核桃青皮提取物对乳腺癌MCF-7细胞增殖、凋亡及EGFR/MAPK信号通路的影响Δ
2022-08-03张硕稳杜志兴庞建民李瑞池刘永建郑丽华
张硕稳,李 丹,贺 静,杜志兴,庞建民,李瑞池,刘永建#,郑丽华
(1.河北医科大学第一医院健康管理中心,石家庄 050000; 2.河北医科大学第一医院普外科,石家庄 050000)
乳腺癌是一种异质性疾病,被认为是世界女性中发病率和病死率较高的一种恶性肿瘤[1]。根据国际癌症研究机构2018年发布的全球统计数据,乳腺癌的发病患者占所有恶性肿瘤的11.6%,乳腺癌为仅次于肺癌的全球第二大常见恶性肿瘤[2]。尽管在诊断和联合治疗方面取得了进步,但乳腺癌患者的预后仍然不令人满意[3]。近年来,随着中医药的快速发展,越来越多的天然产物被发现具有抗肿瘤作用[4]。据研究报道,核桃青皮中具有多种药理活性成分,如核桃多糖、胡桃醌和鞣花酸等,具有抗菌、镇痛和抑癌等功效[5-6]。高杨等[7]的研究结果表明,核桃青皮提取物可显著抑制胃癌细胞的增殖和转移,可能是胃癌预防的潜在治疗药物。然而,核桃青皮提取物在乳腺癌中是否有相同的功效还未可知。表皮生长因子受体(EGFR)/丝裂原活化蛋白激酶(MAPK)信号通路为细胞中重要的调控机制,且已证实抑制EGFR/MAPK通路可诱导乳腺癌MCF-7细胞凋亡[8]。推测核桃青皮提取物可能通过抑制EGFR/MAPK信号通路抑制乳腺癌细胞增殖,诱导细胞凋亡。为验证该猜想,进行了以下研究,以期为乳腺癌的治疗提供帮助。
1 材料
1.1 实验细胞
人乳腺癌MCF-7细胞(批号为CM-H061),购自美国模式培养物保藏中心(ATCC)。
1.2 仪器
LT-CIX90型CO2细胞培养箱、DG5031型酶标仪,均购自上海立德泰勀科学仪器有限公司;M205FA型显微镜、Attune NxT型流式细胞仪、GIS-300型凝胶成像系统,均购自北京昊诺斯科技有限公司。
1.3 药品与试剂
核桃青皮提取物(原料药,纯度≥98%,批号为WJ-6013R)购自西安四叶草生物科技有限公司;盐酸阿霉素(原料药,纯度99%,批号为25219-27,实验时用完全培养液稀释成浓度为0.01 mg/mL)购自山东永信中和生物科技有限公司;DEME培养基(批号为LM-P0523)、细胞计数试剂盒-8(CCK-8)增殖检测试剂盒(批号为LM-K0149),均购自上海联迈生物公司;EGFR激动剂(NSC228155,批号为HY-10142)购自美国MedChemExpress公司;TUNEL红色荧光原位凋亡检测试剂盒(批号为A209-11)、Annexin V-FITC/PI凋亡检测试剂盒(批号为A315-14),均购自南京诺唯赞生物科技股份有限公司;高效RIPA细胞快速缓冲液(批号为R4512)、BCA蛋白浓度测定试剂盒(批号为PC01595)和ECL超敏发光液(批号为PE0615-28),均购自北京索莱宝科技有限公司;鼠抗人细胞周期蛋白D1(CyclinD1,批号为ab170099)、增殖细胞核抗原(PCNA,批号为ab52894)、B细胞淋巴瘤2(Bcl-2,批号为ab40815)、Bcl-2相关X蛋白(Bax,批号为ab201015)、EGFR(批号为ab32503)、磷酸化EGFR(p-EGFR,批号为ab219584)、胞外信号调节激酶(ERK,批号为ab92552)、磷酸化ERK(p-ERK,批号为ab182858)、p38丝裂原活化蛋白激酶(p38 MAPK,批号为ab179461)、磷酸化p38 MAPK(p-p38 MAPK,批号为ab184699)、c-Jun氨基端蛋白激酶(JNK,批号为ab16713)、磷酸化JNK(p-JNK,批号为ab60124)和甘油醛-3-磷酸脱氢酶(GAPDH,批号为ab00129)单克隆抗体、鼠抗人二抗(批号为ab00258),均购自美国Abcam公司。
2 方法
2.1 细胞培养
乳腺癌MCF-7细胞在含10%胎牛血清的DEME培养基中培养,培养条件为37 ℃、5%CO2的湿润培养箱,至细胞融合度>70%,进行传代培养,选择传3代对数期生长的细胞进行后续研究。
2.2 CCK-8检测不同浓度核桃青皮提取物对乳腺癌MCF-7细胞增殖的影响
将对数期生长的乳腺癌MCF-7细胞接种于96孔板中(5×103个/孔),待细胞贴壁生长后,更换为含不同浓度梯度的核桃青皮提取物(0、5、10、20、40和80 μg/mL)的培养基培养48 h。依次向每孔中添加CCK-8溶液10 μL,继续培养2 h后使用酶标仪检测各孔乳腺癌MCF-7细胞在450 nm波长处的吸光度(OD),计算细胞增殖率。细胞增殖率=OD实验组/OD对照组×100%,实验组为不同浓度梯度的核桃青皮提取物组,对照组为0 μg/mL核桃青皮提取物组。各组均设6个平行样。
2.3 细胞分组
将对数期生长的乳腺癌MCF-7细胞依次分为空白对照组、阳性对照组、核桃青皮提取物低浓度组、核桃青皮提取物高浓度组和核桃青皮提取物高浓度+NSC228155组。空白对照组细胞不进行任何处理,正常培养48 h;阳性对照组细胞使用含0.01 mg/mL盐酸阿霉素[9]的培养基培养48 h;核桃青皮提取物低、高浓度组细胞分别使用含20、40 μg/mL核桃青皮提取物的培养基培养48 h;核桃青皮提取物高浓度+NSC228155组细胞使用含40 μg/mL核桃青皮提取物和100 μmol/L NSC228155[10]的培养基培养48 h。各组均设6个平行样。通过“2.2”项下方法,采用CCK-8检测各组乳腺癌MCF-7细胞增殖情况。
2.4 集落形成实验检测各组乳腺癌MCF-7细胞集落形成数量
将经过“2.3”项下方法处理的各组乳腺癌MCF-7细胞接种于培养皿中(1×102个/皿),以十字线方向轻轻晃动培养皿,使细胞均匀分散。将培养皿置于培养箱中培养2~3周,期间根据培养基pH变化更换培养基;直至出现肉眼可见的克隆时,中止培养。吸出培养基后干燥。添加甲醇固定15 min,后使用Giemsa染色10 min,轻轻冲洗掉染色液,干燥后于显微镜中拍照并对>50个细胞克隆数的集落进行计数。
2.5 TUNEL法检测各组乳腺癌MCF-7细胞凋亡水平
将经过“2.3”项下方法处理的各组乳腺癌MCF-7细胞制备形成5×107个/mL的悬浮液,吸取100 μL接种至细胞爬片上,待爬满细胞后使用磷酸盐缓冲液(PBS)轻轻冲洗细胞,添加甲醇固定15 min。之后严格按照TUNEL红色荧光原位凋亡检测试剂盒说明进行操作。在显微镜下观察,并统计凋亡细胞数量,TUNEL阳性细胞率=每个视野中凋亡细胞数/总细胞数×100%。
2.6 流式细胞仪检测各组乳腺癌MCF-7细胞凋亡率
将经过“2.3”项下方法处理的各组乳腺癌MCF-7细胞接种于6孔细胞培养板中(1×105个/孔),培养24 h,使用PBS洗涤细胞,将细胞悬浮于结合缓冲液中,并添加Annexin V-FITC和碘化丙啶(PI)各5 μL,于4 ℃下避光孵育30 min,使用结合缓冲液洗涤3次以去除多余的染料,后重悬于500 μL的结合缓冲液中,在1 h内使用流式细胞仪分析各组乳腺癌MCF-7细胞的凋亡率。
2.7 蛋白免疫印迹法检测各组乳腺癌MCF-7细胞中增殖、凋亡及EGFR/MAPK信号通路相关蛋白的表达水平
使用高效RIPA细胞快速缓冲液提取按照“2.3”项下方法处理的各组乳腺癌MCF-7细胞总蛋白,经BCA蛋白浓度测定试剂盒进行定量。通过电泳分离蛋白,然后转移至聚偏氟乙烯膜上,使用TBST配制的5%牛血清白蛋白封闭1 h,将聚偏氟乙烯膜与CyclinD1、PCNA、Bax、Bcl-2、p-EGFR、EGFR、p-ERK、ERK、p-p38 MAPK、p38 MAPK、p-JNK、JNK和GAPDH一抗(均为1∶1 000)在4 ℃下孵育过夜。隔日洗膜3次后添加鼠抗人二抗(1∶3 000)室温(25 ℃)孵育1 h。最后,使用ECL超敏发光液可视化免疫印迹,采用Image J软件分析蛋白质印迹的灰度值。
2.8 统计学方法
3 结果
3.1 不同浓度核桃青皮提取物对乳腺癌MCF-7细胞增殖的影响
使用不同浓度核桃青皮提取物干预乳腺癌MCF-7细胞,结果显示,当核桃青皮提取物浓度<20 μg/mL时,各浓度下细胞增殖率的差异均无统计学意义(P>0.05);当核桃青皮提取物浓度≥20 μg/mL时,细胞增殖率显著降低,与0 μg/mL比较,差异有统计学意义(P<0.05),见表1。故选择20、40 μg/mL分别为低、高浓度核桃青皮提取物处理浓度。
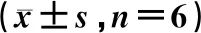
表1 不同浓度的核桃青皮提取物对乳腺癌MCF-7细胞增殖的影响
3.2 各组乳腺癌MCF-7细胞增殖率和集落形成数量比较
与空白对照组相比,阳性对照组、核桃青皮提取物低浓度组和高浓度组细胞增殖率、细胞集落形成数量均显著降低,差异均有统计学意义(P<0.05);与阳性对照组相比,核桃青皮提取物低浓度组细胞增殖率、集落形成数量升高,差异有统计学意义(P<0.05);而核桃青皮提取物高浓度组细胞增殖率、集落形成数量与阳性对照组的差异无统计学意义(P>0.05);与核桃青皮提取物低浓度组相比,核桃青皮提取物高浓度组细胞增殖率、集落形成数量降低,差异有统计学意义(P<0.05);与核桃青皮提取物高浓度组相比,核桃青皮提取物高浓度+NSC228155组细胞增殖率、集落形成数量升高,差异有统计学意义(P<0.05),见图1、表2。

A.空白对照组;B.阳性对照组;C.核桃青皮提取物低浓度组;D.核桃青皮提取物高浓度组;E.核桃青皮提取物高浓度+NSC228155组A.blank control group; B.positive control group; C.walnut green husk extract low concentration group; D.walnut green husk extract high concentration group; E.walnut green husk extract high concentration+NSC228155 group
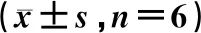
表2 五组乳腺癌MCF-7细胞增殖率和集落形成数量比较
3.3 各组乳腺癌MCF-7细胞凋亡情况比较
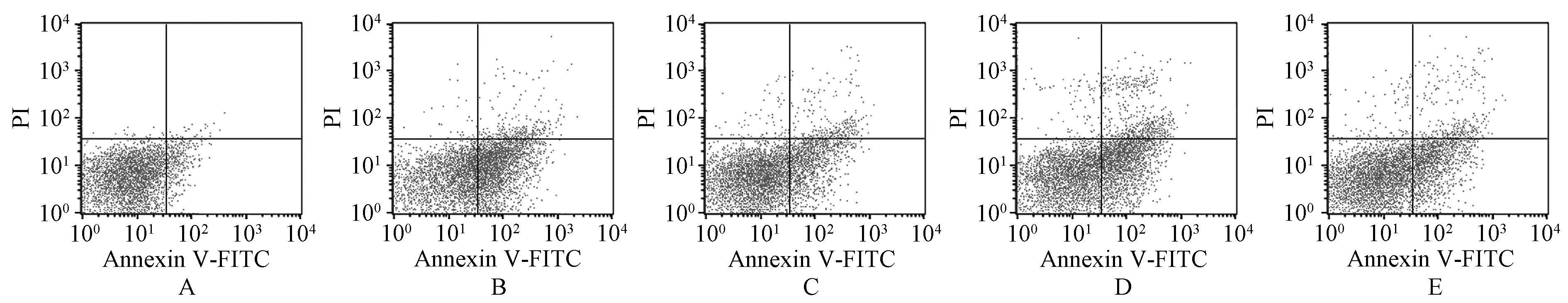
与空白对照组相比,阳性对照组、核桃青皮提取物低浓度组和高浓度组TUNEL阳性细胞率、细胞凋亡率均显著升高,差异均有统计学意义(P<0.05);与阳性对照组相比,核桃青皮提取物低浓度组TUNEL阳性细胞率、细胞凋亡率降低,差异有统计学意义(P<0.05);而核桃青皮提取物高浓度组TUNEL阳性细胞率、细胞凋亡率与阳性对照组的差异无统计学意义(P>0.05);与核桃青皮提取物低浓度组相比,核桃青皮提取物高浓度组TUNEL阳性细胞率、细胞凋亡率升高,差异有统计学意义(P<0.05);与核桃青皮提取物高浓度组相比,核桃青皮提取物高浓度+NSC228155组TUNEL阳性细胞率、细胞凋亡率降低,差异有统计学意义(P<0.05),见图2—3、表3。

A.空白对照组;B.阳性对照组;C.核桃青皮提取物低浓度组;D.核桃青皮提取物高浓度组;E.核桃青皮提取物高浓度+NSC228155组A.blank control group; B.positive control group; C.walnut green husk extract low concentration group; D.walnut green husk extract high concentration group; E.walnut green husk extract high concentration+NSC228155 group
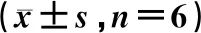
表3 五组乳腺癌MCF-7细胞TUNEL阳性细胞率和细胞凋亡率比较
3.4 各组乳腺癌MCF-7细胞中增殖、凋亡相关蛋白表达水平比较
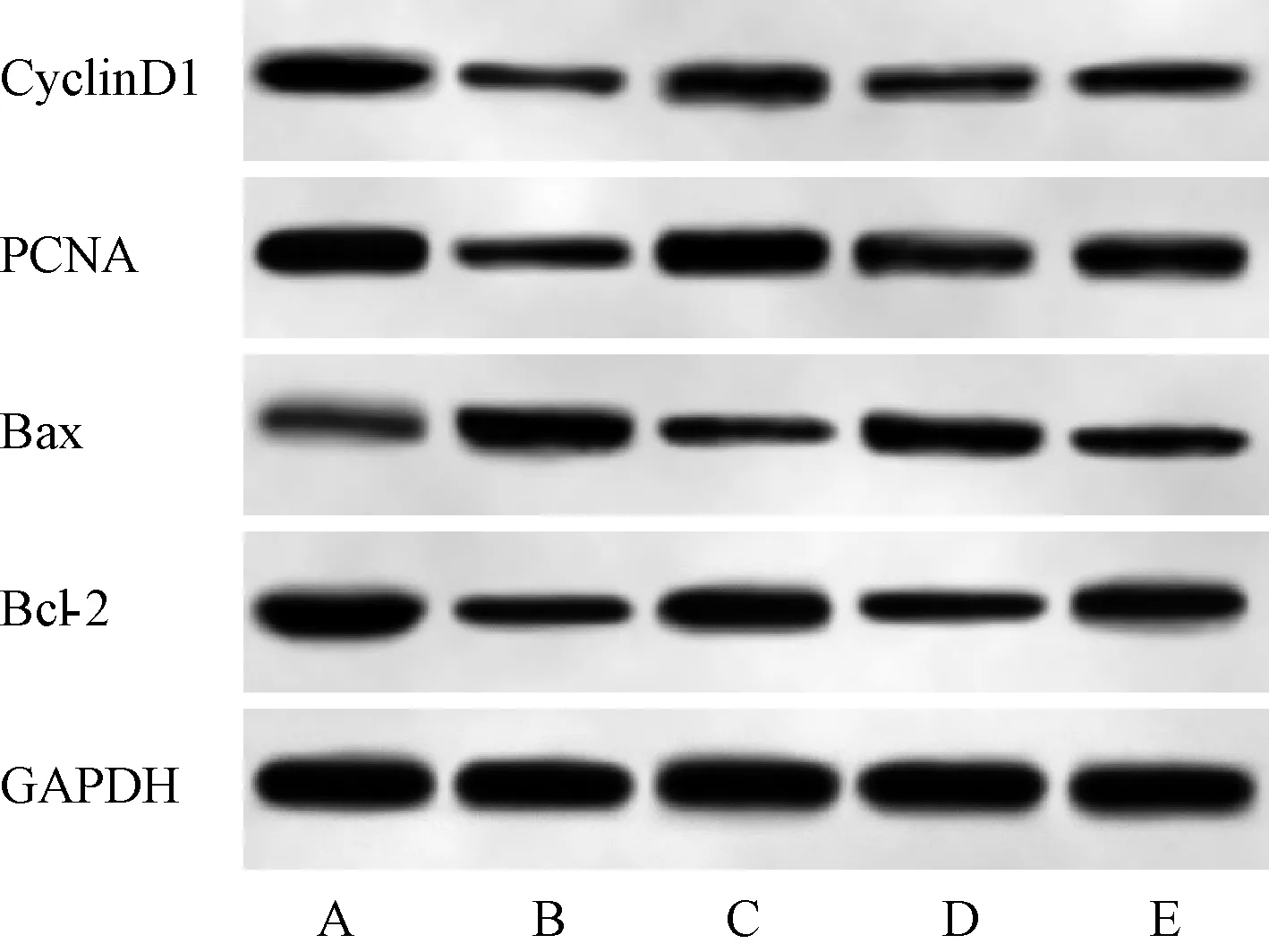
与空白对照组相比,阳性对照组、核桃青皮提取物低浓度组和高浓度组乳腺癌MCF-7细胞中CyclinD1、PCNA和Bcl-2蛋白表达水平显著降低,Bax蛋白表达水平显著升高,差异均有统计学意义(P<0.05);与阳性对照组相比,核桃青皮提取物低浓度组乳腺癌MCF-7细胞中CyclinD1、PCNA和Bcl-2蛋白表达水平升高,Bax蛋白表达水平降低,差异均有统计学意义(P<0.05);而核桃青皮提取物高浓度组乳腺癌MCF-7细胞中CyclinD1、PCNA、Bax和Bcl-2蛋白表达水平与阳性对照组的差异均无统计学意义(P>0.05);与核桃青皮提取物低浓度组相比,核桃青皮提取物高浓度组乳腺癌MCF-7细胞中CyclinD1、PCNA和Bcl-2蛋白表达水平降低,Bax蛋白表达水平升高,差异均有统计学意义(P<0.05);与核桃青皮提取物高浓度组相比,核桃青皮提取物高浓度+NSC228155组乳腺癌MCF-7细胞中CyclinD1、PCNA和Bcl-2蛋白表达水平升高,Bax蛋白表达水平降低,差异均有统计学意义(P<0.05),见图4—5。
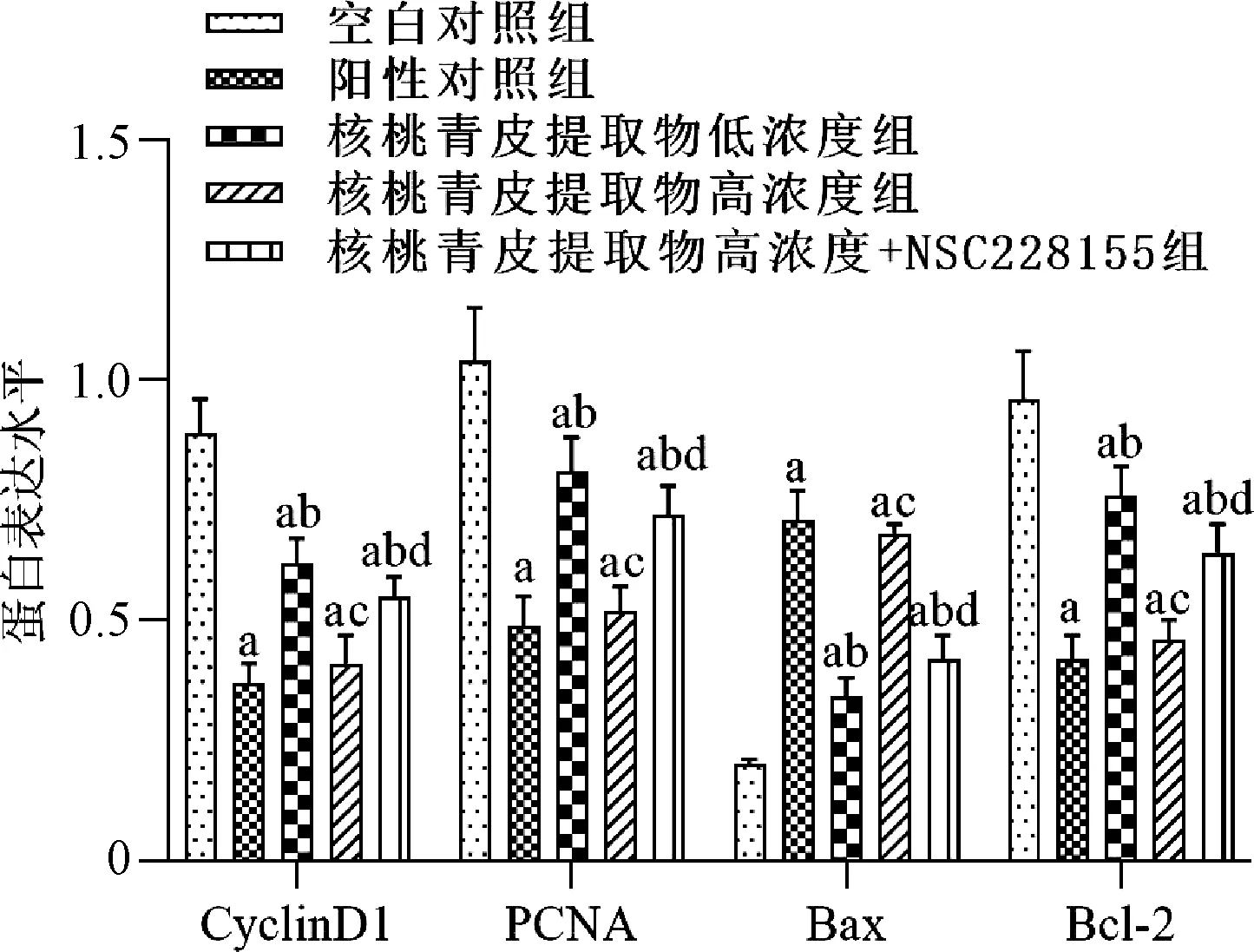
与空白对照组比较,aP<0.05;与阳性对照组比较,bP<0.05;与核桃青皮提取物低浓度组比较,cP<0.05;与核桃青皮提取物高浓度组比较,dP<0.05Note: vs. the blank control group, aP<0.05; vs. the positive control group, bP<0.05; vs. the walnut green husk extract low concentration group, cP<0.05; vs. the walnut green husk extract high concentration group, dP<0.05
A.空白对照组;B.阳性对照组;C.核桃青皮提取物低浓度组;D.核桃青皮提取物高浓度组;E.核桃青皮提取物高浓度+NSC228155组A.blank control group; B.positive control group; C.walnut green husk extract low concentration group; D.walnut green husk extract high concentration group; E.walnut green husk extract high concentration+NSC228155 group
A.空白对照组;B.阳性对照组;C.核桃青皮提取物低浓度组;D.核桃青皮提取物高浓度组;E.核桃青皮提取物高浓度+NSC228155组A.blank control group; B.positive control group; C.walnut green husk extract low concentration group; D.walnut green husk extract high concentration group; E.walnut green husk extract high concentration+NSC228155 group
3.5 各组乳腺癌MCF-7细胞中EGFR/MAPK信号通路相关蛋白表达水平比较
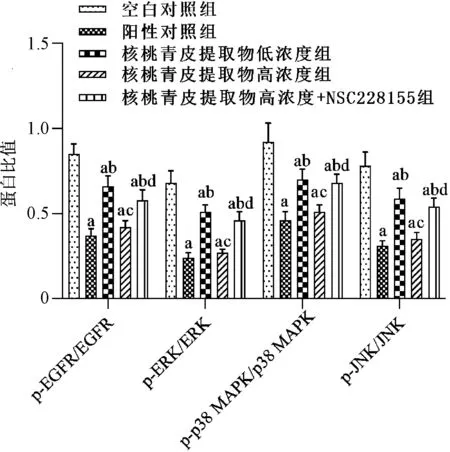
与空白对照组相比,阳性对照组、核桃青皮提取物低浓度组和高浓度组乳腺癌MCF-7细胞中p-EGFR/EGFR、p-ERK/ERK、p-p38 MAPK/p38 MAPK和p-JNK/JNK蛋白比值显著降低,差异均有统计学意义(P<0.05);与阳性对照组相比,核桃青皮提取物低浓度组乳腺癌MCF-7细胞中p-EGFR/EGFR、p-ERK/ERK、p-p38 MAPK/p38 MAPK和p-JNK/JNK蛋白比值升高,差异均有统计学意义(P<0.05);而核桃青皮提取物高浓度组乳腺癌MCF-7细胞中p-EGFR/EGFR、p-ERK/ERK、p-p38 MAPK/p38 MAPK和p-JNK/JNK蛋白比值与阳性对照组的差异均无统计学意义(P>0.05);与核桃青皮提取物低浓度组相比,核桃青皮提取物高浓度组乳腺癌MCF-7细胞中p-EGFR/EGFR、p-ERK/ERK、p-p38 MAPK/p38 MAPK和p-JNK/JNK蛋白比值降低,差异均有统计学意义(P<0.05);与核桃青皮提取物高浓度组相比,核桃青皮提取物高浓度+NSC228155组p-EGFR/EGFR、p-ERK/ERK、p-p38 MAPK/p38 MAPK和p-JNK/JNK蛋白比值升高,差异均有统计学意义(P<0.05),见图6—7。

A.空白对照组;B.阳性对照组;C.核桃青皮提取物低浓度组;D.核桃青皮提取物高浓度组;E.核桃青皮提取物高浓度+NSC228155组A.blank control group; B.positive control group; C.walnut green husk extract low concentration group; D.walnut green husk extract high concentration group; E.walnut green husk extract high concentration+NSC228155 group
4 讨论
核桃青皮中富含多种生物活性成分,如胡桃醌可抑制卵巢癌细胞增殖、转移并诱导其凋亡,抗肿瘤效果较好[11];核桃青皮提取物对包括胃癌[7]、肺癌[12]在内的多种恶性肿瘤具有一定的抑制作用。本研究通过使用不同浓度的核桃青皮提取物干预乳腺癌MCF-7细胞,筛选出合适的核桃青皮提取物处理浓度。经对核桃青皮提取物干预后的乳腺癌MCF-7细胞增殖、凋亡检测发现,核桃青皮提取物可明显降低乳腺癌MCF-7细胞的增殖能力,提高细胞凋亡能力,且随着核桃青皮提取物浓度的升高,其影响作用也随之增加。该结果表明,核桃青皮提取物可能通过抑制乳腺癌MCF-7细胞增殖、诱导细胞凋亡,进而发挥抑癌作用。为验证该结果,本研究添加临床抗肿瘤药盐酸阿霉素作为阳性对照,结果发现,低浓度的核桃青皮提取物对乳腺癌MCF-7细胞增殖、凋亡的作用小于盐酸阿霉素,高浓度的核桃青皮提取物对乳腺癌MCF-7增殖、凋亡的作用与盐酸阿霉素相当,表明在乳腺癌MCF-7细胞中,高浓度的核桃青皮提取物与盐酸阿霉素的功效类似,均具有抑制乳腺癌MCF-7细胞增殖、促进细胞凋亡的作用,但其如何在乳腺癌MCF-7细胞中发挥作用,还未可知。
与空白对照组比较,aP<0.05;与阳性对照组比较,bP<0.05;与核桃青皮提取物低浓度组比较,cP<0.05;与核桃青皮提取物高浓度组比较,dP<0.05Note: vs. the blank control group, aP<0.05; vs. the positive control group, bP<0.05; vs. the walnut green husk extract low concentration group, cP<0.05; vs. the walnut green husk extract high concentration group, dP<0.05
MAPK信号通路已被认为是抗恶性肿瘤治疗的有效级联通路,MAPK为丝氨酸/苏氨酸激酶,将其特定底物磷酸化为丝氨酸和(或)苏氨酸残基,以调节基因表达、有丝分裂、增殖、运动、代谢和程序性细胞凋亡[13]。MAPK通路具有3个亚通路,包括ERK、JNK和p38 MAPK亚通路,据报道,ERK通路对细胞存活很重要,而JNK和p38 MAPK则与细胞的凋亡相关[14]。已有研究结果证实,阻断p38 MAPK通路可在一定程度上减少白细胞介素32诱导的上皮间充质转化标志物的表达和乳腺癌细胞的侵袭及转移[15]。此外,调节细胞存活/死亡的途径还涉及EGFR通路,EGFR为受体酪氨酸激酶,通过各种下游信号通路被激活以促进细胞增殖、运动和存活[16];且已有研究结果证实,EGFR为三阴性乳腺癌治疗的靶点[17]。因此,抑制EGFR/MAPK通路可能是治疗乳腺癌的一种新策略。本研究结果发现,低浓度和高浓度的核桃青皮提取物可下调EGFR、ERK、p38 MAPK和JNK的磷酸化水平,表明核桃青皮提取物可能通过抑制EGFR/MAPK通路抑制乳腺癌MCF-7细胞的增殖,并诱导细胞凋亡。同时,添加EGFR通路激动剂可有效逆转核桃青皮提取物对乳腺癌MCF-7细胞增殖、凋亡及EGFR/MAPK通路的影响。此外,本研究结果亦发现,核桃青皮提取物可明显抑制乳腺癌MCF-7细胞中CyclinD1、PCNA和Bcl-2蛋白表达,促进Bax蛋白表达。已知CyclinD1、PCNA是与增殖相关的蛋白,二者的表达水平可在一定程度上反映细胞的增殖能力;Bcl-2和Bax为凋亡过程中的一对关键因子,上调Bax水平、下调Bcl-2水平可有效促进细胞凋亡[18]。以上结果表明,核桃青皮提取物通过抑制EGFR/MAPK通路调控增殖、凋亡相关蛋白水平,从而抑制乳腺癌MCF-7细胞增殖,促进细胞凋亡。
综上所述,核桃青皮提取物通过抑制EGFR/MAPK信号通路对乳腺癌MCF-7细胞发挥抑制其增殖、促进其凋亡的作用,并可能与调控增殖、凋亡相关蛋白有关,为乳腺癌的预防和治疗提供了新的思路。但本研究并未探究是否还有其他通路参与核桃青皮提取物对乳腺癌MCF-7细胞增殖、凋亡的作用,以及EGFR/MAPK信号通路是否直接调控增殖、凋亡相关的蛋白发挥作用,后续将从这两个方向重点探究,以完善核桃青皮提取物的功效。
