北京海坨山典型林分土壤固氮菌群落特征研究
2022-08-03聂立水魏一凡张润哲聂浩亮薄慧娟
史 策,聂立水*,魏一凡,祝 琳,杨 昊,张润哲,聂浩亮,王 江,薄慧娟
(1.北京林业大学林学院,北京 100083;2.河北农林科学院农业资源与环境研究所,河北 石家庄 050051;3.成都市青白江区农业农村局,四川 成都 610300;4.山西农业大学资源环境学院,山西 晋中 030000)
固氮菌是森林生态系统中重要的功能菌群,它通过固氮酶的作用把大气中分子态氮还原为植物可利用态氮[1-2],为植物生长提供氮素营养。固氮菌在森林生态系统氮循环,尤其是土壤氮循环中具有重要作用,其群落多样性及结构组成是土壤氮素固定及维持氮循环平衡的重要指标[3-4]。研究森林土壤固氮菌群落多样性及组成可对提高土壤氮素水平和森林土壤氮循环机理提供新认识,可为森林植被恢复和森林经营提供科学依据。
已有研究表明固氮菌群落与植被类型、土壤特性等因素有互作效应[5-7]。植物群落通过凋落物和根系分泌物等影响固氮菌的种类和丰度,而固氮菌通过改变土壤环境、土壤养分矿化等方式影响植物群落[8]。Templer 研究表明不同树种土壤氮保留能力显著差异[9],并且在不同植被类型下土壤固氮菌群落存在显著差异[10]。土壤中的碳、氮含量及碳氮比显著影响土壤固氮菌的活性及分布[5,7,11-13]。相较传统研究方法,高通量测序技术由于其精确性而被广泛应用于微生物的研究中[14-15],对于高通量测序检测土壤固氮菌通常选用nifH作为分子标记基因,因其是编码铁蛋白组分的基因且高度保守,在固氮微生物中都可以检测到[16]。
北半球温带森林在调节全球碳平衡和减缓全球气候变化进程中扮演着重要角色[17-19],华北地区是我国暖温带落叶阔叶林的重要分布区域,北京松山自然保护区是华北地区内保持完好,植被类型典型且丰富的自然保护区之一[20],油松林(Pinus tabuliformis Carriere.)是保护区最具代表性的植被类型,区内还分布有核桃楸(Juglans mandshurica Maxim.)、山杨(Populus davidiana Dode.)、白桦(Betula platyphylla Suk.)、蒙古栎(Quercus mongolica Fisch.)等常见暖温带落叶阔叶林[21]。目前已有对该地区不同林分类型下土壤细菌和真菌的研究报道[22],然而对不同林分下土壤固氮微生物群落特征及其与土壤理化性质之间相互关系的研究未见报道。
本研究以北京松山国家级自然保护区内4种典型林分(油松林、针阔混交林、蒙古栎林、核桃楸林)下土壤为研究对象,以固氮酶铁蛋白nifH 基因为分子靶标[23-24],采用Illumina MiSeq技术分析不同林分类型下土壤固氮菌的群落特征,探讨该地区固氮菌群落的多样性和结构组成及与其土壤特性的关系,为了解土壤氮循环提供基础数据,同时为发挥暖温带森林土壤潜力和森林植被恢复重建等提供科学依据。
1 研究区概况
研究区位于北京市延庆区松山国家级自然保护区(115°43′44″~115°50′22″ E,40°29′9″~40°33′35″ N)。该区域位处燕山山脉海坨山南麓,海拔628~2 198 m,属暖温带大陆性气候,年平均气温8.9 ℃,年平均日照时数2 836 h,年蒸发量1 772 mm,年降水量493 mm[20]。保护区内成土母岩多为花岗岩,主要土壤类型为山地棕壤、山地褐土和山地草甸土。保护区内植被类型丰富,包括草甸、灌木、乔木等,森林覆盖率高达87.6%。保护区内主要乔木为:白桦林、油松林、山杨林、核桃楸林、针阔混交林等。
2 研究方法
2.1 样地设置
依据研究区内油松林、针阔混交林、蒙古栎林和核桃楸林4种典型林分类型分布情况,在每种林型下设面积为20 m×20 m 3块标准地,共12块。分别对所选样地进行相关因子调查,样地基本概况见表1。样地中土壤类型均为山地棕壤,石砾较少,多为壤土、碎屑类结构,成土母质均为坡积母质,林龄均为成熟林,林分起源均为天然林。
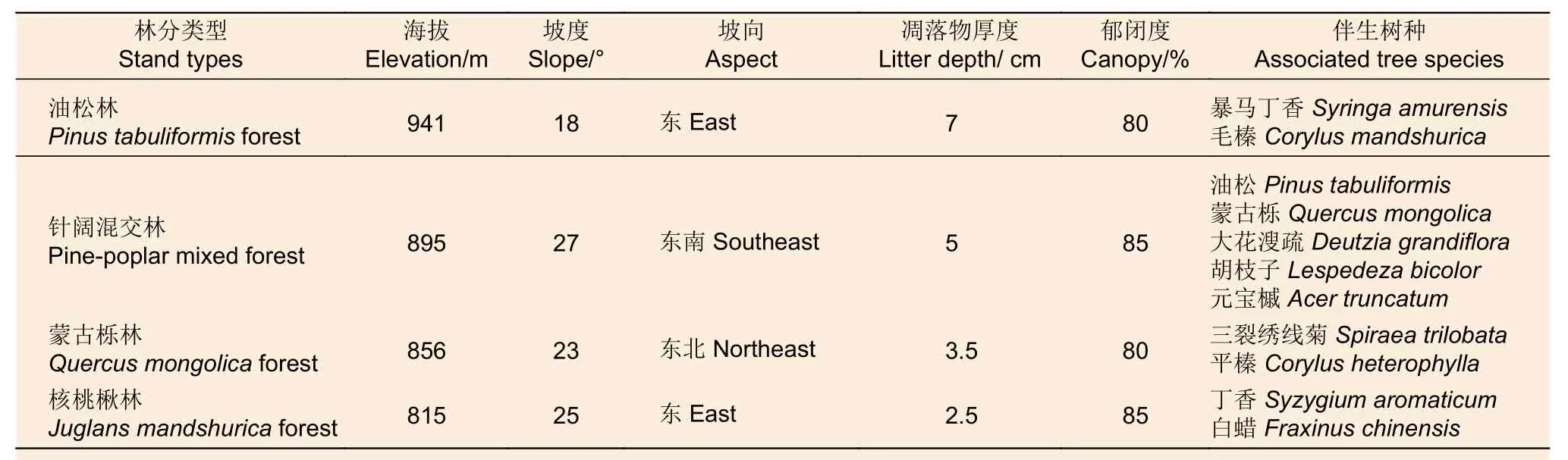
表1 样地基本概况Table 1 General characteristics of forest stands
2.2 野外调查与采样
于2019年7月进行野外调查和样品采集。在不同林型下随机设置3块20 m×20 m 的标准样地,按五点法采集0~20 cm土样,去除土样内凋落物和石砾,混合均匀后用四分法取100 g左右的土,装入无菌自封袋中,共计12份土样放入便携式冰箱带回实验室。一部分放入−60 ℃冰箱保存,余下风干研磨用作土壤特性分析。
2.3 土壤理化性质测定
土壤特性采用常规分析方法:土壤pH 测定采用酸度计法;土壤全氮测定采用凯氏定氮法;土壤碱解氮测定采用碱解扩散法;土壤有效磷测定采用钼蓝比色法;土壤速效钾测定采用醋酸铵-火焰光度计法;土壤有机质测定采用重铬酸钾-外加热法[25]。
2.4 DNA提取及PCR扩增
使用Omega Mag-bind soil DNA kit提取土壤微生物总DNA,合格后样品保存于−80 ℃冰箱用于PCR扩增。扩增引物选择nifH-F(5′-AAAGGYG GWATCGGYAARTCCACCAC-3′)和nifH-R(5′-TTGTTSGCSGCRTACATSGCCATCAT-3 ′)[26],对fungene-nifH区域进行扩增。每个样品重复扩增3次,扩增后的序列委托上海派森诺生物有限公司进行测定。PCR 反应体系:5×缓冲液 5 μL;dNTP(2.5 mM)2 μL;正向引物(10 uM)1 μL;反向引物(10 uM)1 μL;DNA 模板 1 μL;超纯水 14.75 μL;快速 pfu DNA 聚合酶 0.25 μL。PCR扩增条件:98 ℃ 预变性 5 min;98 ℃ 变性 30 s,63.7 ℃ 退火 30 s,72 ℃ 延伸 45 s,共 35个循环;72 ℃ 延伸 5 min。PCR 反应后,取 5 μL 产物进行1.0% 琼脂糖凝胶电泳检测。
2.5 数据处理与统计分析
根据序列质量初步筛选出高通量测序的原始离线数据,并把数据上传至NCBI平台,序号为:SUB10898702。QIIME2 DADA2分析进行OTU聚类。采用CD-HIT方法,根据97% 的相似性对OTU进行分类,以获得每个OTU对应的物种分类信息,利用QIIME分析微生物α和β多样性,在门和属分类水平上比较不同林型土壤固氮菌群落结构组成差异。试验数据处理采用Excel、SPSS24.0和R完成。采用单因素方差分析(one-way ANOVA),Duncan 法比较不同林型的土壤特性、固氮菌多样性的差异(p<0.05)。采用 Pearson相关系数评价固氮菌多样性与土壤特性之间的相关关系。采用冗余分析(RDA)检验固氮菌结构组成与土壤特性的关系。采用 Spearman 相关性检验,分析优势固氮菌和土壤特性的相关性,运用关联热图展现微生物群落组成与土壤特性的关系。
3 结果
3.1 不同林分类型下土壤特性
不同林分类型的土壤特性见表2。方差分析和多重比较表明,土壤有机质、全氮及速效钾在4种林型之间均有显著差异,碱解氮含量表现为:针阔混交林 > 油松林 > 核桃楸林 > 蒙古栎林,有效磷含量表现为:核桃楸林 > 蒙古栎林 > 针阔混交林 > 油松林。

表2 不同林分类型下土壤特性Table 2 Soil properties of forest stands
3.2 不同林分类型下土壤固氮菌多样性
3.2.1 不同林分类型下土壤固氮菌α多样性 不同林分类型下土壤固氮菌α多样性指数的统计结果见表3,Chao1指数由高到低表现为:油松林 >针阔混交林 > 核桃楸林 > 蒙古栎林,核桃楸林和蒙古栎林之间差异不显著(p<0.05)。Shannon指数由高到低表现为:油松林 > 针阔混交林 > 核桃楸林 > 蒙古栎林,针阔混交林和核桃楸林之间差异不显著(p<0.05)。

表3 不同林分类型下土壤固氮菌α多样性指数Table 3 Alpha diversity index of soil nitrogen-fixing bacteria of forest stands
3.2.2 不同林分类型下土壤固氮菌β多样性 为进一步明晰样本间在群落物种组成上的差异性,基于Bray-Curtis距离算法并采用 PCoA 分析衡量4种林型土壤固氮菌群落物种组成的相似度。图1表明,每种林型的3个重复均聚类于同一象限,且每种林分集合间距较大,PCo1 和PCo2分别解释变量方差的41.7%、21.5%,两者累计贡献率达63.2%。表明4种林分类型下土壤固氮菌群落组间差异远大于组内差异。

图1 不同林型下土壤固氮菌群落主坐标分析(PCoA)Fig.1 Principal coordinate analysis (PCoA) analysis of soil nitrogen-fixing bacteria of different forest stands
3.3 不同林分类型下土壤固氮菌群落组成及丰度差异物种分析
为解析不同林型下土壤固氮菌群落结构的变异规律,对聚类后的 OTU 代表序列进行物种注释。4种林型土壤样品中的 OTU 隶属于 4 门 6 纲 13目 16 科 29 属。将相对丰度低于 1% 以及在该水平上没有注释结果的归于 Others。4种林型土壤固氮菌在门和属水平上的群落组成见图2。
在门分类水平上(图2A),4种林型土壤固氮菌均以变形菌门 (Proteobacteria)为主,其相对丰度范围是91.87%~73.89%。变形菌门的组成比例在针阔混交林土壤中最高(91.87%),在蒙古栎林中比例最低(73.89%)。同时在4种林型中还含有酸杆菌门(Acidobacteria),其相对丰度范围是7.91%~0.40%。另外,厚壁菌门(Firmicutes)仅存在于油松林和针阔混交林土壤中,含量分别为4.97% 和1.76%。虽然群落组成相似,但是各菌门含量差异显著。
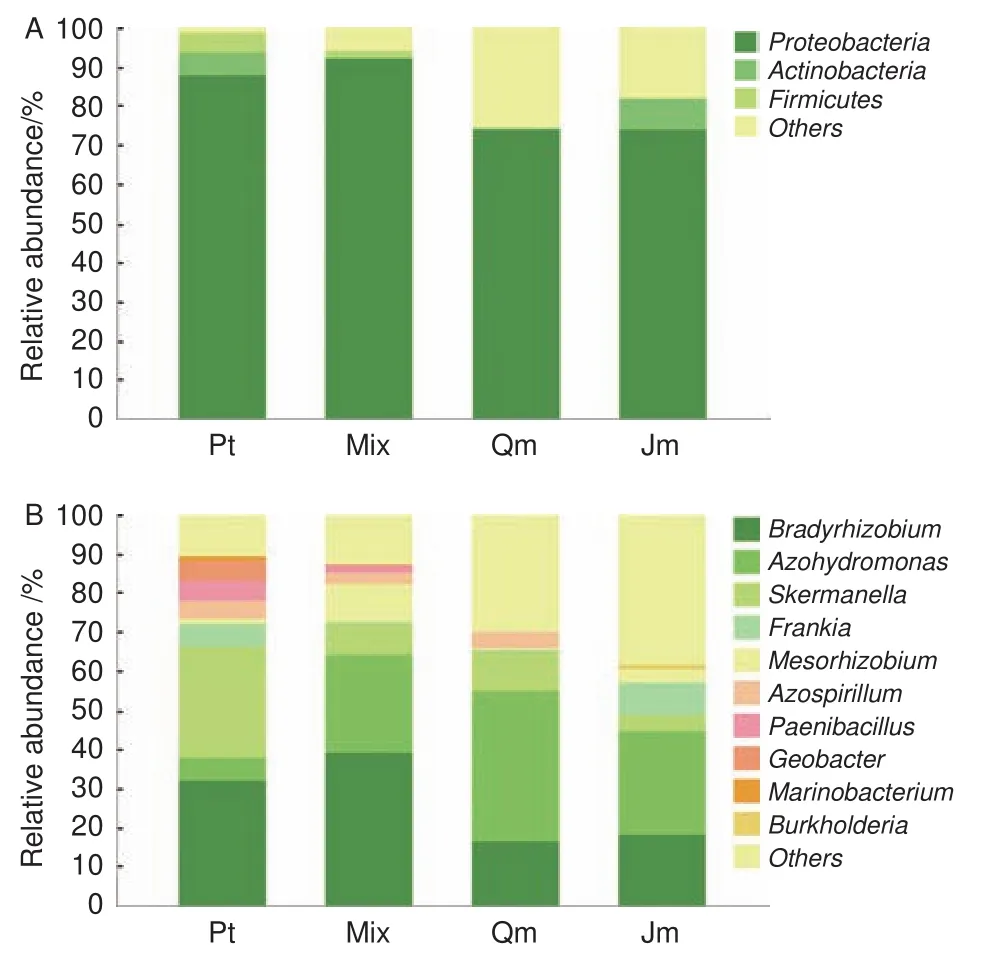
图2 不同林型土壤固氮菌在门和属水平上的群落组成Fig.2 The soil nitrogen-fixing bacteria community compositions of different forest stands on phylum(a) and genus(b) level
在属水平上,取所有样本中平均相对丰度前10 位的菌群,结果表明4种林型下共有菌属为慢生根瘤菌属(Bradyrhizobium),相对丰度为39.24%~16.36%、广泛固氮氢自养单胞菌属(Azohydromonas),相对丰度为38.48%~5.98%、斯克尔曼氏菌属(Skermanella),相对丰度为28.24%~4.41%、弗兰克氏菌属(Frankia),相对丰度为7.91%~0.40%、中生根瘤菌属(Mesorhizobium),相对丰度为9.69%~0.34%、固氮螺菌属(Azospirillum),相对丰度为4.64%~0.17%。地杆菌属(Geobacter)仅存在于油松林和针阔混交林下土壤中,海细菌属(Marinobacterium)仅存在于油松林下土壤中,伯克霍尔德菌属(Burkholderia)仅存在于核桃楸林下土壤中。
按照97%序列相似性划分 OTU,根据 Bray-curtis 指数计算距离,得到相似性矩阵,进行群落结构差异分析。由 Venn 图可见(图3),4 种林型下共有 OTUs 数目为53个。其中,油松林与针阔混交林共有OTUs数目为124个,针阔混交林与蒙古栎林、核桃楸林共有OTUs数目78个,同为阔叶林的蒙古栎林与核桃楸林共有OTUs数目为181个。油松林土壤中所含特有OTUs数量最多为448个,核桃楸林土壤中特有OTUs最少为71个。

图3 不同林型下土壤固氮菌的群落差异分析Fig.3 The variance analysis of soil nitrogen-fixing bacteria community of different forest stands
3.4 不同林型下土壤固氮菌群落与土壤理化因子的关联分析
3.4.1 土壤特性与土壤固氮菌群落多样性的关系土壤特性与固氮菌的α 和β 多样性的相关性分析如表4 所示。固氮菌α多样性与土壤有机质、全氮和速效钾呈极显著正相关,碱解氮与Chao1指数呈极显著正相关,与Shannon指数呈显著正相关,土壤有效磷与Chao1指数呈显著负相关。β多样性数值为相应两个样本之间距离(距离矩阵的类型依据算法参数选择而定)。固氮菌的 β 多样性与土壤有机质和全氮呈极显著负相关,这与α多样性相反,而β 多样性与土壤速效钾呈及显著正相关。

表4 土壤性质和固氮菌群落α和β多样性的相关性系数Table 4 Correlation coefficients between soil properties and α,β diversity of soil nitrogenfixing bacteria community
3.4.2 土壤特性与土壤固氮菌群落组成的关系采用冗余分析(Redundancy analysis,RDA)探究影响4种不同林型下土壤固氮菌群落组成的环境因子(图4)。主成分1(48.85%)和主成分2(16.63%)累计解释土壤固氮菌群落结构变异的65.43%。土壤全氮和有机质是影响土壤固氮菌群落组成的主要土壤特性因子。

图4 不同林型下土壤固氮菌群落与土壤特性的冗余分析Fig.4 Redundancy analysis(RDA)between soil properties and soil nitrogen-fixing bacteria community of different forest stands based on Bray-Curtis
采用Spearman相关性系数分析4种林型土壤特性与土壤固氮菌群落组成的相关性,丰度前20菌属的相关性热图(图5)。其中与土壤速效钾含量呈显著相关的菌属有9个,全氮8个,有机质5个,碱解氮3个,pH 2个。

图5 土壤固氮菌菌属与环境因子的相关性热图Fig.5 Correlation heat maps between the genus of soil nitrogen-fixing bacteria and soil chemical factors.
4 讨论
4.1 不同林分类型下土壤固氮菌多样性及群落结构
不同林分类型的群落结构不同导致凋落物的质量和根系分泌物存在差异,对土壤特性造成影响,从而间接影响固氮菌种间的竞争力,使整个固氮菌的多样性及群落结构发生改变[27-30]。本研究发现,不同林分类型下土壤固氮菌多样性存在显著差异,且油松林下土壤固氮菌多样性最高,这与牛艳芳对贺兰山区和大青山的油松林下土壤固氮菌研究一致[31-32]。固氮菌大部分是异养型微生物,充足的凋落物和丰富的有机质能为固氮菌提供利于它们生长繁殖的养分[33-34],本研究中,油松林下凋落物层厚度厚达7.0 cm,这为固氮菌生长繁殖提供了大量的营养物质。同为落叶阔叶林的蒙古栎林与核桃楸林Shannon指数存在显著差异,PCoA分析固氮菌β多样性也明显区分出不同林型下土壤固氮菌,这说明不同树种形成的林分是决定土壤固氮菌多样性的关键因素。
本研究结果显示,不同林分类型下土壤固氮菌群落组成结构存在显著差异,固氮菌优势门、属各占其总种群的40%以上,不同林型下土壤固氮菌群落组成结构差异主要是由其丰度不同和稀少种不同导致的。不同微生物群落对环境变化和适应能力存在差别,森林的生物固氮功能也会对不同环境做出差别响应,因此造成不同区域优势固氮微生物产生差异。本研究区固氮菌优势菌门为变形菌门,吕雪丽发现亚热带季风气候森林土壤固氮菌优势菌门为酸杆菌门,温带大陆性山地气候蒙古栎林下土壤固氮菌优势菌门为酸杆菌门和变形菌门。本研究中固氮菌优势菌属为慢生根瘤菌属、广泛固氮氢自养单胞菌属和斯克尔曼氏菌属。慢生根瘤菌可以在寄主植物根部膨大生成根瘤,它们可固定大气氮为寄主植物可利用氮,而有些固氮菌会在特定条件下以游离状态固定大气氮[35-36]。尽管斯克尔曼氏菌的基因组内含nifH 基因,但是目前没有发现斯克尔曼氏菌属的物种能够固定N2[37]。
4.2 土壤特性对土壤固氮菌的影响
在相同的气候环境条件下,不同树种的根系分泌物不同及凋落物化学组分和分解速率不同[38-40],导致输入到土壤中的有机养分不同,造成林下土壤特性差异显著。相关研究表明,落叶针叶林的凋落物中含有难以分解的木质素、丹宁、蜡等高分子有机物,导致凋落物分解较为缓慢,累积起来凋落物质量较多,厚重的凋落物层覆盖在土壤表面,从而降低了土壤养分被利用的速率,加速了土壤养分的积累并为固氮菌生长提供养分[41]。本研究中,蒙古栎林下土壤pH为5.87,与其它阔叶林相比,蒙古栎凋落物质量较少,且凋落物中N含量较低、C/N较高、木质素含量较高[42]等因素导致蒙古栎林下土壤pH值偏低。沈秋兰[43]等对阔叶林改种毛竹后土壤固氮菌多样性变化的研究表明,不同树种下土壤固氮菌丰度和群落多样性差异显著,导致这种结果这不仅是地上植物类型的改变,土壤性质差异也是原因之一。森林土壤固氮菌群落多样性和结构的差异主要是不同的土壤条件所造成的,如土壤pH、有机质、全氮和有效磷等[11,44-47]。本研究通过Pearson相关性分析检验固氮菌多样性和土壤环境因子的相关关系,发现土壤特性对不同林型下土壤固氮菌多样性均有不同程度的影响,其中土壤有机质、全氮、碱解氮、有效磷和速效钾均与固氮菌多样性存在相关关系,且大部分土壤特性与固氮菌α多样性呈正相关。这可能说明在一定范围内,土壤有效养分含量与固氮菌α多样性呈正比。以往研究表明土壤pH是影响土壤固氮菌群落结构的重要因子[48],但本研究中,固氮菌多样性和群落结构与土壤pH并没有相关性,有可能是因为试验区土壤pH范围较窄为5.87~6.93。RDA分析显示,土壤特性对土壤固氮菌群落结构变化的解释度为65.43%,土壤全氮和有机质是影响土壤固氮微生物群落组成的主要土壤特性因子。对于固氮菌来说,固氮过程会消耗大量用于生长的碳、氮等能源物质,土壤氮和碳含量不仅是影响土壤固氮菌群落结构和功能的重要因素,而且对调节土壤氮循环起到一定作用[49]。图5表明,不同种类的固氮菌与土壤性质的相关关系结果差异很大,相关性分析表明慢生根瘤菌属(Bradyrhizobium)与土壤全氮、碱解氮和有机质呈正相关关系。研究表明慢生根瘤菌是化能自养型细菌[50],且慢生根瘤菌具有很强的固定CO2的能力[51],并在所有土壤中存在。它可以使用还原态的无机物作为能源,例如NH4+、NO2−、S2−、H2S、H2和Fe2+等作为自养生长的能源。
综上,林分类型、土壤特性、固氮菌三者之间相互影响,存在协同演变机制。然而影响土壤固氮菌的因子还有很多,例如凋落物、季节变化、地理位置、氮沉降等生态环境因子[52],并且微生物群落的分布并非是均匀的[53],不同样点间局部植被和环境的差异可能引发土壤固氮菌性质差异,因此还需要增加重复样品采集数量,多尺度地来探讨其对土壤固氮菌的影响。在今后研究中,有必要综合考虑微生物特征及其影响因素,具体分析固氮菌与植物、土壤之间的耦合机制。
5 结论
不同林分类型下土壤固氮菌群落多样性及结构组成存在显著差异。α多样性分析显示油松林下土壤固氮菌多样性最高,β多样性显示4种林分类型下土壤固氮菌群落组间差异远大于组内差异。本研究区优势菌门为变形菌门,优势菌属为慢生根瘤菌属、广泛固氮氢自养单胞菌属和斯克尔曼氏菌属。冗余分析显示土壤特性能解固氮菌群落结构变异的65.43%,土壤全氮和有机质是影响土壤固氮菌群落组成的主要土壤特性因子。林分类型、土壤特性和土壤固氮菌具有紧密的联系,研究土壤固氮菌的群落多样性及结构组成必须考虑林分类型和土壤性质的影响。
