钢铁酸洗废液铁系颜料制备及改性技术研究进展*
2022-08-02石海信冯洋洋陆贻春陈枚燕
李 根,石海信,冯洋洋,陆贻春,陈枚燕
(1.北部湾大学 石油与化工学院,广西 钦州 535011;2.广西钦州环科水处理有限公司,广西 钦州 535000)
在对钢铁表面镀锌处理时,需要利用H2SO4或HCl洗去钢铁表面的锈斑及油污,由此产生大量的含0.5~60g·L-1的H+、60~250g·L-1的Fe2+、少量Zn2+等金属离子和油污的酸洗废液。随着钢铁行业的发展,酸洗废液呈增加态势,全国年排放量高达106m3[1]。酸洗废液流动性大、腐蚀性强,如不加以处理就排放,会对环境造成严重污染。早在2010年6月,工业和信息化部公布《钢铁行业生产经营规范条件》(工原[2010]第105号)[2],强调钢铁行业环境保护、能源消耗和资源综合利用的重要性。为了落实条件要求,研究人员开展了钢铁酸洗废液无害化与资源化处理的科技攻关工作,其中利用酸洗废液中丰富的亚铁盐资源制备具有高附加值的铁系颜料就是其中一个重要研究课题[3]。铁系颜料的典型代表为氧化铁黄(α-FeOOH)与氧化铁红(α-Fe2O3),由于具有无毒、化学稳定、抗腐蚀、耐候及低成本等特点,成为仅次于钛白粉的第二大无机颜料[4],广泛应用于建筑道路、橡胶塑料等领域。因此,根据酸洗废液治理及铁系颜料市场需求,开发以钢铁酸洗废液为原料的铁系颜料制备技术,并使之工业化,对推动钢铁及铁系颜料两大行业的可持续发展,具有十分重要的意义。本文针对钢铁酸洗废液中的亚铁盐资源,探讨制备铁系颜料的化学原理、制备工艺及改性技术,为推动钢铁酸洗废液资源化利用提供试验设计参考。
1 铁系颜料制备
1.1 干法制备工艺
1.1.1 化学原理
(1)硫酸酸洗废液 废液中的亚铁盐是FeSO4·7H2O,将FeSO4·7H2O从废液中提纯出来后,利用高温煅烧即得到Fe2O3:

(2)盐酸酸洗废液 废液中的亚铁盐为FeCl2,通过加铁屑耗酸,溶液经净化后进行高温喷雾焙烧,使FeCl2在高温及有水蒸气和O2存在条件下发生水解-氧化反应,在焙烧炉直接转化为HCl和Fe2O3,HCl以盐酸形态回用:

1.1.2 工艺流程
(1)煅烧法 H2SO4酸洗废液→FeSO4提纯→FeSO4煅烧→洗涤除盐→干燥→粉碎过筛→氧化铁红产品。
提纯工段可利用王光华等[5]的调酸-冷冻结晶法提纯FeSO4。其最佳运行条件为:H2SO4酸洗废液中H2SO4质量分数20%,FeSO4质量浓度180~250g·L-1,温度0℃,可得到纯度大于等于95%的FeSO4·7H2O。
煅烧工段可采用李怡璞等[6]分段升温法,即在预热段将FeSO4·7H2O大部分结晶水脱去,在250~300℃脱水成FeSO4·H2O,在700~800℃煅烧热解为Fe2O3,通过控制煅烧温度、时间及空气流量,可生产出从浅红到深红的系列色调氧化铁红。从反应(1)可知,FeSO4·7H2O煅烧时还产生大气污染物SO2和SO3,需对含硫废气进行治理。
(2)鲁式法 具体分为流化床焙烧工艺与喷雾焙烧工艺,这两种工艺的化学原理相同(见反应(2)),都是集盐酸酸洗废液的加热、脱水、FeCl2的氧化-水解、HCl气体的净化及再生盐酸等操作在一个系统内一并完成,两种工艺所用的主要反应器设备不同,前者为流化床,后者为含喷嘴的园柱槽。鲁式法工艺流程见图1。

图1 鲁式法制备氧化铁红及盐酸工艺流程Fig.1 Technological process of preparing iron oxide red and hydrochloric acid by Ruthner method
武钢流化床焙烧工艺操作过程为[7]:将酸洗废液用泵送到预浓缩器,与反应炉产生的820℃高温气体进行热交换,使废液蒸发并浓缩至相对密度为1.45~1.5,浓缩液用泵及酸枪送入820℃的流化床反应炉内,废液在高温状态下发生反应(2),生成Fe2O3粉体和HCl气体,含Fe2O3粉尘的HCl气体经过旋风除尘器净化,进入预浓缩器冷却,冷却的HCl气体进入水喷淋吸收塔内成再生盐酸,补加适量新酸使盐酸浓度达到18%后送酸洗线回用;流化床反应炉中生成的Fe2O3粉体使流化床层面不断提高,待达到一定高度时排出Fe2O3。
干法工艺实质为高温煅烧,煅烧温度对产品性能影响很大。煅烧温度低于700℃的Fe2O3晶相不纯,颜色较浅;煅烧温度为800℃的晶相为α-Fe2O3,呈砖红色,煅烧温度高于900℃的晶相仍以α-Fe2O3为主,但颜色加深。干法工艺流程简单,操作方便,但高温煅烧易发生熔结现象而引起晶体团聚,导致盐分被包裹在晶体内部,晶体表面也易吸附Fe2+和酸根阴离子,产品纯度较低、粒径较粗、颗粒较硬,颗粒形貌和色泽也较难调控[8]。
1.2 湿法制备工艺
1.2.1 化学原理 在酸洗废液中加入NaOH、KOH、NH3、Na2CO3、K2CO3等碱性沉淀剂将亚 铁盐变成Fe(OH)2,以空气、NaClO3、H2O2等为氧化剂将Fe(OH)2氧化为悬浮的氧化铁黄或氧化铁红晶种,按比例不断加入废液和碱性沉淀剂,保持一定的亚铁浓度、pH值和温度,在持续通入氧化剂(如空气)条件下,Fe2+在晶种引导下不断被氧化成α-Fe2O3·H2O或α-Fe2O3并沉积在晶种上,使其逐渐成长,通过对色光进展的控制,可得到从浅到深的系列色相的Fe2O3。具体反应及历程为:

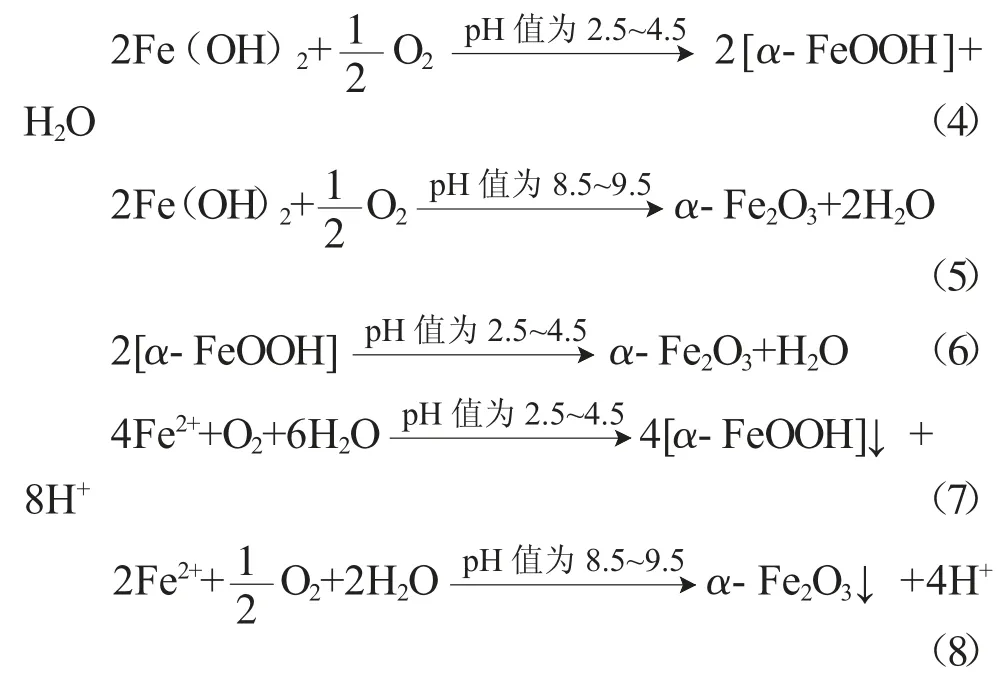
1.2.2 工艺流程
(1)酸法工艺 酸法工艺流程见图2。

图2 酸法制备氧化铁黄工艺流程Fig.2 Process flow diagram of preparing iron oxide yellow by acid method
由图2可知,晶种形成过程是复杂的多相反应,浓度、酸度、温度以及氧化方式均会影响晶种质量,随着氧化反应(4)的进行,悬浮液逐渐变稠、颜色变深,形成氧化铁黄微晶,当悬浮液颜色呈黄色时,晶种形成过程完成,此时pH值约为3;二次氧化过程则需将晶种引入酸洗废液中,调节温度,加入一定量碱液,控制悬浮液pH值为4~5,继续加入氧化剂,则废液中Fe2+发生反应(7),生成氧化铁黄沉积在晶种表面,当晶种生长至所需尺寸时即进行固液分离,用水洗涤固体数次,于120℃干燥5h,即得氧化铁黄产品。周益钧等[9]发明了利用酸洗废液和铁皮制备氧化铁黄的工艺,其主要做法:将钢铁厂的酸洗废酸与铁皮反应并过滤得亚铁盐滤液;将滤液泵入全密封反应釜中,加入Fe2O3晶种,釜内压强为0.11~0.12MPa,O2通过喷射泵加入反应釜内,控制滤液温度80~90℃,获得pH值为4.5~5.5的第一混合物;加入NaOH溶液调pH值为3~5,获得第二混合物;加入促进剂NaNO2溶液,获得第三混合物;出料,经压滤、烘干、粉碎,得氧化铁黄。
酸法优点是可避免杂质金属离子沉淀,能得到较纯色颜料,碱耗少;缺点是即使多次洗涤后,颜料里仍含有阴离子,降低其分散性能。
(2)碱法工艺 碱法工艺流程见图3。
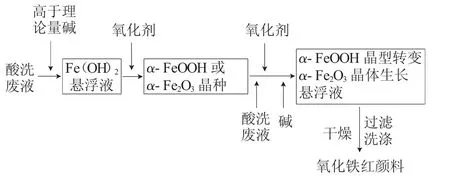
图3 碱法制备氧化铁红工艺流程Fig.3 Process flow diagram of preparing iron oxide red by alkaline method
由图3可见,碱法工艺用过量碱将酸洗废液pH值调至8~10,使废液中Fe2+全部沉淀为Fe(OH)2;在碱性条件下得到氧化铁黄(反应(4))或氧化铁红(反应(5))晶种;α-FeOOH在一定温度下逐步脱水转化为α-Fe2O3。碱法工艺的pH值与温度控制较为关键,pH值过高易形成杂晶,较低则离子扩散速度快,晶体生长快,粒径大且不易控制;温度以35~40℃为佳,温度低,则晶体生长慢,虽可得到较细粒子,但反应时间长,且易生成γ-FeOOH杂晶,温度高,亚铁离子扩散快,晶体生长快,晶体粒径粗。刘克文等[10]采用碱法工艺,控制温度83℃,pH值为9,将铁屑和晶种置于酸洗废液中,通入空气使Fe2+氧化成Fe2O3并沉积于晶种上,反应(8)生成的酸与铁屑反应不断补充Fe2+,继续氧化制备出红棕色氧化铁红。安少锋等[11]发明了利用含铁酸洗废液制备氧化铁红方法,该方法以Ca(OH)2乳液将酸洗废液pH值调至8.2~8.8,生成Fe(OH)2,以H2O2为氧化剂将Fe(OH)2生成晶种δ-FeOOH,控温80~90℃经液相催化相转化生成α-Fe2O3晶核,再加入含铁酸洗废液、氧化剂Ca(ClO3)2以及Ca(OH)2乳液,控制pH值为2.5~3.5,使Fe2+进行原位反应生成氧化铁红,最后过滤,在105~120℃烘干1~2h即得产品氧化铁红,滤液蒸发得到CaCl2。
碱法优点是收率高,粒径分布窄,微晶完整,易微细化,分散好;缺点是易将杂质金属离子沉淀到微晶使颜色不纯,还会产生大量含碱废液需再次处理。
影响酸法或碱法所制备的Fe2O3产品质量的因素有:酸洗废液所含亚铁盐纯度与浓度、反应温度、搅拌速度、氧化剂及氧化时间等。因空气易得、安全,是酸法或碱法的首选氧化剂,空气氧化法具有技术成熟、设备简单、生产成本低、易工业化的优点,但也存在氧化反应速率慢、生产周期长(约需30~50h)等缺点。针对空气氧化法在析出Fe(OH)2沉淀后,随着悬浮液黏度增加,氧化反应(4)或(5)速率明显降低,体系中Fe(OH)2难以继续被氧化为α-FeOOH或α-Fe2O3,造成氧化不完全而导致所得Fe2O3产品纯度降低的问题,张震斌等[12]用氧化铁皮为除酸剂,与HCl酸洗废液反应制得FeCl2溶液,采用空气-双氧水双重氧化和沉淀法,通过将FeCl2溶液滴加到NH3·H2O和聚乙烯吡咯烷酮混合液中,得到Fe(OH)2胶体,然后通入一定量的空气和1~3D 30%H2O2进行氧化,得到FeOOH胶体前驱体,经过滤、洗涤、干燥和煅烧,得到红褐色α-Fe2O3纳米颗粒。与单纯空气氧化法相比,空气-双氧水双重氧化法具有反应效率高、耗时耗能少、产品纯度高等特点。也可通过加入催化剂NaNO2以加快氧化速率[13],在不加晶种情况下直接生成铁黄,再锻烧成铁红。总的来说,与干法相比,湿法的能耗低、投资少、二次污染小,但操作要求高,条件不易控制。
2 铁系颜料的改性
利用酸洗废液制备的铁系颜料,因来源于废物而具有较大的价格优势,理应在颜料市场占一席之地。然而,由于分散性不佳或耐热性差等缺陷,使这些铁系颜料的应用受到一定程度的限制,因此,需对这些颜料进行改性,改善其性能以便提升附加值或拓展应用范围。
2.1 氧化铁黄改性
对于氧化铁黄颜料来说,(1)在油性涂料中分散性较差,在使用时需长时间研磨,才能分散到介质中,造成涂料生产成本增加且使用不方便;(2)耐热性较差,受热至150~200℃开始脱水,当温度升至270~300℃迅速脱水并变成氧化铁红,透明氧化铁黄因粒径小、比表面积大,使其脱水温度更低,耐热性更差,而塑料加工的熔化温度一般高于200℃,这就限制了氧化铁黄在塑料工业的应用。因此,需从提高分散性与耐热性两个方面对氧化铁黄进行改性。
2.1.1 氧化铁黄表面无机包覆改性 陈健等[14]用沉淀法在氧化铁黄颜料表面包覆羟基氧化铝来提升其耐热性,探索得到的较佳包覆条件:温度80℃,包覆层质量分数为15%,晶化时间大于4h,在此条件下所得产品的耐热性达到240℃。夏盛杰等[15]发明了一种耐高温氧化铁黄颜料及其制备方法。采用双层包覆核壳结构,核结构为氧化铁黄颜料,核结构自内向外依次包覆羟基氧化铝层(占氧化铁黄颜料重量的1%~50%)、Zn(OH)2层(占氧化铁黄颜料重量的1%~10%),颜料表面包覆的羟基氧化铝/Zn(OH)2能抑制热量进入铁黄颗粒内部,使颜料能在高于240℃的烘箱中耐受至少30min,从而使其适用于高温卷涂材料和塑料加工行业。
2.1.2 氧化铁黄表面有机包覆改性 氧化铁黄颜料由带正电的羟基氧化铁粒子构成,可用阴离子表面活性剂对其表面进行包覆改性来改善分散性能。包覆原理见图4。

图4 表面活性剂包覆氧化铁黄粒子示意图Fig.4 Schematic diagram of iron oxide yellow particles coated by surfactant
常用阴离子表面活性剂有:烷基苯磺酸钠、脂肪酸盐、柠檬酸、蓖麻油等。由图4可知,在氧化铁黄颜料与油状介质构成的涂料体系中,加入一定量的阴离子表面活性剂,可在颜料粒子形成的同时,对粒子进行表面包覆处理,中和铁黄粒子表面的正电性,把颜料粒子由表面张力高的亲水疏油性改为疏水亲油性,使粒子在相互碰撞中不易凝聚,可在有机溶剂中较好地分散。范建平[16]发明了一种表面包覆改性氧化铁黄的制备方法,其所用的包覆材料含羟丙基甲基纤维素、H3BO3、耐火土、正硅酸乙酯等,通过球磨及超声分散处理,并用乙酸乙酯调体系pH值至中性,经陈化、湿研磨、干燥,可制得稳定性好、耐热性能高的表面包覆有机物的氧化铁黄。
2.1.3 氧化铁黄化学改性 管文琴等[17]采用混合-煅烧-研磨法将氧化铁黄进行化学改性,制备耐高温颜料铁酸锌黄,原理见反应式(9):

主要做法是先将氧化铁黄与ZnO用水配成悬浮液,混合均匀后干燥、粉碎并煅烧,控制温度750~1000℃,时间10~30min,再缓慢冷却400~500℃,最后在室温下完全冷却,即可将氧化铁黄变成化学性质稳定、耐热、耐光、耐候等锌铁黄(铁酸锌)颜料,达到国外同类型颜料TAN的优异性能。
2.2 氧化铁红改性
干法氧化铁红在制备过程中经高温锻烧,其表面较为致密,吸附的金属离子以及杂质离子难以去除,严重影响氧化铁红的遮盖力;湿法氧化铁红在制备过程中,各种杂质离子易进入晶体内部,杂质离子的存在会压缩氧化铁红颗粒的双电层,使其分散性变差。因此,要对氧化铁红进行改性处理。
2.2.1 氧化铁红表面无机包覆改性 氧化铁红自身化学性质稳定,可用于塑料着色,但由于氧化铁红及其所含的杂质金属离子具有一定的触媒活性作用,能引发塑料的早期老化,从而影响塑料使用寿命。因此,在氧化铁红表面包覆Al2O3、SiO2等无机物,可以有效地降低氧化铁红的触媒活性,从而抑制塑料的早期老化,延长塑料制品的使用时间。另外,氧化铁红表面包覆了Al2O3、SiO2后,使其具备一定的抗絮凝剂的性能,提高了其分散性。郭玉鹏等[18]发明了一种氧化铁红的表面处理方法,先用强碱溶液将氧化铁红中混杂的钙、镁等杂质金属离子转变成溶解度小的氢氧化物,让硫等非金属杂质与碱生成可溶盐而过滤去除,再用强酸中和多余碱液,使钙、镁等金属氢氧化物在酸中溶解过滤而去除,从而将氧化铁红纯化,且使铁红颗粒间静电斥力增强、分散性增加,进而提高铁红遮盖性能。
2.2.2 氧化铁红表面有机包覆改性 郑水林等[19]以改性剂丙烯酸聚合物和改性助剂沉淀SiO2(白炭黑)复配作为表面改性剂,采用干式工艺对氧化铁红表面进行改性,最佳改性剂配方为:丙烯酸聚合物用量15%~30%,沉淀SiO2(白炭黑)用量35%~45%。表面改性后的氧化铁红颜料着色力较改性前有较大提高,在水溶液中分散稳定时间长,干态分散性好,改性机理是粒子间静电排斥与空间排斥作用增大、液桥力降低。
3 结语
钢铁酸洗废液资源化与无害化处理,是钢铁行业可持续发展的必经之路。利用酸洗废液生产铁系颜料,学界与产业界进行了大量研究与攻关,但仍以实验室试验或小试为主,已工业化的制备工艺因所得产品质量一般而未被市场青睐。因此,利用酸洗废液制备铁系颜料仍有大量的技术开发工作可做,在新技术开发及产业化应用中需对以下问题多加考虑:
(1)制备工艺绿色化 在保证最大程度地将亚铁盐资源化利用基础上,还要有相应的无害化措施,以避免制备过程造成二次污染。
(2)制备工艺多样化 由于钢铁工业生产的连续性,酸洗废液的产生也是连续的,由酸洗废液制备铁系颜料的工艺既要确保所得产品能达到相应的质量标准,也应有一定的灵活性,以保证当某种产品滞销时,可通过简单的工艺切换转而制备畅销产品。
(3)产品微细化及表面改性 针对干法或湿法工艺所得铁系颜料性能较差的特点,对产品进行微细化及表面处理,以改善铁系颜料应用性能,提升产品附加值,以期达到更好的环境和经济效益。
