6-羟基多巴胺阻断交感神经对咪喹莫特诱导银屑病样小鼠模型的系统性炎症的影响
2022-08-02刘思骐罗宇榕彭余徐英萍梁云生
刘思骐, 罗宇榕, 彭余, 徐英萍, 梁云生
南方医科大学皮肤病医院,广东 广州 510091
银屑病(psoriasis)是一种全身炎症性疾病,主要以皮肤鳞屑性红斑、斑块和瘙痒为特征[1]。银屑病与许多共患病相关联,涉及全身多个系统[2-3]。银屑病患者血液中的炎性生物标记物升高[4],同时成像技术已记录到皮肤以外的炎症部位。白念珠菌是一种具有高度致病性的常见病原菌,在免疫抑制状态下存在于皮肤和口腔等屏障部位。与银屑病相似,白念珠菌感染后的皮肤出现以Th17型免疫反应为主的炎症反应[5],而二者不同之处在于是否出现系统性炎症反应。
脾脏是神经免疫通讯的关键部位[6-7],作为机体免疫反应的中心,在免疫系统中起着重要作用[8]。脾交感神经的神经信号传递对正常的免疫功能至关重要[9],并与炎症发生的重要步骤有关,如免疫细胞的募集和动员[10]。临床研究曾发现银屑病儿童的脾脏体积增加,与C57BL/6小鼠在咪喹莫特诱导银屑病样皮损模型时观察到的脾脏肿大现象一致[11]。通过影像技术可检测到成年银屑病患者脾脏的高代谢活动,提示脾脏炎症的出现,且后续研究表明患者的脾脏炎症与主动脉炎症具有相关性[12]。本研究提出脾脏交感神经信号参与了银屑病发生后的脾脏炎性活动,从而导致系统性炎症的产生,希望探索银屑病中系统性炎症发生发展的神经免疫机制,为银屑病全身性炎症的治疗与干预提供新靶点。
1 材料与方法
1.1 实验动物
24只SPF级6~8周龄 C57BL/6J 野生型小鼠购于广东至远生物医药科技有限公司。小鼠的处理和实验程序操作均符合机构动物护理和使用委员会的要求, 本实验经医院实验动物伦理委员会审批 (2021d061)。
1.2 主要材料与试剂
咪喹莫特乳膏购自英国Aldara 公司,Ⅳ型胶原酶(货号40510ES60)购自美国Thermo Fisher Scientific公司,红细胞裂解液(货号555899)、流式抗CD45抗体(货号CD45RB BV650 16A, 50 μg) 购自美国BD Pharmingen 公司,Trizol(货号15596-026) 购自美国Invitrogen公司,流式抗CD11c抗体(货号117328)、抗IA/IE抗体(货号107630) 购自美国Biolegend公司,抗Ly6C抗体(货号48-5932-82)、抗CD11b抗体(货号101205)、抗Ly6G抗体(货号127609)购自美国eBioscience公司,RNA反转录试剂盒(货号RR047A)、实时荧光定量PCR试剂盒(货号RR047A)购自日本 TaKaRa 公司。IL-17A、IL-6、IL-1β引物购自生工生物工程(上海)股份有限公司。GAPDH、IL-17A、IL-6、IL-1β抗体购自创伟生物(广州)股份有限公司。
1.3 动物模型的建立
将24只SPF级C57BL/6J小鼠以简单随机抽样法分为银屑病样皮炎模型组(模型组)、白念珠菌感染组、阴性对照组及银屑病样皮炎模型伴溶剂处理组(溶剂模型组)、6-羟基多巴胺(6-OHDA)处理组、溶剂对照组,每组4只。
模型组、白念珠菌感染组、阴性对照组背部脱毛,范围1.5 cm×2 cm。白念珠菌感染组脱毛区用220粗砂纸刮10次以去除角质层,用无菌PBS洗涤后,将2×108株白色念珠菌加入50 μL无菌PBS中涂抹于皮肤上,作用3 d后取材。模型组、阴性对照组分别每日外涂5%咪喹莫特乳膏(IMQ)和凡士林62.5 mg,作用5 d后取材。溶剂模型组、6-OHDA处理组、溶剂对照组小鼠耳部脱毛。6-OHDA处理组于造模前3 d腹腔注射80 mg/kg 6-OHDA溶液(生理盐水,含0.1%抗坏血酸)1次,溶剂模型组、溶剂对照组同时注射80 mg/kg 含0.1%抗坏血酸生理盐水1次。溶剂模型组、6-OHDA处理组每日外涂5%咪喹莫特乳膏25 mg,溶剂对照组每日外涂凡士林25 mg,作用5 d后取材。
1.4 HE 染色
用石蜡包埋脱水后皮肤组织,应用切片机将组织切成6~10 μm厚度的组织薄片黏附于载玻片上,脱蜡后进行HE染色。使用相差显微镜观察并拍摄。
1.5 q-PCR检测皮肤和脾脏的炎症因子IL-17A、IL-6和IL-1β RNA水平检测
取小鼠皮损组织或脾脏组织,采用有机溶剂萃取法提取两种组织的总RNA,使用反转录试剂盒将RNA反转录为cDNA后,使用TaKaRa实时荧光定量试剂盒和7900实时PCR系统,以反转录后的cDNA为模板,进行RT-qPCR检测,分别对皮损组织的GAPDH和IL-17A、脾脏组织的IL-6和IL-1β分析。各引物序列如下:GAPDH:5′-GCACCGTCAAGGC-TGAGAAC-3′(上游),5′-TGGTGAAGACGCCAGTGGA-3′(下游);IL-17A:5′-CTGGAGGATAACACTGTGAGAGT- 3′(上游),5′-TGCTGAA-TGGCGACGGAGTTC-3′(下游);IL-6:5′-CTCTGCAAGAGACTTCCATCCAGT- 3′(上游),5′-CATTTCCACGATTTCCCAGAGA-3′(下游);IL-1β:5′-CCTGTCCTGCGTGTTGAAAGA- 3′(上游),5′-GGGAACTGGGCAGACTCAAA-3′(下游)。采用2-ΔΔCt循环阈值法计算相对表达量,以 GAPDH为内参。
1.6 Western blot检测皮肤和脾脏的炎症因子IL-17A、IL-6和IL-1β蛋白水平
取各组小鼠耳部皮肤或脾脏组织,液氮速冻后,立刻加入RIPA裂解液、蛋白酶抑制剂等并研磨组织至粉末状,研磨过程于冰上进行。用超声细胞破碎仪对组织混悬液进行细胞裂解,而后离心并吸出上清蛋白液,使用BCA法测定裂解液总蛋白浓度,每孔上样30 μg,电泳、转膜、封闭,分别加入GAPDH、IL-17A、IL-6和IL-1β抗体,置于4 ℃冰箱过夜。次日洗膜,加入辣根过氧化物酶标记的羊抗兔二抗孵育,洗膜,化学显影。实验重复3次。
1.7 制备脾脏单细胞
颈椎脱臼处死小鼠后,取小鼠脾脏,剔除附着筋膜及脂肪,剪碎后用1 mg/mL Ⅳ型胶原酶在 37 ℃条件下消化30 min,终止消化后滤网研磨过滤,离心获得单细胞悬液。
1.8 统计学处理
数据使用Grahpad Prism 8.0软件进行统计分析。小鼠脾脏体重比、脾脏及皮损的炎症因子mRNA和蛋白结果组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 银屑病样皮炎模型组及白念珠菌感染组小鼠皮肤发生皮肤局部17型免疫反应
每日观察各组小鼠皮损变化,白念珠菌感染组小鼠背部皮肤于接种真菌后第1天出现明显红斑及表皮增厚,随真菌定植持续加重,以接种后第3天最为明显;而模型组小鼠背部应用IMQ后第1天出现皮肤红斑,以造模5 d后的情况最为严重,皮肤干燥且出现较多鳞屑,皮肤红肿,炎症细胞浸润明显(图1A)。
HE染色结果显示:阴性对照组小鼠皮肤表皮层薄,真皮层细胞浸润少; 与阴性对照组相比,白念珠菌感染组及模型组小鼠表皮增厚明显、角化不全、基底角化细胞增殖过度和炎症细胞浸润(图1B)。
与阴性对照组相比,模型组及白念珠菌感染组小鼠皮损中IL-17A的mRNA及蛋白表达量均显著增高(均P<0.01),但模型组与白念珠菌感染组间无统计学差异(P值分别为0.972、0.578,图1C、1D)。
2.2 银屑病样皮炎模型组小鼠脾脏发生系统性炎症反应
观测小鼠脾脏炎症改变,结果显示,与阴性对照组比较,模型组小鼠脾脏指数(脾脏重量/小鼠体重×1 000)明显升高(P<0.01),而白念珠菌感染组未见改变(P=0.468,图1E、1F);模型组小鼠脾脏组织中IL-6和IL-1β的mRNA(均P<0.01)及蛋白表达量(均P<0.01)均明显上升,而白念珠菌感染组无明显变化(P值分别为0.237、0.533,图1G、1H)。

图1 银屑病样模型小鼠与白念珠菌感染小鼠第5天皮损及脾脏炎症状态 1A:各组小鼠皮肤炎症情况大体表现;1B:各组小鼠皮损组织病理表现 (HE,100×);1C、1D:各组小鼠皮肤组织内IL-17A表达情况;1E、1F:各组小鼠脾脏炎症情况大体表现;1G、1H:各组小鼠脾脏组织内IL-6及IL-1β表达情况 与对照组比,***P<0.01, ****P<0.001, ns P>0.05 Control:阴性对照组;IMQ:银屑病样模型组;C Albicans:白念珠菌感染组
2.3 6-OHDA阻断脾脏交感神经可轻度缓解银屑病样皮肤炎症
2.3.1 6-OHDA处理轻度缓解了银屑病样皮炎模型小鼠的皮肤肿胀 使用交感神经阻断剂6-OHDA对小鼠行1次腹腔注射,并在3 d后使用咪喹莫特进行连续5 d的耳部皮肤炎症诱导(图2A)。使用游标卡尺测量小鼠每日耳朵厚度并记录,第5天对比溶剂模型组小鼠,可见6-OHDA处理组的小鼠耳部皮肤肿胀程度减轻(P=0.008),但行HE染色未见明显差异(图2B~2D)。
2.3.2 6-OHDA处理降低了银屑病样皮炎模型小鼠皮肤组织内的IL-6蛋白含量 提取小鼠耳部皮肤组织的RNA及蛋白进行检测,q-PCR结果未见溶剂模型组和6-OHDA处理组小鼠皮肤组织内IL-17A(P=0.297)及IL-6(P=0.600)的mRNA表达量有统计学差异;Western blot检测组织中蛋白水平,可见相较于溶剂模型组小鼠,6-OHDA处理组小鼠皮肤组织内IL-6的蛋白含量略有降低(P=0.010,图2E、2F)。

图2 6-OHDA部分缓解咪喹莫特诱导的银屑病样皮炎 2A:6-OHDA处理银屑病样小鼠流程示意图;2B:各组小鼠皮肤炎症情况大体表现;2C:各组小鼠皮损组织病理表现;2D:各组小鼠耳部皮肤厚度;2E、2F:各组小鼠皮肤组织内IL-6及IL-17A表达情况 与溶剂对照组比较,**P<0.01, ***P<0.001, ****P<0.0001, ns P>0.05 Vehicle control:溶剂对照组;VC-IMQ:溶剂模型组;6-OHDA-IMQ:6-OHDA处理组
2.4 6-OHDA阻断脾脏交感神经显著缓解银屑病样小鼠模型的系统性炎症
相较于溶剂模型组,6-OHDA处理组小鼠的脾脏肿胀程度明显减轻,其脾脏指数也显著降低(P<0.01,图3A、3B)。同时,6-OHDA处理组小鼠脾脏的炎症细胞浸润比例也发生了明显改变。流式细胞术结果显示:与溶剂对照组小鼠相比,溶剂模型组小鼠的脾脏中,中性粒细胞(CD11bhighLy6Cint,P=0.001)、单核来源的巨噬细胞(CD11bhighF4/80int,P=0.005)和组织定居巨噬细胞(CD11b+F4/80+,P=0.013)水平升高,而6-OHDA的处理挽救了咪喹莫特导致的中性粒细胞(P=0.003)和单核来源巨噬细胞(P=0.049)的浸润,同时组织定居的巨噬细胞也有所降低,但差异无统计学意义(P>0.05,图3C、3D)。q-PCR及Western blot检测脾脏内炎症因子的表达情况,结果显示6-OHDA处理降低了银屑病样皮炎小鼠脾脏的IL-6和IL-1β的mRNA(P值分别为0.007、0.039)和蛋白(均P<0.01)表达(图3E、3F)。提示6-OHDA起到挽救银屑病样皮炎小鼠系统性炎症的作用,交感神经在银屑病系统性炎症的调控中扮演重要角色。
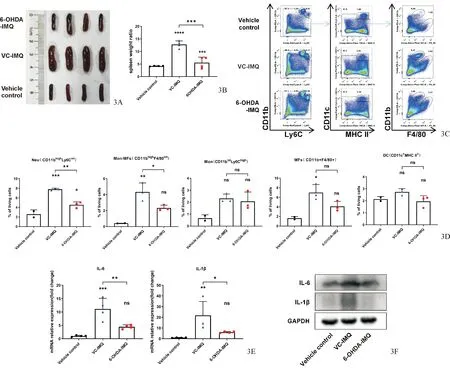
图3 6-OHDA减轻银屑病样皮炎小鼠系统性炎症 3A、3B:各组小鼠脾脏炎症情况大体表现;3C、3D:各组小鼠脾脏炎症细胞类型及占比;3E、3F:各组小鼠脾脏组织内IL-1β及IL-6表达情况 与模型对照组相比,*P<0.05, **P<0.01,***P<0.001, ****P<0.0001, ns P>0.05.
3 讨论
银屑病是一种系统性免疫性疾病,在各种因素的共同作用下,免疫系统激活引起皮肤局部炎症细胞浸润,角质形成细胞异常增殖分化[13]。以往大部分研究都集中在炎性皮肤疾病的免疫基础上,较少探究神经系统在银屑病的疾病过程中的作用。近年来,人们发现精神压力是银屑病发病的因素之一,心理应激可能引发或加剧免疫介导的皮肤病[14-15]。消极情绪如焦虑、抑郁等既导致银屑病的发病[16],也会因为负面情绪的持续使临床症状加重; 这些负面情绪伴随神经激活,调控免疫细胞过度活化产生细胞因子,加重皮损的炎症反应,使疾病迁延不愈甚至恶化。有报道1例长期偏瘫的 59 岁女性出现非偏瘫侧的单侧银屑病关节炎和单侧银屑病,提示神经系统参与银屑病及其共病的发生发展[17]。 Hjuler等[12]则发现成年银屑病患者脾脏炎性活动与银屑病共病主动脉炎症具有相关性,提示脾免疫功能在银屑病局部免疫反应和系统免疫反应之间起着重要作用。
IMQ诱导的小鼠模型是最广泛认可的银屑病样动物模型,除了主要的皮肤改变,也可部分模拟银屑病的系统性炎症状态[11,18]。本研究对比咪喹莫特诱导的小鼠模型和白念珠菌感染的小鼠模型发现,两种疾病模型的病理机制虽然都以皮肤局部Th17型免疫反应为主,但脾脏炎症状态的差距反映出二者在系统性炎症方面的不同。咪喹莫特诱导的银屑病样皮炎模型可见脾脏明显肿胀,脾脏中炎症因子IL-6和IL-1β的升高也从分子机制验证了其系统炎症的产生。一些研究表明,银屑病中可见交感神经系统的激活和异常[19-20],而脾交感神经对脾脏免疫功能的影响也被多方面探究[21-22]。有研究表明,焦虑、抑郁等神经病症早于银屑病皮损的发生,与银屑病的发生发展相关,而焦虑、抑郁等神经病症往往与交感神经兴奋相关,因此我们考虑交感神经有可能参与了银屑病病理过程的调控,可能参与导致银屑病样小鼠模型发生系统性炎症反应,并对银屑病样皮炎的发展起调控作用。使用选择性的儿茶酚胺能神经毒剂6-OHDA阻断腹腔交感神经后[23-24],银屑病样皮炎小鼠耳朵肿胀程度轻度缓解,皮损内IL-6蛋白含量降低,而IL-6 mRNA表达未见差异,考虑6-OHDA通过减轻系统性炎症从而减少循环内IL-6的蛋白水平而非皮损局部产生的IL-6水平。腹腔交感神经阻断后,银屑病样皮炎小鼠的脾脏肿胀得到极大缓解,脾脏中免疫细胞中性粒细胞、单核来源巨噬细胞的比例有所下降,炎症因子IL-6、IL-1β表达也明显下调。局部炎症和免疫功能障碍会促进靶向末端器官的组织损伤,而全身性炎症则会通过影响多个器官系统增加发病率和死亡率[25],所以银屑病中系统性炎症的发生发展不容忽视。
综上所述,腹腔交感神经可能通过调节脾脏免疫功能参与咪喹莫特诱导银屑病样小鼠模型产生系统性炎症。交感神经对脾脏免疫功能的调节,将有助于解释银屑病发病过程中系统性炎症发生的机制,为进一步阐明交感神经系统在银屑病中的调控作用提供新的理论依据,提示神经系统将有望成为银屑病治疗的新靶点。
