miR-125a-3p靶向作用P2RX7抑制糖尿病肾病小鼠肾纤维化发展
2022-08-02蒋伟郑东辉李海伦徐永
蒋伟, 郑东辉, 李海伦, 徐永
(徐州医科大学附属淮安医院肾脏内科,江苏省淮安市 223002)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最主要的并发症之一,DN病程中晚期糖基化终末产物(advanced glycation end-products,AGE)蓄积激活体内活性氧,导致肾组织脂质过氧化、炎症反应和促纤维化因子产生,进而促进肾纤维化进程从而影响肾脏的正常功能[1],目前关于肾纤维化的分子机制仍不清楚。miR-125a-3p是近年新发现的纤维化相关微小RNA(microRNA,miRNA),体外研究显示miR-125a-3p可调控成纤维细胞增殖和细胞外基质累积[2]。也有研究显示DN发生后miR-125a-3p降低,进而参与DN视网膜病变[3],提示miR-125a-3p可能参与DN肾纤维化,但其调节机制仍不清楚。P2RX7是一种ATP门控离子通道,参与调节免疫、炎症和肿瘤的进展,研究表明P2RX7药理学抑制可缓解肝组织纤维化[4],P2RX7对DN肾纤维化的机制仍不清楚。因此,本文探讨miR-125a-3p靶向作用P2RX7对DN小鼠肾纤维化发展的影响。
1 材料和方法
1.1 主要实验材料
C57BL/6小鼠(SPF级,雄性,6周龄,20~25 g)。ELISA试剂盒、HE染色试剂盒、Masson染色试剂盒(碧云天公司,中国)。P2RX7质粒、miR-125a-3p类似物(mimic)及阴性对照(negative control,NC)(吉玛公司,中国)。TRIzol和mirNeasy mini试剂盒(QIAGEN GmbH公司,德国)。SYBR Premix Ex TaqTM试剂盒(TaKaRa公司,日本)。PCR仪(ABI7900,ABI公司,美国)。P2RX7一抗(ab48871)、胶原蛋白I(collagen I,Col-I)一抗(ab255809)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)(ab40854)一抗(Abcam公司,美国)。ECL显色试剂盒和Nanodrop 2000仪器(Thermo Fisher公司,美国)。肾胚细胞(ATCC公司,美国)。突变试剂盒和Renilla荧光素酶(Beyotime公司,中国)。荧光素酶试剂盒(Promega公司,美国)。
1.2 小鼠建模和分组干预
60只C57BL/6小鼠随机均分为对照组、模型组、miR-125a-3p NC组和miR-125a-3p mimic组。除对照组外,其他小鼠参考文献[5]高糖高脂配合STZ诱导构建DN小鼠模型,小鼠尾静脉空腹血糖>16.65 mmol/L、尿量>对照组50%提示建模成功。建模后miR-125a-3p NC组和miR-125a-3p mimic组DN小鼠分别腹腔注射miR-125a-3p NC或miR-125a-3p mimic(300 μg,每周2次)[6];对照组和模型组注射等量生理盐水为对照。8周后,收集小鼠尾静脉血,安乐死小鼠收集肾组织。
1.3 qRT-PCR检测miR-125a-3p表达
使用TRIzol试剂从肾组织中提取总RNA,Nanodrop 2000进行定量。使用mirNeasy Mini试剂盒将miRNA进行反转录,使用SYBR Premix Ex TaqTM进行qRT-PCR反应:95 ℃ 2 min,58 ℃20 s, 72 ℃ 20 s(40个循环),以U6为内参,使用2-ΔΔCt法计算miR-125a-3p相对表达水平。
1.4 Western blotting检测P2RX7、Col-I、α-SMA蛋白
肾组织裂解后离心(4 ℃,12 000 r/min,5 min)收集总蛋白。10%SDS-PAGE分离40 μg蛋白,转移到硝酸纤维素膜上。加入5%脱脂牛奶(室温,2 h)封闭后加入抗-P2RX7、抗-Col-I、抗-α-SMA(1∶800,4 ℃,8 h),洗涤后加入二抗(1∶2 000,室温,1 h)。条带用ECL可视化处理,GAPDH为内参,计算P2RX7、Col-I、α-SMA蛋白的相对表达量。
1.5 ELISA检测血肌酐和血尿素氮
取小鼠尾静脉血,半径8 cm 3 000 r/min离心15 min,收集上清,分别加入抗体和显色剂,终止显色反应后15 min内检测光密度(450 nm),根据标准曲线计算肾功能指标血肌酐(creatinine,Cr)和血尿素氮(blood urea nitrogen,BUN)水平。
1.6 HE染色观察肾脏病理改变
肾组织用10%甲醛溶液固定48 h,流水冲洗。梯度乙醇脱水,然后将组织浸入蜡中,切5 μm厚度。载玻片65 ℃恒温烘箱中30 min。脱蜡水化后染色。细胞核用苏木精染色5 min,细胞质用伊红染色1~2 min。染色切片用乙醇脱水并在显微镜下观察拍照。
1.7 Masson染色检测肾纤维化
将1.6切片标本加入Masson三色染料染色,根据试剂盒说明书方法操作,显微镜下观察并拍照,利用IPP 6.0图像分析系统计算胶原蛋白体积分数(collagen volume fraction,CVF)。
1.8 双荧光素酶检测miR-125a-3p与P2RX7靶向关系
通过Starbase网站得到miR-125a-3p与P2RX7的碱基结合位点。根据其原始序列,将P2RX7的3′端非翻译区域(3′-untranslated region,3′-UTR)负载于pGL4荧光素酶载体上作为野生型(WT-)P2RX7;利用突变试剂盒生成突变型(MUT-)P2RX7。根据上述转染方法,分别将1 μg WT-/MUT-P2RX7及50 nmol/L miR-125a-3p mimic/ NC质粒转染1×104个人胚胎肾干细胞(HEK293)中。36 h后根据Renilla计算细胞荧光素酶活性。
1.9 统计学处理
2 结 果
2.1 各组miR-125a-3p和P2RX7蛋白表达水平的比较
与对照组比较,其他3组P2RX7蛋白表达升高,miR-125a-3p表达降低(P<0.05);与模型组和miR-125a-3p NC组比较,miR-125a-3p mimic组上述趋势得到逆转(P<0.05;图1和表1)。
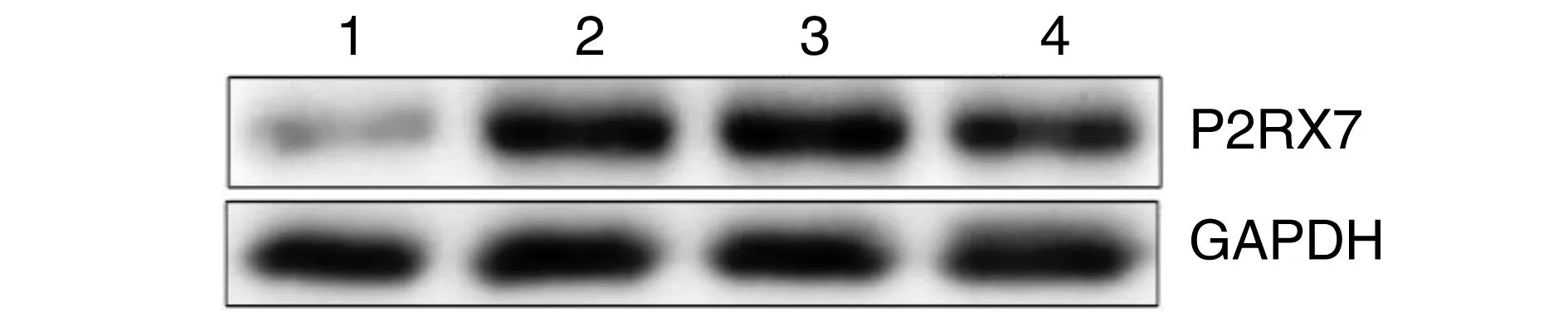
图1 各组P2RX7蛋白表达水平的比较1为对照组;2为模型组;3为miR-125a-3p NC组;4为miR-125a-3p mimic组。

表1 各组小鼠肾组织P2RX7蛋白和miR-125a-3p表达的比较(n=15)
2.2 miR-125a-3p对肾功能指标的影响
与对照组比较,其他3组Cr和BUN水平均升高(P<0.05);与模型组和miR-125a-3p NC组比较,miR-125a-3p mimic组上述趋势得到逆转(P<0.05;表2)。

表2 miR-125a-3p对DN小鼠肾功能指标的影响(n=15)
2.3 miR-125a-3p对肾组织病理学改变的影响
对照组细胞排列规则,肾小球和肾小管结构完整;模型组和miR-125a-3p NC组肾小管出现明显萎缩和紊乱,并出现细胞外基质累积和炎性浸润;miR-125a-3p mimic组可观察到基础的肾小管和肾小球结构,组织损伤程度较模型组和miR-125a-3p NC组轻(图2)。

图2 miR-125a-3p对DN小鼠肾组织病理学改变的影响(HE染色,40×)
2.4 miR-125a-3p对CVF的影响
对照组着色均匀,无明显蓝色胶原纤维,提示肾组织正常,灰蓝色或灰色为纤维化组织和胶原蛋白。模型组和miR-125a-3p NC组出现明显蓝色胶原纤维,提示肾组织异常;而miR-125a-3p mimic组出现少量蓝色胶原纤维,较模型组和miR-125a-3p NC组少,提示肾组织部分异常。与对照组比较,模型组和miR-125a-3p NC组CVF均升高(P<0.05);与模型组和miR-125a-3p NC组比较,miR-125a-3p mimic组上述趋势得到逆转(P<0.05;图3)。
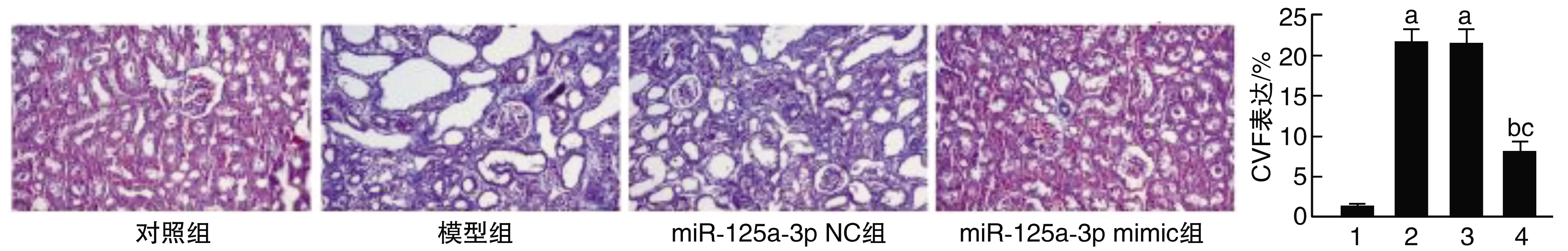
图3 miR-125a-3p对DN小鼠肾组织纤维化的影响(Masson染色,40×)1为对照组;2为模型组;3为miR-125a-3p NC组;4为miR-125a-3p mimic组。a为P<0.05,与对照组比较;b为P<0.05,与模型组比较;c为P<0.05,与miR-125a-3p NC组比较。
2.5 miR-125a-3p对Col-I和α-SMA蛋白水平的影响
与对照组比较,模型组和miR-125a-3p NC组Col-I和α-SMA蛋白水平升高(P<0.05);与模型组和miR-125a-3p NC组比较,miR-125a-3p mimic组上述趋势得到逆转(P<0.05;图4)。

图4 Western blotting检测miR-125a-3p对DN小鼠Col-I和α-SMA蛋白水平的影响1为对照组;2为模型组;3为miR-125a-3p NC组;4为miR-125a-3p mimic组。a为P<0.05,与对照组比较;b为P<0.05,与模型组比较;c为P<0.05,与miR-125a-3p NC组比较。
2.6 miR-125a-3p对P2RX7的靶向作用
miR-125a-3p与P2RX7存在靶向结合位点,转染MUT-P2RX7和miR-125a-3p mimic后,细胞中相对荧光素酶活性降低(P<0.05;图5),证明miR-125a-3p与P2RX7靶向结合。

图5 miR-125a-3p对P2RX7的靶向调节作用A为miR-125a-3p与P2RX7结合位点;B为荧光素酶活性柱状图。a为P<0.05,与miR-125a-3p NC组比较;b为P<0.05,与MUT-P2RX7比较。
3 讨 论
糖尿病肾病(diabetic nephropathy,DN) 典型的病理改变为肾小球及肾小管基底膜增厚、肾小管间质纤维化等。若其纤维化得不到有效控制,则会发展为肾小球硬化和肾间质纤维化,甚至终末期肾功能衰竭[7]。
miRNA可通过碱基配对识别并结合mRNA,进而诱导mRNA的降解或者抑制翻译[8]。miR-125a-3p是近年来新发现的与糖尿病和纤维化相关的miRNA,细胞实验结果表明DN会引起miR-125a-3p的水平升高,引起DN相关动脉损伤[9]。miR-125a-3p 通过下调系统性红斑狼疮介导的肾炎小鼠中的TGF-β1表达来抑制肾纤维化[10]。相关研究发现miR-125a-3p可以通过调控STAT3通路缓解成纤维细胞活化,此外,还可以调节自噬参与四氯化碳诱导的小鼠模型肝纤维化[11-12]。为初步分析miR-125a-3p是否参与了DN引起的肾纤维化,本研究成功构建DN模型,并成功促进了肾纤维化,发现肾组织中miR-125a-3p水平降低。为进一步证实miR-125a-3p在DN引起的肾纤维化中的作用,本研究利用miR-125a-3p mimic提高DN小鼠miR-125a-3p水平。本实验结果表明,提高miR-125a-3p水平可显著缓解DN小鼠肾组织损伤,抑制肾纤维化,保护肾功能。本研究在动物水平上证实miR-125a-3p参与了DN诱导的肾纤维化,而提高miR-125a-3p水平可显著缓解纤维化。
P2RX7蛋白是P2X7的受体,通过形成可渗透大分子的膜孔,负责巨噬细胞的ATP依赖性裂解[13]。研究显示,P2RX7的接触抗击可减轻肾脏炎症的早期阶段、间质纤维化,并与输尿管梗阻中的肾细胞增殖有关[14]。也有研究显示,抑制P2RX7通过抑制NLRP3/IL-1β通路而下调Col-I和α-SMA的表达,改善心脏纤维化[15]。Col-I是细胞外基质的主要成分,也是引起纤维化和肾功能障碍的重要蛋白[16]。α-SMA是促进肾上皮细胞转化为肌成纤维细胞的重要蛋白,进而促进纤维化进程[17]。本研究结果显示,在DN纤维化肾组织中,P2RX7水平显著升高,Col-I和α-SMA蛋白升高,而提高miR-125a-3p表达则会恢复P2RX7蛋白的表达水平,并抑制Col-I和α-SMA的表达。此外,双荧光素酶报告实验也验证了miR-125a-3p与P2RX7靶向结合。本研究结果表明,DN会引起肾组织中miR-125a-3p的降低,从而导致P2RX7的过表达,进而导致Col-I和α-SMA蛋白的升高,引起肾纤维化;而提高miR-125a-3p的水平可通过抑制P2RX7蛋白等的水平抑制纤维化,保护肾功能。
然而,本研究也有一定的局限性,首先,miR-125a-3p与P2RX7的相关性以及在DN引起的肾纤维化的作用仍需要临床研究证实,DN、miR-125a-3p以及P2RX7之间调控的分子机制仍需要进一步分析。
综上所述,miR-125a-3p升高会通过靶向抑制P2RX7蛋白的表达缓解DN引起的肾纤维化,保护肾功能。这提示miR-125a-3p/P2RX7可能是治疗DN肾纤维化的新靶点。
