变构促红细胞生成素对中年雌性脑缺血小鼠白质损伤的作用研究
2022-08-02王荣亮杨振宏马舒贝王韬罗玉敏焦力群
王荣亮 杨振宏 马舒贝 王韬 罗玉敏 焦力群
脑血管病以其高病死率、高致残率成为威胁人类生存的重要疾病,但至今对其仍无公认、有效的神经保护剂。近年来,研究者们对神经保护药物在缺血性卒中临床转化失败的结果中分析了很多可能原因,其中一种观点是过去治疗缺血性脑血管病时过于注重对神经元的保护,而忽略了对白质的保护[1-2]。随着现代神经影像学技术的发展,临床上发现,中枢神经系统的很多疾病都存在白质损伤,从新生儿的脑室周围白质软化、成年期的卒中到老年人的血管性痴呆,白质均是缺血、缺氧损伤的靶点[3-5]。虽然脑缺血可促使机体诱导少突胶质细胞前体细胞(oligodendrocyte precursor cells,OPCs)新生,但大部分OPCs不能发育成为成熟的少突胶质细胞,致髓鞘化不充足,影响脑缺血后的白质修复[6-7]。
在过去的30年里,基础研究结果显示,促红细胞生成素(erythropoietin,EPO)在治疗缺血性脑血管病中展现出良好的神经保护效果[8-9]。德国的一项多中心临床试验研究(Ⅱ/Ⅲ期临床试验,ClinicalTrials.gov,注册号:NCT00604630)结果表明,由于重组组织型纤溶酶原激活剂(rt-PA)联合EPO治疗急性脑缺血患者可使患者出现严重并发症,包括死亡、出血、血栓栓塞事件,因此,EPO不适用于采用rt-PA溶栓治疗的脑缺血患者[10]。然而,该临床试验的进一步分析结果表明,对于未rt-PA溶栓的脑缺血患者,EPO能产生有效的神经保护效果,改善患者的神经功能评分。这个结论与该中心第1次的EPO治疗脑缺血的临床试验结论相一致[11]。以上结果表明,EPO可能成为临床治疗缺血性卒中的潜在神经保护剂。除了不能与rt-PA联用,另一个影响EPO临床转化的问题是其促红细胞生成作用。在急性脑缺血早期,EPO需高剂量和多次全身给药,才能穿过血-脑屏障进入脑组织,达到有效的治疗浓度,这会导致严重的副作用,如血栓形成和继发性梗死[12]。值得注意的是,EPO的促红细胞生成作用与其组织保护作用可能是通过与不同受体分别独立介导的[13]。基于以上研究,我们将EPO的促红细胞生成的基因序列中位于104位的丝氨酸突变到异亮氨酸,制作成变构EPO(mutant EPO,MEPO),使EPO完全丧失了促红细胞生成活性,但仍对脑缺血小鼠具有神经保护作用[14-15]。我们最近的研究结果显示,MEPO可改善成年雄性小鼠脑缺血后神经功能,促进其白质修复[16]。本研究拟在此基础上,进一步验证MEPO对脑缺血雌性中年小鼠脑组织中胶质细胞及白质的影响,评价其保护作用,为其向临床转化研究提供更多的基础研究数据。
1 材料与方法
1.1 实验动物及分组
中年(10月龄)雌性C57BL/6J小鼠30只,体质量(25±2) g,购自斯贝福(北京)生物技术有限公司[动物许可证号:SCXK(京)2019-0010]。实验所使用的动物均经过首都医科大学宣武医院实验动物委员会批准(动物伦理号:XWH20210128),遵守动物福利和伦理的相关规定。恒温条件下饲养,实验前一晚禁食但不禁水。将30只小鼠按随机数字表法完全随机分为3组,每组10只:(1)假手术组(Sham组):分离血管,不结扎或凝断血管;(2)模型组(Vehicle组):脑缺血+与MEPO相同用量的等渗盐水;(3)MEPO组:脑缺血+MEPO。造模术后即刻按照5 000 IU/kg体质量的剂量腹腔注射MEPO或等渗盐水,每隔1 d给药1次,直到术后14 d。术后第2天开始,按照50 mg/kg体质量的剂量腹腔注射5-溴-2′-脱氧尿苷(5-Bromodeoxyuridinc,BrdU),每日1次,直至术后11 d。记录每只动物每天的体质量。将每组动物分为第1、第2两组,每组5只,记录每组动物死亡数量。第1组在术后3 d处死,取脑组织进行2,3,5-氯化三苯基四氮唑( 2,3,5-triphenyl tetrazolium chloride,TTC)染色;第2组在术后14 d取脑组织,制作冰冻切片,进行免疫荧光染色。
1.2 实验试剂与仪器
MEPO为美国匹斯堡大学曹国栋教授赠送。实验所用单抗购于北京谊诚盛盈生物科技有限公司:髓鞘碱性蛋白抗体(anti-myelin basic protein,anti-MBP,兔来源)、神经丝200抗体(anti-neurofilament 200,anti-NF200,小鼠来源)、CD16抗体(anti-CD16,大鼠来源)、CD206抗体(anti-CD206,山羊来源)、Iba1抗体(anti-Iba1,兔来源)、Iba1抗体(anti-Iba1,小鼠来源)、2′,3′-环腺苷酸-3′-磷酸二酯酶(2′,3′-cyclic nucleotide 3′-phosphodiesterase,CNPase,兔来源)、BrdU(小鼠来源)、CCAAT增强子结合蛋白β抗体(anti-CCAAT enhancer binding protein β,anti-C/EPBβ,小鼠来源)。所有二抗购自美国Jackson ImmunoResearch公司,封片剂为4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI; 0100-20,Southern Biotech,美国)。双极电凝(德威ACC100,北京天业爱博科贸有限公司)、正置免疫荧光显微镜(Eclipase 80i,日本尼康公司)、超声波细胞粉碎机(SCIENTZ-IID,宁波新芝生物科技有限公司)、冰冻切片机(CM1900,德国莱卡公司)、脱色摇床(TS1,江苏海门市其林贝尔仪器制造有限公司)。
1.3 动物模型制作
采用大脑中动脉远端血管永久性闭塞的方式制备小鼠脑缺血模型[5]将C57BL/6J小鼠用70%一氧化二氮和30%氧气混合气体及4%恩氟烷气体混合诱导麻醉,使用70%一氧化二氮和30%氧气混合气体及1.5%恩氟烷气体混合维持麻醉。仰卧位固定于手术台上,备皮后颈部正中开约1 cm的切口,钝性分离肌肉、筋膜后暴露右侧颈总动脉,进行结扎后缝合颈部切口。随后将小鼠左侧卧位固定于手术台上,于右侧外眦和耳道连线处进行备皮并开1个约0.5 cm的切口,分离并切断颞肌后暴露颅骨,用小鼠颅骨钻在颅骨上开1个直径约2 mm的孔,暴露右侧大脑中动脉主干及侧支血管后电凝后剪断。显微镜下观察动脉侧支血管无血液流出证明建模成功,缝合皮肤后用碘伏消毒,眼部涂药膏保护眼球。在手术过程中,通过温控垫将小鼠肛温维持在(37.0±0.5) °C。
1.4 体质量的记录
记录各组小鼠术前及术后第1天至第14天的体质量。
1.5 神经功能评分
采用贴条实验对小鼠感觉、运动能力进行测试。将3 mm×3 mm的贴纸贴在小鼠左前肢掌心上,放入直径15 cm的透明圆筒中,分别记录小鼠第1次触碰贴纸所用的时间(接触时间)和将贴纸撕掉所用的时间(移除时间)。术前训练3 d,以小鼠撕掉贴纸的时间少于10 s为入组标准。分别在小鼠术前、脑缺血后第1、3、5、9、12、14天进行评价。
1.6 脑梗死及脑水肿评价
小鼠脑缺血3 d后,腹腔注射水合氯醛(300 mg/kg)麻醉,用0.1 mol/L 磷酸盐缓冲液配制的0.04 g/L多聚甲醛磷酸盐溶液经右心室快速灌注,断头取脑后进行连续冠状切片(2 mm厚度),用磷酸盐缓冲液配制的0.02 g/L TTC染色,染色后红色区域为正常脑组织,白色区域为脑梗死组织。用数码相机拍摄,使用Image J图像分析软件计算脑梗死及水肿面积。脑梗死百分比=(正常侧大脑半球面积-患侧大脑半球非梗死区面积)/正常侧大脑半球面积×100%。脑水肿百分比=(正常侧大脑半球面积-患侧大脑半球的面积)/正常侧大脑半球面积×100%。
1.7 脑组织冰冻切片
小鼠脑缺血术后14 d,腹腔注射水合氯醛(300 mg/kg)麻醉,0.04 g/L 多聚甲醛磷酸盐溶液经右心室快速灌注,断头取脑,置于0.04 g/L 多聚甲醛中后固定48 h后,再经0.3 g/L 蔗糖-多聚甲醛溶液脱水。在冰冻切片机上做连续冠状切片,每片15 μm。将脑组织切片贴在含有多聚赖氨酸的载玻片上,放入-20 °C冰箱中备用。
1.8 免疫荧光检测
将冰冻切片平衡室温后,用磷酸盐缓冲液洗3次,每次5 min,随后用0.1 mol/L 磷酸盐缓冲液配制的0.03 g/L驴血清封闭2 h;按照1∶100的比例加一抗,4 ℃孵育过夜;加入相应驴来源的荧光标记二抗,室温孵育30 min;用DAPI标记细胞核及封片,荧光显微镜下观察并记录。荧光强度的比值以及双阳性细胞的计数采用Image J分析软件进行检测。
应用免疫荧光染色检测MBP和NF200,用MBP/NF200荧光强度比值评价髓鞘脱失程度,也表示白质损伤程度,两者比值越小,脑白质损伤越严重。采用Iba1标记小胶质细胞,CD16标记M1型小胶质细胞,CD206标记M2型小胶质细胞,采用免疫荧光染色检测小鼠脑缺血后14 d脑组织中小胶质细胞表型变化。用CNPase标记成熟少突胶质细胞, BrdU标记新生细胞,两者共染阳性(CNPase+/BrdU+)表示新生的少突胶质细胞。此外,用Iba1标记小胶质细胞,转录因子C/EBPβ用绿色荧光标记,C/EBPβ+/Iba1+双阳性细胞指表达C/EBPβ的小胶质细胞。
1.9 统计学分析
2 结果
术后3组小鼠存活状况显示,Vehicle组小鼠死亡2只(分别于术后12 d和13 d),MEPO组小鼠死亡1只(术后3 d),Sham组小鼠无死亡。用于术后3 d的TTC染色分析小鼠脑梗死百分比的数量为每组5只,由于染色过程中Vehicle组和MEPO组小鼠分别有2只的缺血侧脑组织发生部分丢失,因此分析小鼠脑水肿百分比的数量为每组3只。术后14 d,各组小鼠存活数量分别为Sham组5只,Vehicle组3只,MEPO组4只。因此,用于体质量、行为学分析的小鼠每组统一为3只。最终存活的所有小鼠用于后续免疫荧光分析,分别为Sham组5只,Vehicle组3只,MEPO组4只。
2.1 3组小鼠脑缺血后的体质量比较
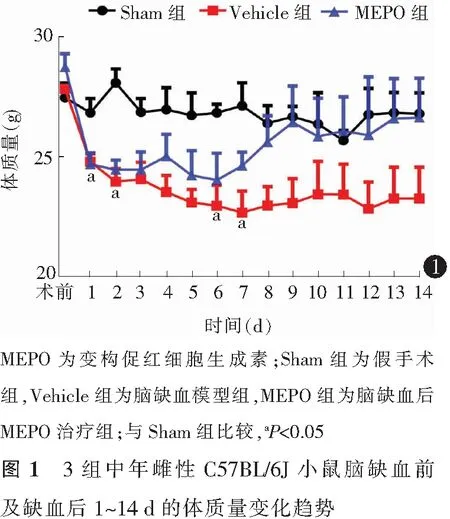
重复测量双因素方差分析结果显示,时间效应F(14,84)=5.066,P<0.01;组别效应F(2,6)=3.623,P=0.090;交叉效应F(28,84)=2.110,P=0.005。与Sham组比较,Vehicle组小鼠体质量在术后第1、2、6、7天明显降低,差异均有统计学意义(均P<0.05);与Vehicle组比较,MEPO组小鼠体质量虽然有增加趋势,但差异均无统计学意义(均P>0.05)。见表1,图1。
表1 术前与术后不同时间3组中年雌性C57BL/6J小鼠体质量的比较
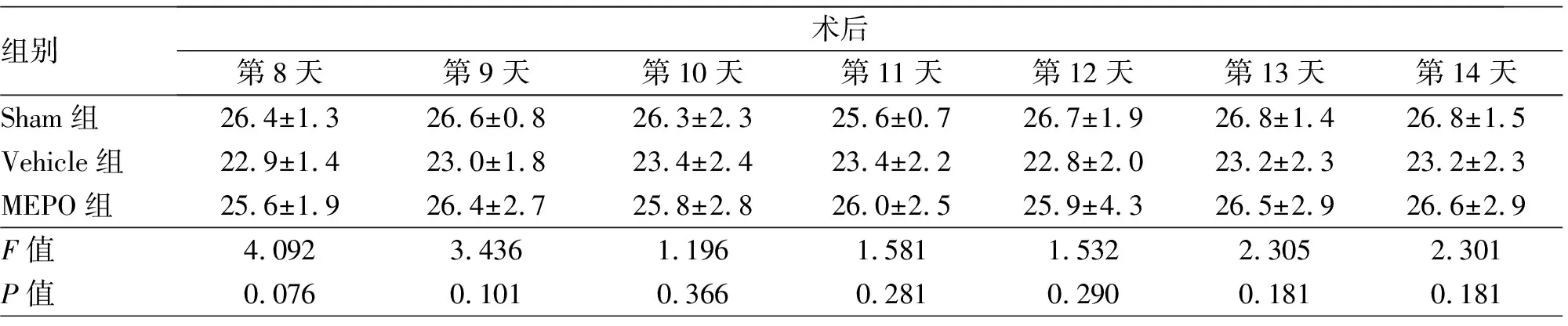
组别术后第8天第9天第10天第11天第12天第13天第14天Sham组26.4±1.326.6±0.826.3±2.325.6±0.726.7±1.926.8±1.426.8±1.5Vehicle组22.9±1.423.0±1.823.4±2.423.4±2.222.8±2.023.2±2.323.2±2.3MEPO组25.6±1.926.4±2.725.8±2.826.0±2.525.9±4.326.5±2.926.6±2.9F值4.0923.4361.1961.5811.5322.3052.301P值0.0760.1010.3660.2810.2900.1810.181
2.2 3组小鼠脑缺血后的神经功能评估
2.2.1接触时间:重复测量双因素方差分析结果显示,时间效应F(6,36)=5.003,P<0.01;组别效应F(2,6)=5.634,P=0.042;交互相应F(12,36)= 1.964,P=0.059。3组小鼠接触时间在各观察时间点差异均无统计学意义(均P>0.05)。见表2,图2a。
表2 术前与术后不同时间3组中年雌性C57BL/6J小鼠的神经功能评估结果的比较
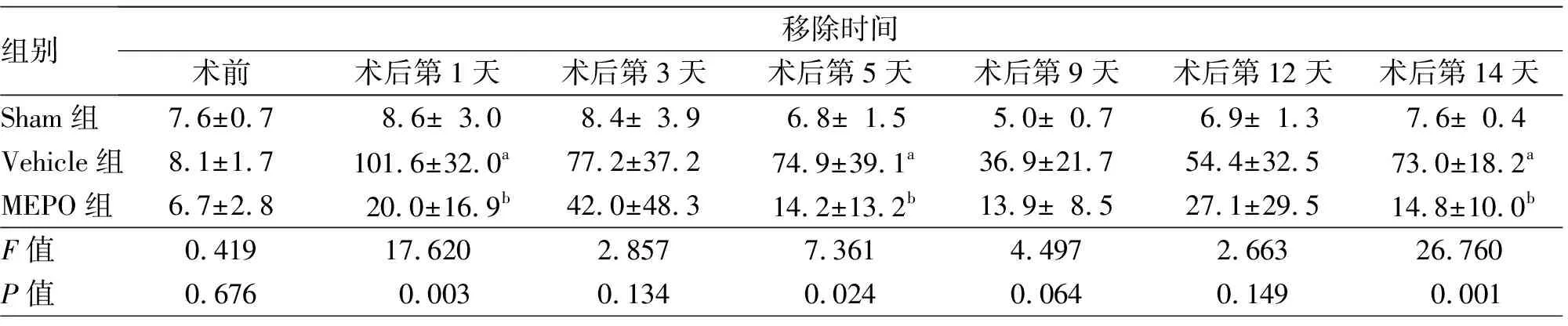
组别移除时间术前术后第1天术后第3天术后第5天术后第9天术后第12天术后第14天Sham组7.6±0.7008.6±03.008.4±03.906.8±01.505.0±00.706.9±01.307.6±00.4Vehicle组8.1±1.7101.6±32.0a77.2±37.274.9±39.1a36.9±21.754.4±32.573.0±18.2aMEPO组6.7±2.8020.0±16.9b42.0±48.314.2±13.2b13.9±08.527.1±29.514.8±10.0bF值0.41917.6202.8577.3614.4972.66326.760P值0.67600.0030.1340.0240.0640.14900.001
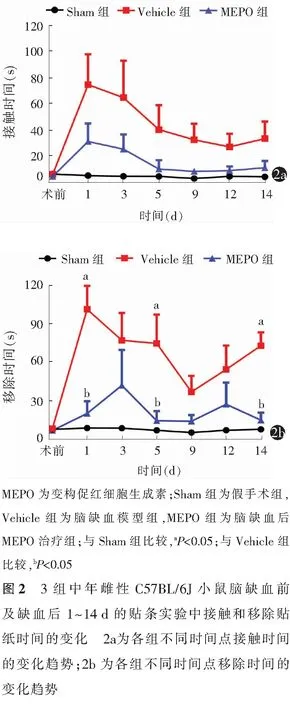
2.2.2移除时间:重复测量双因素方差分析结果显示,时间效应F(6,36)=5.320,P<0.01;组别效应F(2,6)=10.570,P=0.011(图2b);交互效应F(12,36)= 3.212,P=0.003。与Sham组比较,Vehicle组小鼠在脑缺血后第1、5、14天移除时间均明显增加(均P<0.05);而与Vehicle组比较,MEPO组小鼠在脑缺血后第1、5、14天的移除时间则明显降低(均P<0.05)。见表2,图2b。
2.3 3组小鼠脑缺血3 d后的脑梗死百分比和脑水肿百分比
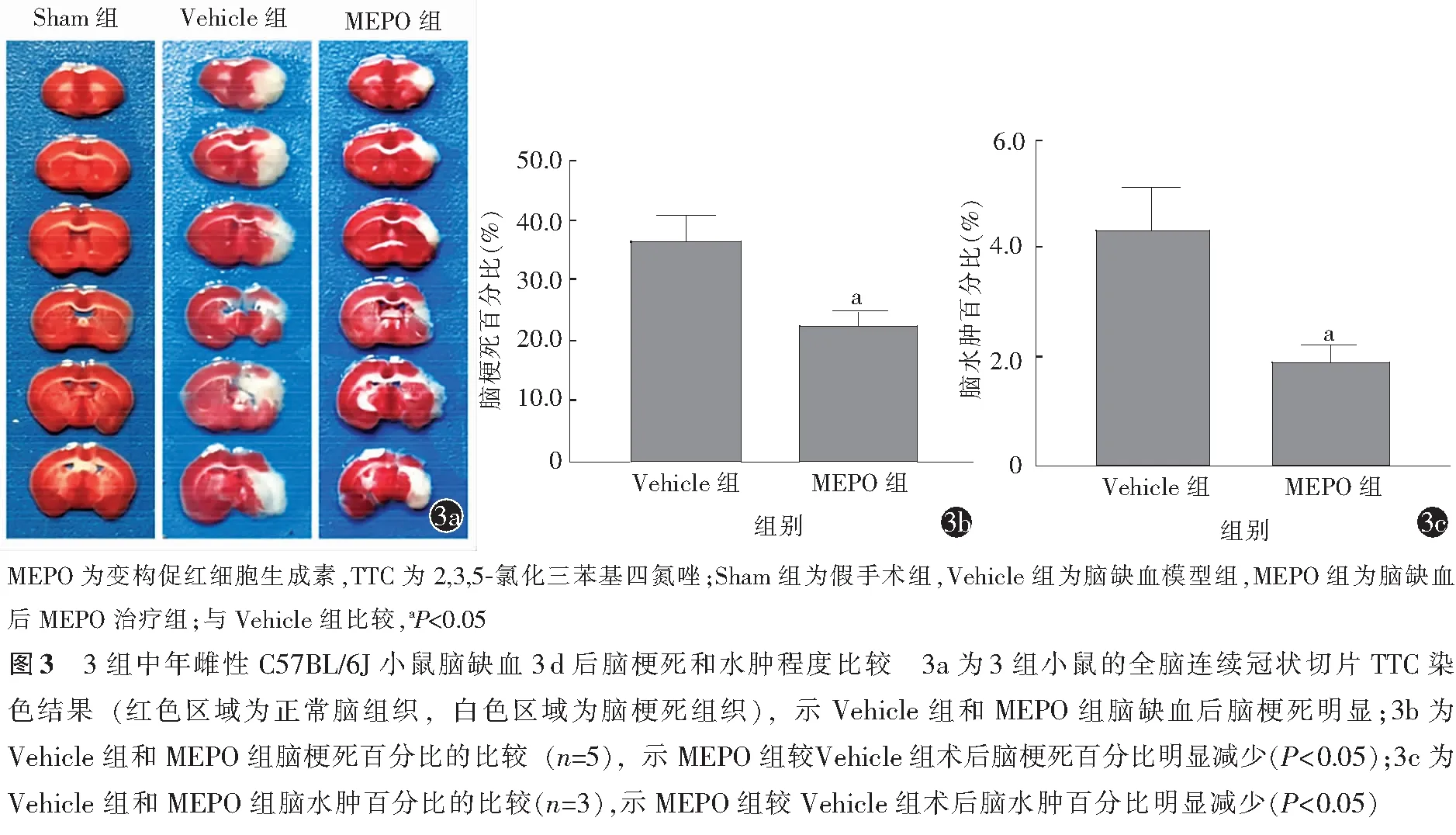
TTC染色结果显示,Sham组小鼠未发生脑梗死和脑水肿现象,故不进行测定。与Sham组比较,Vehicle组和MEPO组小鼠脑组织均出现一定程度的脑梗死(图3a)。与Vehicle组比较,MEPO组小鼠脑梗死百分比和脑水肿百分比均明显降低(均P≤0.05,图3b,3c和表3)。
表3 Vehicle组与MEPO组中年雌性C57BL/6J小鼠术后3 d脑梗死和脑水肿百分比比较
2.4 3组小鼠脑缺血后的脑白质损伤比较
脑缺血后第14天,免疫荧光染色结果显示,与Sham组小鼠脑组织相比,Vehicle组和MEPO组小鼠脑组织均出现脱髓鞘现象,而MEPO组脱髓鞘明显轻于Vehicle组(图4a)。脑缺血后第14天,Sham组、Vehicle组、MEPO组3组小鼠的MBP/NF200荧光强度比值分别为4.6±0.8、0.9±0.5、2.9±1.0,差异有统计学意义(F=18.750,P<0.01);与Sham组比较,Vehicle组和MEPO组小鼠脑组织皮质区MBP/NF200荧光强度比值显著降低(P<0.05);与Vehicle组比较,MEPO组小鼠脑组织皮质区MBP/NF200荧光强度比值显著升高(P<0.05,图4b)。

表4 Vehicle组与MEPO组中年雌性C57BL/6J小鼠术后第14天不同小胶质细胞表型数量比较个/mm2)
2.5 3组小鼠脑缺血后的小胶质细胞表型变化
免疫荧光染色结果显示,Sham组的小胶质细胞处于静息状态,未发生活化,故不做小胶质细胞活化表型的数量统计;相比Sham组,Vehicle组和MEPO组的M1和M2型小胶质细胞均发生活化。与Vehicle组比较,MEPO组中CD16+/Iba1+小胶质细胞数量呈现降低的趋势,但差异无统计学意义(P>0.05);而MEPO组中CD206+/Iba1+小胶质细胞数量较Vehicle组明显增多(P<0.05),小胶质细胞更倾向于M2表型极化。见图5,表4。

2.6 3组小鼠脑缺血后的少突胶质细胞新生
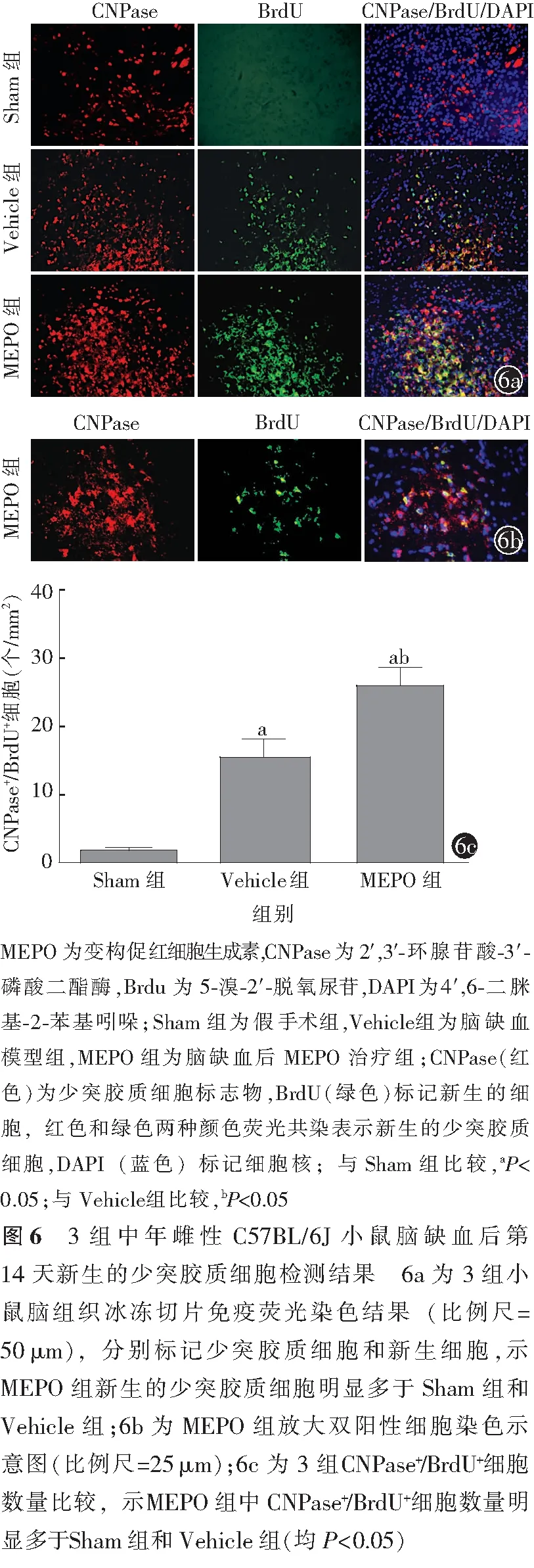
小鼠脑缺血后第14天后,免疫荧光染色结果显示,Sham组小鼠脑组织中出现少量新生的少突胶质细胞。相比Sham组,Vehicle组和MEPO小鼠脑组织中新生的少突胶质细胞数量均有一定程度增加(图6a,6b)。Sham组、Vehicle组、MEPO组CNPase+/BrdU+的细胞数量分别为(1.6±0.9)、(15.7±4.9)、(26.3±5.1)个/mm2,3组间差异有统计学意义(F=48.000,P<0.01);与Sham组比较,Vehicle组和MCAO组脑缺血同侧组织中CNPase+/BrdU+细胞数量均显著增加(均P<0.05);与Vehicle组比较,MEPO组中CNPase+/BrdU+细胞数量明显增加(P<0.05)。见图6c。
2.7 3组小鼠脑缺血后的小胶质细胞中C/EBPβ表达
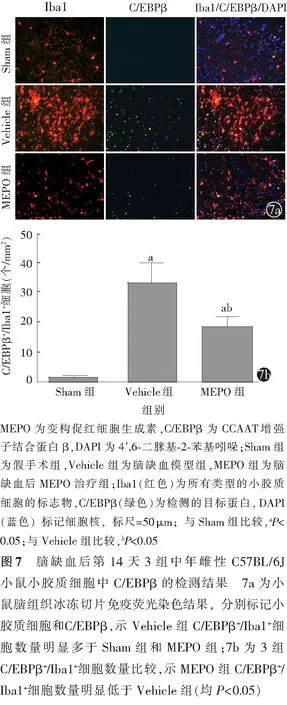
小鼠脑缺血后第14天后,免疫荧光染色结果显示,Sham组小鼠脑组织中出现少量表达C/EBPβ的小胶质细胞。相比Sham组,Vehicle组和MEPO组小鼠脑组织中小胶质细胞发生明显活化,胞体变大。此外,Vehicle组和MEPO组小鼠脑组织中C/EBPβ阳性的细胞数量也明显增加(图7a)。Sham组、Vehicle组、MEPO组C/EBPβ+/Iba1+细胞数量分别为(1.4±1.1)、(33.3±11.6)、(18.3±6.7)个/mm2,3组间差异有统计学意义(F=21.750,P<0.01)。与Sham组比较,Vehicle组和MEPO组脑缺血同侧组织中C/EBPβ+/Iba1+细胞数量均显著增加(均P<0.05);与Vehicle组比较,MEPO组中C/EBPβ+/Iba1+细胞数量明显减少(P<0.05)。见图7b。
3 讨论
神经保护药在缺血性卒中临床转化失败的一个重要原因可能是过去研究者过于关注神经元胞体(灰质)的保护,而忽略了对白质的保护[17]。白质主要由轴突纤维、少突胶质细胞和其他胶质细胞组成,少突胶质细胞产生髓鞘,包裹在轴突外,促进神经脉冲的跳跃式传导以及保护轴突。脑白质对缺血损伤十分敏感,白质损伤几乎占据梗死体积的50%,包括髓鞘损伤、白质胶质化等,可导致很严重的神经功能缺损[3,6]。因此,脱髓鞘是缺血性或出血性脑损伤的一个重要的病理现象,对髓鞘的保护也是脑血管病及多种神经变性病的治疗靶点[18-19]。缺血性卒中发生脱髓鞘,常导致进行性不可逆神经行为功能障碍,特别是老年卒中患者[20]。研究结果表明,小胶质细胞M2表型可促进少突胶质细胞新生,进而加快轴突再髓鞘化和白质修复[21]。既往研究结果显示,MEPO可以促进中年雄性小鼠脑缺血后小胶质细胞向M2表型转化,并最终修复白质[22]。本研究进一步验证MEPO保护白质的作用是否也对中年雌性脑缺血小鼠有作用。此外,本研究中采用了小鼠大脑中动脉远端血管永久性闭塞模型,充分保证了脑组织梗死位置和梗死范围的均一性。结果表明,MEPO组雌性小鼠在脑缺血急性期的脑梗死百分比及脑水肿百分比较Vehicle组均有明显降低。与之对应的神经功能在术后较短的时间内得到恢复,证实了MEPO对中年雌性脑缺血小鼠的神经保护作用。有研究显示,在新生儿胼胝体和皮质区的缺氧缺血性损伤14 d后,延迟进行EPO治疗显著增加了MBP/NF200荧光染色的比值[22]。本研究结果与之相似,MEPO显著提高中年雌性小鼠缺血性脑损伤后第14天皮质的MBP/NF200比值,提示MEPO可以抑制脑缺血后髓鞘的脱失。
小胶质细胞在脑损伤后的神经炎性反应中发挥重要作用,其与巨噬细胞有相似的特征,按照不同的作用,可分为M1和M2表型。研究表明,在损伤部位存在M1和M2激活的混合小胶质细胞,M1小胶质细胞可增加炎性反应前介质的分泌,抑制轴突再生,而M2小胶质细胞可促进神经新生[23]。因此,探寻可以调节小胶质细胞表型的分子开关,并通过干预将脑缺血后小胶质细胞向M2表型转变,是治疗脑血管病的一个可行的策略[23-24]。这种观点虽也有争议,认为将小胶质细胞分为M1表型和M2表型过于简单[25],但最近几年的研究证实了其可行性。在脑出血模型中,将小胶质细胞表型向M2转变,可以促进少突胶质细胞分化,调节白质修复[26]。既往研究结果均已证明,EPO和MEPO可以调节小鼠脑缺血后小胶质细胞的表型向M2转化,发挥保护作用[16,27]。
在本研究中,MEPO的这种作用同样体现在中年雌性脑缺血小鼠上。
C/EBP是碱性亮氨酸拉链类的转录因子,已经在C/EBP家族中发现了6个成员(α、β、γ、δ、ε、ζ)。C/EBPβ和C/EBPδ参与神经元突触可塑性,同时调节胶质细胞促进炎性反应[28]。在阿尔茨海默病的发病机制中,C/EBPβ的激活刺激载脂蛋白E4的表达,从而促进阿尔茨海默病的病理进程[29]。而这一进程很可能与小胶质细胞中C/EBPβ激活后刺激小胶质细胞分泌促炎因子相关,而抑制C/EBPβ激活可有效阻断这一进程[30]。我们的结果显示,MEPO组的小胶质细胞中C/EBPβ明显减少,这可能是促使小胶质细胞向M2表型转化的关键机制。
综上所述,本研究结果提示,MEPO减少中年雌性小鼠脑缺血后3 d的脑梗死和脑水肿程度,并改善脑缺血后的神经功能。在脑缺血后第14天,MEPO通过降低小胶质细胞中C/EBPβ的表达,调节小胶质细胞向M2表型转化,促进少突胶质细胞新生,从而达到修复脑白质的作用。
