多模态监测技术在脑动静脉畸形显微外科治疗中的应用效果
2022-08-02王娟戴嵬李伟吴凌云凌海平赵鹏来杭春华
王娟 戴嵬 李伟 吴凌云 凌海平 赵鹏来 杭春华
脑动静脉畸形(arteriovenous malformations,AVMs)的临床主要表现为反复多次出血和癫痫发作,是青年人(年龄<35岁)非创伤性脑出血死亡最常见的原因,严重影响患者的生活质量[1-2]。显微手术切除一直是AVMs最经典、最常用的治疗方式,但对于部分体积大、位置深、Spetzler-Martin分级高的病变,安全全切病灶一直是神经外科的难题[3]。随着现代科学技术的快速发展,神经导航、超声、吲哚氰绿血管造影、神经电生理等多模态监测技术逐渐应用于神经外科,尤其在神经肿瘤手术中取得了良好的治疗效果[4-5]。本研究选取我院2019年3月至2021年2月收治的51例AVMs患者,探讨多模态监测技术辅助下行显微手术治疗的效果,以期为AVMs的临床诊疗提供参考。
1 对象与方法
1.1 对象
回顾性连续纳入2019年3月至2021年2月南京大学医学院附属鼓楼医院神经外科AVMs患者51例,其中男31例,女20例;年龄13~51 岁,平均(31±11)岁;未破裂AVMs 25例(49.0%),包括以癫痫发作为首发症状者10例(19.6%),头痛、头晕、记忆力下降者10例(19.6%),局灶性神经功能障碍者5例(9.8%);破裂AVMs 26例(51.0%),表现为突发头痛、呕吐等高颅压症状,包括发病后即出现昏迷者6例,伴癫痫发作者5例;病灶位于大脑半球38例(额叶5例、颞叶6例、额颞叶6例、顶叶8例、颞顶叶4例、枕叶2例、颞顶枕叶5例、颞枕叶2例),基底节区4例,小脑7例,胼胝体部2 例;Spetzler-Martin分级Ⅰ级3例、Ⅱ级5例、Ⅲ级16例、Ⅳ级22例、Ⅴ级5例。本研究方案经南京大学医学院附属鼓楼医院伦理委员会审核批准[临研审2020(041)号],患者或其家属签署了诊疗知情同意书。
1.2 纳入与排除标准
纳入标准:有癫痫发作、头痛、头晕、神经功能障碍等临床表现;对合并癫痫发作患者,经术前长程视频脑电图确定致痫灶与AVMs病灶位置一致;经影像学检查[CT、CT血管成像(CTA)、MRI、MR血管成像(MRA)或DSA]和术后病理证实为AVMs;采用神经导航、超声、吲哚氰绿血管造影、神经电生理多模态监测技术辅助显微手术切除。
排除标准:有严重基础疾病或术前出现脑疝者;破裂出血接受急诊手术而未使用多模态监测技术或仅使用单纯介入栓塞;术后失访;资料不全。
1.3 术前准备
按照本研究团队前期报道的手术流程[6],由外科组与介入组高年资主任医师共同讨论制定手术方案,有下列情况优先考虑选择性介入栓塞联合显微外科手术:(1)AVMs直径>6 cm;(2)有大脑后动脉参与供血;(3)有脑膜动脉参与供血;(4)位于功能区;(5)位于脑深部的小型病变;(6)位于岛叶和胼胝体附近。具有前3项患者接受分期选择性介入栓塞联合显微外科手术,即先行选择性介入栓塞,术后第2天行显微外科手术,以避免介入栓塞术后即刻引起畸形团血流动力学变化以及显微外科手术切除过程中肝素化对出血的影响;其余患者接受同期选择性介入栓塞联合显微外科手术。所有选择性介入栓塞联合显微外科手术均于复合手术室进行,Spetzler-Martin分级Ⅰ~Ⅱ级患者直接于普通手术室行显微外科手术。麻醉医师参与术前讨论。
1.4 多模态监测技术辅助显微手术切除策略
全身麻醉后,所有患者接受神经导航、神经电生理监测以及术中超声监测。启动神经导航工作站(StealthStation S8,Medtronic,美国),安装参考球架,调整红外线摄像机机臂,用导航棒完成注册并设计最佳手术路径,包括皮肤切口、骨瓣大小等。启动神经电生理监测仪(Natus,XLTEK PROTEKROR),按照《中国神经外科术中电生理监测规范(2017版)》要求指定神经电生理监测方案,包括运动诱发电位、躯体感觉诱发电位、脑干听觉诱发电位、术中唤醒电刺激等,安装电极并记录基线值[7]。按照《唤醒状态下切除脑功能区胶质瘤手术技术指南(2018版)》规定,对术中唤醒患者进行显微手术切除术[8]。剪开硬脑膜前,使用多普勒超声探头(Hsl25x,6~13 MHz Linear或rP19x,1~5 Hz Phased,Fujifilm Sonosite EdgeⅡ,美国)和导航棒指引探测病灶的位置、大小、深度等,以决定硬脑膜剪开的方向。
手术过程中,根据需要可反复使用微血管多普勒超声(MultiDop X,16 MHz,DWL,德国),实时调整探测深度、取样容积等参数,将探测深度调整为3~8 cm,必要时灌注等渗盐水或等渗盐水湿润的棉片作为中介填充超声探头及病灶之间的空隙。探测血流速度、血流方向、阻力指数、搏动指数等血流动力学指标。参照文献[9-10]方法,对病变及血管的超声影像学特征进行评估,即(1)AVMs病变:在超声灰阶图像上,可表现为回声不均匀的混杂回声区;在彩色多普勒模式下,可表现为彩色镶嵌的异常血流信号,形态不规则;(2)引流静脉:血流信号较明亮,方向远离畸形团主体,为动脉化血流频谱;(3)供血动脉:血流信号明亮,方向朝向畸形团主体,为高速低阻型血流频谱;(4)畸形团内部:血流速度不等,伴湍流或涡流,引流静脉动脉化、血流速度明显高于正常皮质血管;(5)对于皮质或畸形团表面血流速度<5 cm/s的血管,可使用微血管超声进行探测,因其血流速度可精确至1 cm/s,准确性高于二维超声;(6)观察临时阻断可疑供血动脉后病灶内部血流信号的变化,以判断该动脉是否为主要供血动脉,若病灶内血流信号明显变浅、血流速度明显变慢,说明为主供血动脉。
对于AVMs位置表浅者,结合吲哚氰绿血管造影鉴别供血动脉、引流静脉等,对比剂最早通过的部分为供血动脉,最晚通过的部分为引流静脉,通常一次手术吲哚氰绿血管造影的使用次数≤4次。每次吲哚氰绿血管造影均使用FLOW800技术生成二维彩色编码图像,实时显示血管结构[6]。
AVMs病变位于功能区时,术中采用皮质体感诱发电位,以定位中央沟;进行电刺激,以定位皮质运动区;使用直接电刺激靶区,以定位语言区,并用无菌数字标签记录对刺激出现阳性反应的区域。同时,术中注意动态观察、记录神经电生理监测指标的变化,包括运动诱发电位以及躯体感觉诱发电位的潜伏期、波幅等,并与剪开硬脑膜前的基线值进行比较。如出现潜伏期明显延长、波幅降低超过50%并排除麻醉因素等异常现象,需及时与手术医师沟通,必要时暂停手术操作,调整手术方案[8]。
术前合并癫痫发作接受皮质脑电图描记者,需明确是否存在尖波、棘波、尖慢波、棘慢波等癫痫样放电,若癫痫样放电持续存在,考虑为癫痫病灶未切除完全,则继续探查和切除[7]。
术中导航、神经电生理监测提示残余病灶邻近运动或语言功能区,应复合术中介入栓塞;经术中超声或DSA确认畸形团无残余后即可止血关颅[6]。
1.5 安全性及疗效
本研究手术并发症定义为术后30 d内,因手术及其相关原因引起的急性卒中[5]、经临床及辅助检查确诊的功能障碍(语言、运动、感觉、视觉)、颅内感染[6,11]、脑积水[12-13]以及死亡等。
随访采用门诊、住院或电话的方式,分别于术后10 d、6个月对AVMs患者进行临床和影像学随访。临床随访通过改良Rankin量表(mRS)评分进行评价,分为预后良好(mRS评分0~2分)和预后不良(mRS评分3~6分)[14]。影像学随访为住院期间进行DSA、MRI、CTA等影像学的检查,主要观察畸形巢呈现情况,即治愈为AVMs完全消失,好转为残留AVMs较上一次变小,稳定为AVMs较上一次无变化,进展为AVMs较上一次变大[11-12]。
1.6 统计学分析
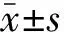
2 结果
2.1 手术结果
51例AVMs患者Spetzler-Martin分级Ⅲ~Ⅴ级占84.3%(43例),共进行开颅手术51次,其中直接显微外科手术13例,分期选择性介入栓塞联合显微外科手术31例,同期选择性介入栓塞联合显微外科手术7例;手术时间5~16 h,平均(9.2±2.9) h。
51例患者均接受神经导航、术中超声及神经电生理检查,其中30例位置表浅者行吲哚氰绿血管造影、FLOW800分析以及微血管超声;10例功能区病变采用术中唤醒(7例定位皮质运动区,3例定位语言区);15例术前癫痫发作患者术中接受皮质脑电图描记。
术后30 d内,未发卒中或死亡事件。51例患者中,治愈50例,治愈率98.0%;仅1例为好转,该患者病灶位于基底节区,术中电生理监测提示病灶周围为皮质脊髓传导束,术前有癫痫发作,未扩大切除病灶周围的胶质增生,少量残留,术后6个月随访见病灶好转,仍间断有癫痫发作,但发作次数较术前、术后10 d减少;无稳定或进展者。手术并发症发生率21.6%(11/51),包括(1)2例视觉障碍,其病灶主体位于枕叶视觉皮质,术后出现对侧视野缺损;1 例感觉性失语,病灶主体位于颞顶叶语言中枢。该3例患者出院后接受康复治疗,术后6个月随访时mRS评分3分。(2)2例小脑及1例颞顶枕叶AVMs出血患者术后出现交通性脑积水,经治疗后好转出院。(3)5例(9.8%)出现颅内感染,治愈出院。51例患者均完成了临床及影像学随访。
2.2 治疗前后mRS评分比较
51例患者无mRS评分6分者,术前、术后10 d、术后6个月预后不良患者分别为26例(51.0%)、23例(45.1%)、6例(11.8%)。随着术后时间的延长,预后良好占比增加(术后10 d和术后6个月分别为54.9%、88.2%),治疗前后mRS评分占比的差异有统计学意义(P<0.01)。见表1。

表1 51例AVMs行多模态监测技术辅助下显微手术治疗患者术前、术后10 d及术后6个月mRS评分占比比较(例)
2.3 Spetzler-Martin分级与术后6个月mRS评分的相关性
Spetzler-Martin分级与术后6个月mRS评分呈正相关(r=0.793,P<0.01)。见表2。

表2 51例AVMs Spetzler-Martin分级患者与多模态监测技术辅助下显微手术治疗术后6个月mRS评分的相关性(例)
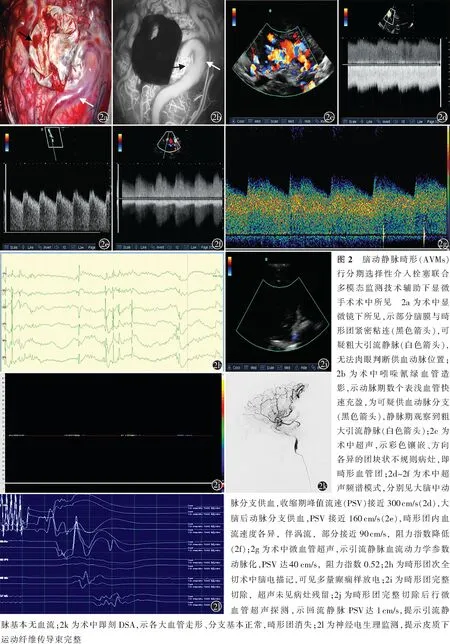
典型病例男,24岁,主因“突发性头晕、头痛1 d”于2021年1月26日收治于南京大学医学院附属鼓楼医院神经外科。患者既往身体健康。入院前1 d,患者突发头晕、头痛,就诊于当地医院,急诊查头部CT,示左侧颞顶枕叶脑出血伴脑室积血,予保守诊疗后转入我院。急诊完善头部CTA,示左侧颞顶枕叶血管畸形(图1a),遂收入我科。患者入院后出现发作性右侧肢体及面部抽搐数次,体格检查未见阳性体征。进一步行头部MRI,提示左侧颞顶枕叶病变,考虑AVMs合并蛛网膜下腔出血(图1b),弥散张量成像序列示左侧皮质脊髓束邻近病灶(图1c),动态对比增强MRI示,病灶区灌注水平明显高于正常脑组织(图1d)。DSA示大脑中动脉、大脑后动脉、脑膜中动脉等多支动脉参与AVMs病灶供血,引流静脉向深部引流至上矢状窦,病灶体积大,Spetzler-Martin分级Ⅴ级(图1e,1f)。考虑患者为Spetzler-MartinⅤ级,邻近顶叶运动区,术前有癫痫发作,故拟采用分期选择性介入栓塞联合显微外科手术。先行左侧大脑中动脉脑膜支及大脑后动脉选择性栓塞,以减少病灶供血,次日于复合手术室在神经导航+超声+吲哚氰绿血管造影+神经电生理监测多模态监测下行显微手术切除。(1)开颅前行神经导航,根据动静脉畸形的体表投影位置,行左侧额颞顶枕部马蹄形手术切口,右侧股动脉留置微导管,备术中DSA。(2)开颅后,见AVMs病灶位于颞顶枕叶皮质下,脑膜动脉已被前期栓塞,脑膜血管进入畸形团导致部分脑膜与畸形团紧密粘连,畸形团表面见可疑粗大引流静脉(图2a)。(3)吲哚氰绿血管造影动脉期见数个表浅血管快速充盈,为供血动脉分支,随后周边畸形血管逐渐显影,静脉期见粗大引流静脉。FLOW 800技术重建提示,病灶灌注明显高于周围正常脑组织,初步区分供血动脉、畸形团与引流静脉(图2b)。(4)术中超声检查确定畸形团范围及主要供血动脉:畸形团内部血流速度杂乱,呈彩色镶嵌样改变(图2c),来自大脑中动脉的供血动脉收缩期峰值流速(PSV)接近300 cm/s(图2d),来自大脑后动脉的供血动脉PSV接近160 cm/s(图2e);畸形团内血流速度各异,伴涡流,其中部分畸形血管PSV接近90 cm/s(图2f);微血管超声探测表浅回流静脉PSV达40 cm/s,阻力指数0.52,其余表浅静脉血流动力学参数动脉化,阻力指数、搏动指数均高于正常静脉(图2g)。(5)神经导航再次验证病灶边界及其与周围皮质下运动纤维传导束的关系。(6)逐步分离病灶边界,分别阻断供血动脉,切除畸形团,术中反复使用超声或微血管超声鉴别血管性质及血流动力学变化。(7)最后次全切除畸形团,顶叶部分少量残留,神经电生理监测提示病灶邻近中央后回,遂术中复合介入栓塞,保留顶叶运动功能。(8)注胶后造影,畸形团主体消失,顶枕叶皮质表面脑电描记存在多量癫痫样放电(图2h),再次探查可见局部残留少量畸形团及血肿,清除血肿及残余畸形团后脑电描记癫痫样放电明显减少。(9)超声、微血管超声及术中DSA均提示畸形团完整切除(图2i~2k),神经电生理提示皮质下运动纤维传导束完整(图2l)。术后组织病理学提示,送检组织多量血管壁结构,管壁厚薄不一,符合AVMs改变;另见脑组织神经元结构消失、退行性变伴神经胶质细胞增生。术后患者恢复良好,短期予以抗癫痫药物,出院3个月后患者自行停药,无癫痫发作。术后3 d复查头部CT提示无新发出血(图3a);术后10 d复查头部MRI提示无畸形团残留(图3b)。术后6个月随访,mRS评分2分。


3 讨论
AVMs特点是缺乏毛细血管床,畸形血管壁薄弱,当承受较大供血压力时易破裂出血,其治疗方式包括显微手术切除、血管内栓塞、立体定向放射治疗、药物保守治疗等。多项研究表明,早期积极治疗,尤其是对已破裂出血患者,开颅手术清除血肿的同时完整处理病灶,防治出血相关并发症,有助于促进术后神经功能恢复[1,13-14]。本组26例AVMs术前出现破裂出血,另外25例临床症状明显,按照本研究团队前期报道手术流程经介入组高年资主任医师评估不适宜做单纯介入栓塞术[6],选择分期或同期选择性介入栓塞联合显微外科手术治疗。AVMs显微手术的关键在于如何判断病灶边界,确定主要供血动脉的位置,辨认畸形血管团性质,保护神经功能前提下最大范围切除畸形团及其周围的胶质增生组织[5]。以往对病灶的判断主要根据手术医师对术前影像学资料的分析以及对血管解剖的理解和临床经验等,不能真实反映术中实时的变化情况,而术中多模态监测技术的应用为我们解决上述难题,提供了新的诊疗思路[4,15]。一项对AVMs治疗方式的Meta分析纳入了137项观察性研究,共46 314例患者接受了显微手术、介入栓塞或放射性治疗并获得随访,其中总病死率为0.68%,显微手术组病死率为1.00%,总再出血率为1.40%,显微手术组再出血率为0.18%,而部分Spetzler-Martin高分级患者需要接受多次手术才能达到全切的目的[16]。本组51例患者,Spetzler-Martin Ⅲ~Ⅴ级占84.3%,治愈率98.0%(50/51),无术后死亡或卒中或再次开颅手术患者,安全性高。术后6个月预后良好比例为88.2%,高于国外文献报道[AVMs显微手术治疗预后良好比例为71%(79/112)][13]。本研究51例患者术前、术后10 d预后不良患者分别为26例(51.0%)、23例(45.1%),且随着术后时间的延长,预后良好占比增加(术后10 d和术后6个月分别为54.9%、88.2%),治疗前后mRS评分占比的差异有统计学意义(P<0.01)。本研究多为复杂性Spetzler-Martin高分级AVMs,术前破裂出血比例高(51.0%),手术创伤及应激反应等引起术后预后不良的比例可能较高,但随着随访时间的延长(术后6个月),预后不良比例明显降低,与文献报道类似[13]。本组患者术后并发症发生率21.6%,其中颅内感染发生率9.8%(5/51),高于文献报道[16],其原因可能由于Spetzler-Martin高分级AVMs的手术时间相对较长、术中DSA与外科手术操作反复交替等可能增加术后感染的机会等有关。因此,对于高级别AVMs患者应加强术中感染控制的管理,控制手术时间等,以减少术后感染的发生。术后Spetzler-Martin分级与6个月mRS评分呈正相关,但本组患者术后6个月mRS评分无5分或6分者,仅1例为4分,结果表明,多模态监测技术下显微手术切除AVMs有利于改善患者预后。本研究结果与既往报道类似[14]。对于AVMs患者的治疗体会,尤其是手术风险高的Spetzler-Martin高分级患者,我们认为需要充分的术前讨论、选择复合手术方案以及完善的术中多模态监测[6]。
神经导航是将术前影像资料与实际解剖通过计算机连接起来,指导设计皮瓣切口、选择手术入路及骨瓣大小[17]。在脑血管畸形显微手术中,神经导航可准确定位直径>3 mm的供血动脉[18]。本组患者中,开颅前均进行神经导航,术前准确显示了异常血管团与周围正常脑组织的三维关系,依此对皮肤切口及手术入路进行设计。有研究表明,随着手术过程中血肿的清除、脑脊液的流失、体位的变化等因素,术中无法对解剖结构的变化、影像漂移状况进行全面有效的纠正[19]。
术中超声经济实用、操作简单,多应用于去除骨瓣后、剪开硬脑膜前定位病灶以及剪开硬脑膜后皮质表面的实时监测,弥补术中神经导航的影像漂移问题[20-21]。灰阶超声可根据实时的解剖结构,指导术者判断病变的边界及深度;彩色多普勒血流成像可通过颜色的种类以及色彩的明暗度,直观、形象地显示血流的方向、速度、范围以及是否存在血流紊乱等;频谱多普勒血流成像可通过血流速度、阻力指数、搏动指数、湍流等参数,以鉴别畸形血管及邻近的正常血管[9-10]。术中根据供血动脉的搏动指数、PSV等参数结合实时解剖,可判断供血动脉来源于前循环颈内动脉系统或后循环椎-基底动脉系统。而手术过程中术野的气泡、动脉瘤夹、止血材料以及超声参数的设置等均可能影响超声图像的清晰度,我们的经验是将探测深度调整为3~8 cm,必要时灌注等渗盐水或等渗盐水湿润的棉片作为中介物以填充超声探头与病灶之间的空隙,从而增强超声的穿透能力并减少探头与脑组织之间的摩擦,使探头易于灵活探查。
对于皮质表面或血流速度较低的血管,可通过术中吲哚氰绿血管造影或采用微血管超声,以判断血管的血流动力学特点[22]。FLOW 800技术是在原有吲哚氰绿血管造影的基础上,运用计算机软件进行数据处理,而获得二维彩色编码图像,实时、直观地显示术中血管结构及血流情况[23]。本组患者中,对于位置表浅的血管畸形,我们通过不同时相荧光信号强弱的变化来判断病灶及其周围血管的性质,初步区分供血动脉及引流静脉,在通过FLOW 800技术直观地显示病灶切除前后局部脑组织血液灌注情况。在手术实际进行过程中,我们的体会是,病灶位置较深或手术过程中止血材料、血凝块、动脉瘤夹等会影响显影质量时,术中通常将吲哚氰绿血管造影与微血管超声结合使用,以利于对AVMs病灶的实时判断及处理[15]。
微血管超声可直接放置在血管表面,迅速准确判断血流速度、搏动指数、涡流或湍流、是否合并血管痉挛等,其对于流速较慢的敏感性、特异性高,可精确到1~2 cm/s;对于流速超过110 cm/s的血流,微血管超声精确度下降[24]。本组患者中,采用了微血管超声探测表浅引流静脉的血流速度、畸形团切除后血管残端的血流速度,帮助判断畸形团残留情况,术后证实AVMs完全切除。因此,畸形团切除后,应用微血管超声监测残端无血流信号或速度极低的血流信号可间接判断AVMs完全切除。
神经电生理监测通过实时监测神经功能,辨别重要脑功能区,及早发现缺氧缺血性脑损害以及协助判断麻醉深度等,能有效避免术后永久性神经功能损伤的发生[7-8,14]。本研究按照中国神经外科术中电生理监测规范,根据具体手术部位、入路和方式,选择了运动诱发电位、躯体感觉诱发电位、脑干听觉诱发电位、术中唤醒电刺激等在内的综合监测方案[7],仅1例颞顶叶AVMs患者因术前即有意识障碍,不能完全配合指令,考虑术中唤醒麻醉风险较高,未监测语言区,而术后出现了感觉性失语。癫痫发作是AVMs第二大临床表现,存在于8%~23%的AVMs患者中,其中约30%会发展为药物难治性癫痫[25-26]。本组术前合并反复癫痫发作的15例AVMs患者,术前视频脑电图检查提示致痫灶与AVMs病灶头皮定位一致,术中结合神经电生理监测结果,在不影响运动、感觉等功能前提下,切除包括AVMs病灶、血肿、神经胶质细胞增生带等组织,其中1例患者病灶主体邻近基底节区皮质脊髓传导束,术前有癫痫发作,术中未完全切除,少量残留,术后6个月随访见病灶好转,仍间断有癫痫发作,但发作次数较术前、术后10 d减少。
综上,对于AVMs患者,结合神经导航、超声、吲哚氰绿血管造影、FLOW 800技术分析、神经电生理等多模态监测技术辅助显微手术,可互相补充,扬长补短,从而获得较好的疗效。吲哚氰绿血管造影及微血管超声适用于浅表血管,超声适用于去除骨瓣后显示病灶,神经导航的影像漂移可被以上技术弥补,神经电生理监测用于术中监测神经功能,皮质脑电描记可辅助判断致痫灶的范围。因此,有选择地联合应用多模态监测技术有利于增加术者对术中判断的准确性,使患者获得良好预后。本研究存在的不足为纳入的样本量较少,且为描述性分析,结论尚需进一步验证。
