楚雄华山松种子园无性系幼苗叶枯病病原菌鉴定
2022-08-02吕则佳陈健鑫董云祥罗正平马焕成伍建榕
吕则佳,陈健鑫,冯 峻,朱 艳,董云祥,罗正平,马焕成,伍建榕,*
(1.云南省高校森林灾害预警控制重点实验室,西南林业大学 生物多样性保护学院,云南 昆明 650224;2.西南地区生物多样性保育国家林业和草原局重点实验室,西南林业大学 林学院,云南 昆明 650224;3.云南省林木种苗工作总站,云南 昆明 650215;4.楚雄市林业和草原局国有林场,云南 楚雄 675000)
华山松(Pinusarmandii)是松科(Pinaceae)松属(Pinus)植物[1],是我国特有的用材树种、同时也是高海拔地区重要的造林树种之一[2-3]。华山松有较高的价值,针叶可提取芳香油;材质经软,耐腐,可做用材树种;种子饱满,可作干果供食用[4];华山松在医用方面有着极高的价值,例如它的松塔提取物对HIV病毒活性有一定的抑制作用[5]。
云南楚雄紫溪山华山松无性系种子园位于24°58′58″-25°04′00″N,101°22′29″-101°26′07″E,海拔2 200~2 400 m,年平均气温12 ℃,年平均降雨量1 000 mm[6]。紫溪山自然保护区是一个重要的生态旅游景区,由于气候环境条件好,人流量大,加之又连续干旱,病虫害时常发生[7],尤其华山松叶枯病发生严重,然而华山松是云南主要造林树种,在退耕还林、城乡绿化和用材林等建设中,发挥着举足轻重的作用,随着林业建设发展及其种植效益的凸显,社会对华山松的优良种子需求会越来越多。近年来对叶枯病的研究较多,例如,张凡等[8]对落羽杉赤枯病的病原进行了分离鉴定并分析了生物学特性。王忠民等[9]对油松的落针病、赤枯病病害进行了调查,总结了发病的症状及规律。目前,对华山松的研究主要集中在其种子的结实量性状、地理种群的遗传变异、种子开花习性以及与华山松息息相关的昆虫等方面[10-11],对于华山松叶枯病此类病害研究鲜有报道。
准确鉴定病原菌是研究病害发生规律及防治的基础。林晓民等[12]和张志华等[13]提出了结合核酸序列在ITS区对病原菌进行鉴定。本研究对楚雄紫溪山华山松种子园叶枯病的发生情况进行调查,通过分离华山松叶枯病的病原,运用形态学特征及分子生物学相结合的方法鉴定病原,同时在华山松幼苗上接种分离获得的纯培养物,验证其致病性以初步探索华山松幼苗叶枯病的病原种类,为华山松病害防治提供理论依据。
1 材料与方法
1.1 材料
供试标本及种子:2019年9月至2021年6月,在楚雄华山松无性系种子园采集症状明显的病叶,用信封保存带回实验室;同时将华山松幼苗采集后用尼龙网袋带回实验室备用。
供试培养基:马铃薯葡萄糖琼脂培养基(PDA)(马铃薯200 g,葡萄糖20 g,琼脂17 g,蒸馏水1 000 mL)。
供试试剂:生工柱式真菌基因组DNA抽提试剂盒、2× SanTaqPCR Mix、DNA分子量标准 Marker、4S Green Plus核酸染料、基因18SrRNA、β-tubulin(TUB)、glyceraldehyde-3-phosphate dehydrogenase (gpd)和Alta1引物,上述试剂盒及基因引物均购置于上海生工生物工程股份有限公司。
1.2 华山松幼苗叶枯病的调查
2019年9月至2021年6月,对华山松无性系种子园叶枯病的发生情况进行调查,分别调查5个样地,每个样地随机调查40株,每株在东南西北4个方向观察华山松叶枯的病叶数,并根据危害的程度参照杨光道[14]分级标准进行病害等级划分(表1)。统计并整理5个样地的发病株数,计算发病率及病情指数。

表1 华山松叶枯病的分级标准Table 1 The classification standard of leaf blight of Pinus armandii
1.3 华山松叶枯病病原菌分离及形态观察
病原菌分离方法参照方中达[15]采用组织分离法。将消毒组织块移至PDA平板中,在恒定的25 ℃生化培养箱中培养,待菌落长出后,接种针经酒精灯外焰灼烧冷却后挑取单菌落菌丝接种至PDA平板上纯化2~3次,纯菌落接种于试管斜面4 ℃保存。将纯菌落重新接种至新的PDA平板上,在生化培养箱中25 ℃培养7 d,在显微镜下观察培养菌株的分生孢子形态,并测量分生孢子的大小。肉眼观察纯培养物的菌丝颜色及是否分泌色素等性状并做好记录。
1.4 华山松叶枯病诱发性致病性试验
利用柯赫式法则验证病原菌的致病性。将获得的菌株接种至PDA平板上,在25 ℃恒温条件下培养10 d,用4 mL无菌水洗涤分生孢子后转移至10 mL的离心管中,使用血球计数板计数后调节孢子悬浮液的浓度至1×107个/mL。把50%的甘油经灭菌后与孢子悬浮液依照1∶4(v/v)充分混匀后备用。用75%的酒精将华山松幼苗的针叶进行表面消毒自然干燥后,使用无菌的竹签轻刺针叶至有微伤口,使用移液枪吸取2 mL孢子悬浮液置于喷瓶中,用2 mL孢子悬浮液等量喷5盆华山松幼苗针叶,每盆的体积为400 μL,使其孢子悬浮液均匀的喷雾至整株华山松幼苗针叶上,空白对照组喷雾等量体积的蒸馏水,接种病原菌组与对照组同时都设置3次重复。接种处理时先把单一菌株接种至华山松植株上,后将2个菌株相互交叉接种至华山松植株上,7 d后观察发病情况,对出现相似症状的样本进行分离鉴定。
1.5 病原菌的形态学特征鉴定
选择病症病状明显的有效标本,进行徒手切片,在光学显微镜(尼康,上海)下观察病原菌的分生孢子盘和分生孢子形态,并测量分生孢子的大小,使用手机拍照记录。根据徒手切片所观察的病原菌形态特征,结合文献及书籍中所描述的病原菌形态特征,对病原菌种类进行识别与鉴定,以确定病原菌的分类地位[16]。
1.6 病原菌的分子生物学鉴定及系统发育树构建
通过生工柱式真菌基因组DNA抽提试剂盒提取病原菌DNA,以提取的DNA为模板扩增18SrRNA、β-tubulin、gpd和Alta1基因。PCR反应体系总体积为50 μL,反应液为:2×SanTaqPCR Mix 25 μL,引物(10 μmol/L)各1.5 μL,模板DNA 2 μL,ddH2O 20 μL。PCR所用的基因引物、序列和反应条件见表2。PCR扩增的产物经1%琼脂糖凝胶电泳检测,将有条带的产物送至昆明硕擎生物科技有限公司测序。将测序公司返回的结果利用DNAMAN 8拼接在一起并提交至NCBI进行比对。从GenBank中选取并下载与菌株相关的ITS、β-tubulin、gpd和Alta1序列,利用MEGA 6中的邻接法(Neighbor-Joining,NJ)构建系统发育树,以1 000进行bootstrap校验。
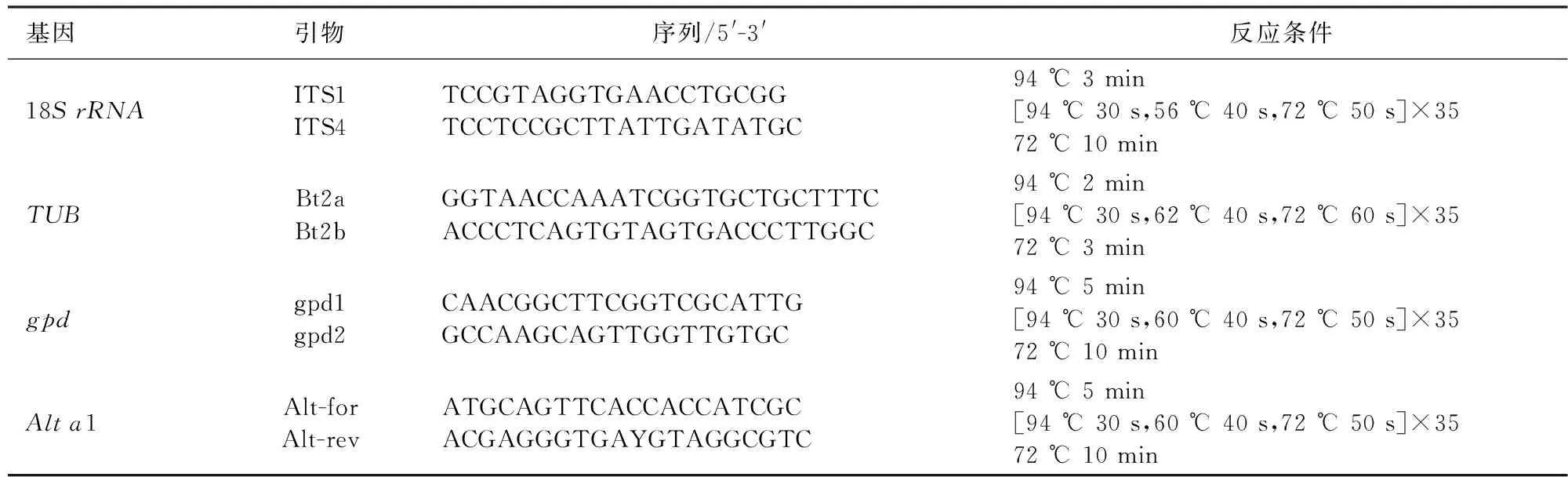
表2 本研究PCR采用的引物及反应条件Table 2 Primers and reaction conditions for PCR used in this study
2 结果与分析
2.1 华山松叶枯病调查
对华山松种子园及周边地区的华山松叶部的发病情况进行了跟踪调查。调查发现,该病害主要危害华山松的嫩叶。病原物多数由叶缘或叶尖开始侵染,发病时针叶初期呈现黄褐色小斑,后扩大变成暗褐色,最后针叶整条枯死掉落(图1)。对华山松叶枯病进行专题调查,结果显示,华山松种子园叶枯病的发病率为81.54%±0.144,病情指数为50.51±0.136。

注:a-d:针叶染病症状。图1 华山松叶枯病症状Fig.1 Symptoms of leaf blight of P.armandii
2.2 华山松叶枯病致病菌分离鉴定
2.2.1 病原菌的分离 将华山松叶枯病的标本在实验室内进行病原菌分离。分离试验共分离了60个平板,获得5个菌株,分别标号为HSS1-HSS5。出现的频率分别是41.67%、33.33%、11.67%、8.30%和5.00%,其中HSS1号菌株出现频率最高,HSS2号菌株出现频率次高,并且明显多于另外3个分离菌,为优势菌株。
2.2.2 柯赫式法则致病性验证 将纯化获得的5种分离菌株进行了致病性验证试验。结果发现,在5~7 d时,HSS1号菌株在华山松的叶片上首先表现出病症,症状表现为华山松幼苗先从叶尖或者叶缘枯死,开始时为灰绿色,逐渐会有黄褐色病斑产生,最后针叶变为赤褐色并且干枯卷曲,发病症状与自然条件下症状相同。回接的华山松幼苗叶枯部位经再次分离后能获得和原培养物一致的菌株,其菌落形态和菌丝颜色与原接种物HSS1号菌株一致,符合柯赫氏法则条件。该试验结果表明,HSS1号真菌为引起华山松叶枯病的致病菌。同样,对其他4个菌株进行致病性验证,除了HSS2得到和最初分离的纯培养物一致,其余均不满足柯赫式法则,表明HSS2号真菌也是引起华山松叶枯病的致病菌。将HSS1号菌株与HSS2号菌株相互交叉接种,结果发现2个菌株的幼苗发病均比单一接种的幼苗发病严重,表明HSS1号菌株与HSS2号菌株相互侵染会加重华山松叶枯病的发病程度(图2)。

注:a为接种无菌水(对照组);b为接种HSS1号菌株;c为接种HSS2号菌株;d为先接种HSS1号菌株后接种HSS2号菌株;e为同时接种HSS1和HSS2号菌株;f为先接种HSS2号菌株后接种HSS1号菌株。图2 华山松幼苗接种分离菌株7 d后的症状Fig.2 Symptoms of P.armandii seedlings inoculated with isolated strains for 7 days
2.2.3 华山松叶枯病病原形态学鉴定 将HSS1病原菌种接种到PDA培养基上进行培养,7 d时病原菌纯菌落正面为白色,背面为淡黄色,有轮纹;10 d 时HSS1病原菌开始产孢,在菌落表面形成黑色浓稠黏液;将HSS2号菌接种到PDA培养基上,7 d时病原菌的纯菌落正面中间为灰白色,边缘灰黑色,菌丝绒毛状;背面初期为白色,后期逐渐颜色加深变成黑色(图3)。
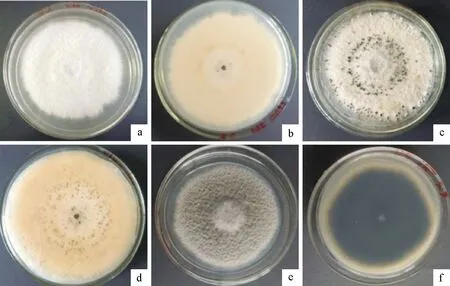
注:a、b为HSS1号菌培养7 d菌落;c、d为HSS1号菌培养10 d菌落;e、f为HSS2号菌培养7 d菌落。图3 病原菌在PDA培养基上纯菌落形态Fig.3 Morphology of pure colony of pathogens on PDA medium
HSS1病原菌的分生孢子盘为黑色。分生孢子为纺锤形,有3~4个隔膜,由5个细胞组成,分生孢子平均大小为22.1 μm×6.1 μm,中间3个细胞呈浅褐色,长为13.2~17.9 μm。两端细胞圆锥形,无色透明。分生孢子顶端细胞上着生2~3根无色附属丝,顶端的附属丝长9.4~18.2 μm,基部细胞上着生1根附属丝,中生,长3.5~13.4 μm。HSS2号菌的分生孢子串生成链状,基部稍钝圆,有纵横分隔,分生孢子大小平均为18.9~8.1 μm(图4)。

注:a为HSS1号菌的分生孢子盘;b为HSS1号菌的分生孢子;c、d为HSS2号菌的分生孢子。图4 华山松叶枯病病原菌的形态特征Fig.4 Morphological characteristics of pathogens of leaf blight of P.armandii
2.2.4 华山松叶枯病病原分子鉴定 联合ITS和β-tubulin基因片段对HSS1号病原菌构建系统发育树,菌株HSS1与P.lespedezae聚为一支,结合形态学鉴定和分子生物学鉴定结果,初步鉴定引起华山松叶枯病的HSS1号病原菌为胡枝子拟盘多毛孢(P.lespedezae);联合ITS、gpd和Alta1基因片段对HSS2号病原菌构建系统发育树,菌株HSS2与A.alternata聚为一支,结合形态学特征将HSS2号病原菌鉴定为互隔链格孢(A.alternata)(图5、图6)。
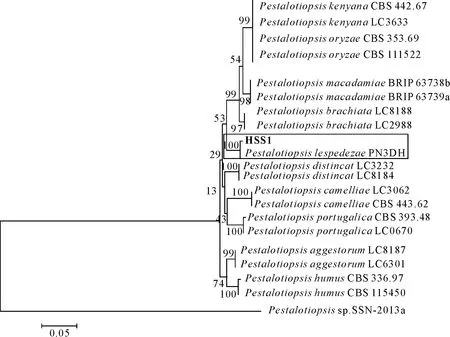
图5 联合ITS和β-tubulin基因片段对HSS1号病原菌构建系统发育树Fig.5 Phylogenetic tree of HSS1 based on the concatenated data of ITS and β-tubulin sequences
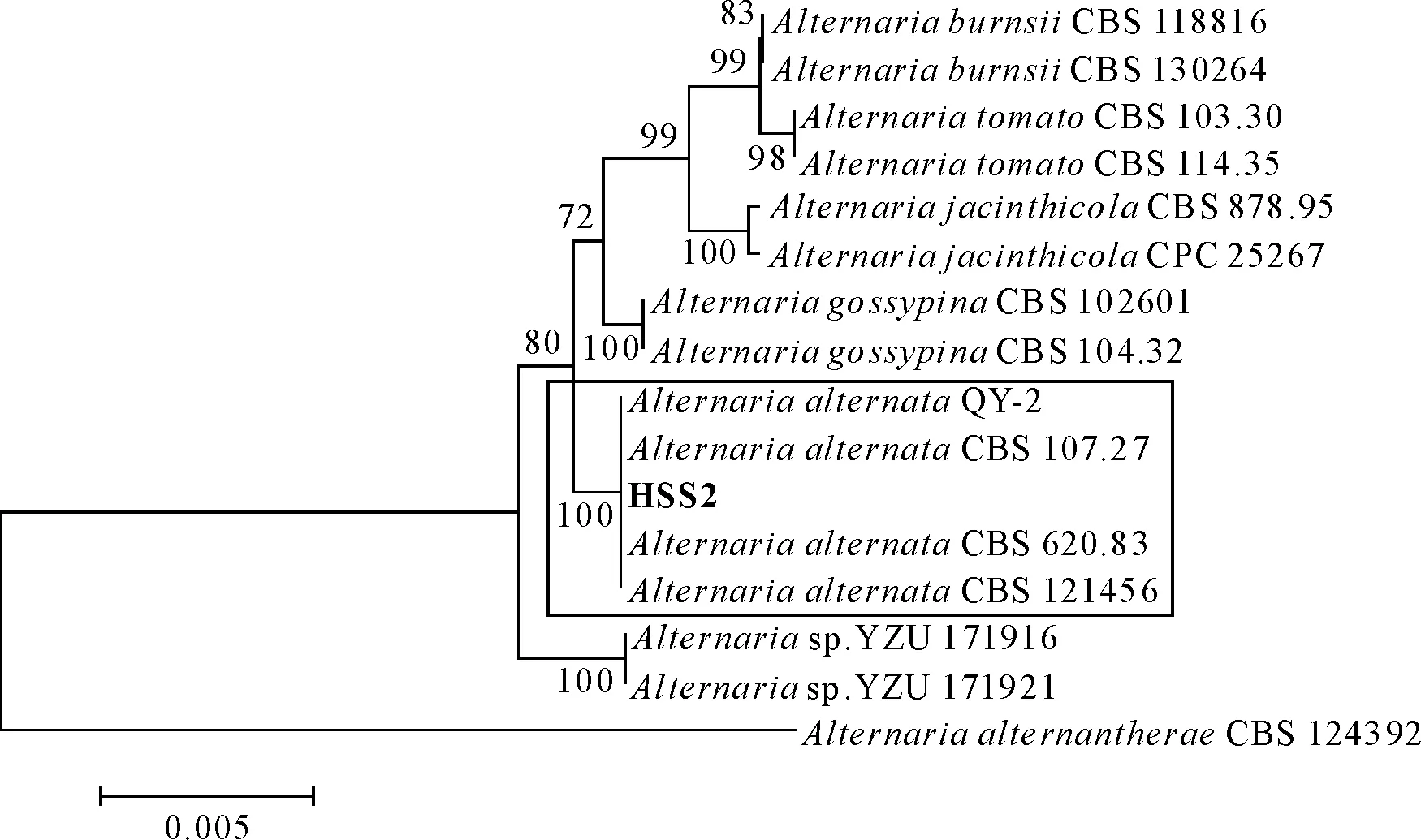
图6 联合ITS、gpd和Alt a1基因片段对HSS2号病原菌构建系统发育树Fig.6 Phylogenetic tree of HSS2 based on the concatenated data of ITS、gpd and Alt a1 sequences
3 结论与讨论
对从华山松幼苗病叶上分离得到的真菌进行了形态学鉴定及分子生物学鉴定,形态学鉴定与分子生物学鉴定结果一致,经致病性测定,最后确定了引起华山松幼苗叶枯病的病原菌为胡枝子拟盘多毛孢(P.lespedezae)和互隔链格孢(A.alternata)。这在国内华山松上属于首次发现及报道。
近年来随着华山松在我国种植面积的不断扩大,病害问题也愈发凸显。华山松易感染叶枯病,该病引起叶片变黄、变枯,提前落叶,影响了华山松的生长发育。目前对华山松叶枯病的研究尚属空白。本研究通过对华山松幼苗叶枯病的症状观察、病原的形态学鉴定和分子生物学鉴定,确定了华山松叶枯病的病原为胡枝子拟盘多毛孢(P.lespedezae)和互隔链格孢(A.alternata)2种,这与匙明强等[17]报道的水杉赤枯病两种病原为同属的不同种。本研究为了明确P.lespedezae与A.alternata的关系,将P.lespedezae与A.alternata2个菌株相互接种,发现接种2个菌株的幼苗发病均比单一接种的幼苗发病严重,这也明确了P.lespedezae与A.alternata的关系:2个菌株均为引起华山松叶枯病的病原,当2个菌株相互侵染华山松幼苗时会加重叶枯病的发病程度。经过查阅相关的文献资料发现,前人报道的油松[18]、马尾松[19]、杉木[20-21]和樟子松[22]的发病特点及症状相似,表现在发病初期,叶片从叶尖开始发生干枯逐渐变成褐色,初期显黄色段斑,病斑和健康组织交界处常有暗红色的环圈,后期病叶表面产生黑色的小点,严重时导致华山松提前落叶或幼苗死亡。但不同的是病原是该病原菌同属下的其他种,如引起油松和马尾松赤枯病的病原为枯斑盘多毛孢(P.funerea)[18-19]。而引起樟子松赤枯病的病原为柠檬拟盘多毛孢(P.citrina)[22]。
拟盘多毛孢属Pestalotiopsissp.是一类重要的病原菌,它会引起植物叶斑和叶枯症状,严重时导致植物死亡[23-24]。目前,对于拟盘多毛孢属形态鉴定有一定的难度,分子鉴定方面基于ITS基因鉴定得较多,但是现阶段仅靠ITS基因鉴定无法更好地鉴定属内的亲缘种[25]。本研究基于ITS和β-tubulin2个基因联合构建系统发育树,结合形态学特征,更加准确地鉴定了胡枝子拟盘多毛孢(P.lespedezae)是引起华山松叶枯病的病原之一。链格孢属(Alternariasp.)的真菌在形态上很容易根据形态特征鉴定到属,如若需要准确鉴定到种的水平较难,这是因为小孢子种间序列相似性高,仅仅依靠ITS基因序列分析不能将小孢子种更好地区别开[26]。此时便需要结合多个基因引物来鉴定到种。本研究采用多对引物来扩增产物并联合ITS、gpd和Alta1多基因构建系统发育树,结合形态学特征准确鉴定了互隔链格孢(A.alternata)是引起华山松叶枯病的另一个病原。本研究通过形态鉴定与分子鉴定相结合的方法明确了引起华山松叶枯病的病原菌,这为之后进一步研究病原菌的其他特性奠定了基础,同时也为之后病害的防治提供了理论依据。
