模拟失重下miR-212-3p/SIRT1通路调控微血管内皮细胞增殖
2022-08-02徐丽群张晓雁张丽君胡泽兵曹新生
徐丽群,张晓雁,张丽君,孙 权,薛 桐,胡泽兵,曹新生,石 菲,张 舒
(空军军医大学航空航天医学系生物动力学教研室,航空航天医学教育部重点实验室,陕西 西安 710032)
内皮细胞对机械刺激高度敏感,通过将机械刺激转化为细胞内信号从而调节内皮及血管功能[1]。长时间太空飞行或卧床严重影响心血管系统功能,已成为影响中长期航天飞行的重要问题。已有报道微血管内皮细胞在血管稳态和局部血流中起着关键作用,微循环系统中的内皮功能障碍会导致严重的心血管功能失调[2]。微小RNA(microRNA,miRNA)是一类长度为21~23个核苷酸的非编码RNA,通过与靶基因的3′-UTR结合导致转录抑制和信使RNA(messenger RNA,mRNA)降解。研究表明,miRNA在内皮细胞功能、血管生成、血管炎症等与血管功能相关的过程中发挥重要作用[3-4]。此外,miR-27b-5p、miR-503-5p和miR-151a等对机械刺激敏感,并对内皮细胞作用显著[5-7]。最近研究表明,miR-212-3p能够抑制肿瘤细胞增殖[8]。然而,模拟失重下miR-212-3p表达是否发生变化及是否影响微血管内皮功能尚不清楚。沉默信息调节因子2相关酶 Ⅰ(silent information regulator 1,SIRT1)是一种烟酰胺腺嘌呤二核苷酸依赖性去乙酰酶,可对组蛋白和非组蛋白等转录因子进行去乙酰化,参与调控细胞衰老、基因转录、能量平衡和氧化应激[9]。研究表明SIRT1通过调控细胞的增殖、迁移在血管发育和生成中发挥至关重要的作用[10]。本研究以小鼠微血管内皮细胞系bEnd.3细胞为研究对象,检测模拟失重下微血管内皮细胞中miR-212-3p及SIRT1是否差异表达,并进一步探究miR-212-3p及SIRT1在微血管内皮细胞中的功能及机制[10]。本研究将有助于深化对失重导致的心血管功能失调发生机制的理解,为寻求新的治疗靶点提供实验依据。
1 材料与方法
1.1 材料
小鼠脑微血管内皮细胞系bEnd.3(中国科学院上海细胞库);高糖培养基(Gibco公司);胎牛血清(Gibco公司);青-链霉素双抗(Gibco公司);胰蛋白酶(Gibco公司);2D回转器(中国航天员科研训练中心);mimic-212-3p、inhibitor-212-3p、pcDNA3.1-SIRT1及相应的阴性对照(上海吉玛制药技术有限公司);RNAiso Plus细胞裂解液、SYBR®PremixExTaqTM、Mir-X miRNA First-Strand Synthesis Kit、Prime Script®RT Reagent Kit(TaKaRa公司);M-PER哺乳动物蛋白抽提试剂(Thermo Fisher Scientific公司);BCA蛋白定量试剂盒(美国Sigma公司);PVDF膜(美国Invitrogen公司);qRT-PCR仪(美国Bio-Rad公司);Cell Counting Kit-8(CCK-8)试剂盒(中国碧云天公司);5-乙炔基-2′-脱氧尿苷(5-ethynyl-2′-deoxyuridine,EdU)试剂盒(中国碧云天公司);酶标仪(Bio-Rad公司);化学发光仪(Tanon-4200,上海天能科技有限公司)。
1.2 方法
1.2.1 细胞培养 用含有100 mL/L胎牛血清、10 mL/L青霉素和链霉素的高糖培养基,在50 mL/L CO2、95%湿度、37°C培养箱中常规培养微血管内皮细胞,实验均用第4~8代的细胞。
1.2.2 细胞模拟失重实验 采用2D回转器模拟地面细胞的失重环境,将bEnd.3细胞以6×105个/瓶的密度接种于25 cm2专用回转培养瓶中常规培养。细胞贴壁后,将培养瓶灌满培养基并盖塞子,确保完全去除气泡。然后,将培养瓶放入回转器中,以24 r/min的速度绕水平轴回转24、48和72 h,获得的细胞为失重组。对照组置入相同环境中常规培养,不进行回转。细胞分为Con组和Clino组。
1.2.3 细胞转染 将bEnd.3细胞以1×105个/孔的密度传至6孔板,用有血清无双抗的培养基常规培养过夜,细胞密度为60%~80%时转染。使用Lipofectamine 2000将mimic-212-3p(40 nmol/L)、inhibitor-212-3p(80 nmol/L)、pcDNA3.1-SIRT1(100 mg/L)及其相应的阴性对照转染至bEnd.3细胞,无血清无双抗培养基培养6~8 h后更换为有血清无双抗培养基常规培养。细胞分组为:mimic-NC组、mimic-212-3p组、inhibitor-NC组、inhibitor-212-3p组、mimic-212-3p+ pcDNA3.1(+)组和mimic-212-3p+ pcDNA3.1-SIRT1组。RNA Oligo序列见表1。

表1 RNA Oligo序列
1.2.4 挽救实验 将bEnd.3细胞以适当的密度传至回转培养瓶,并用有血清无双抗的培养基培养过夜,当细胞密度为60%时转染。转染后灌满培养基并加塞,将培养瓶置于2D回转器并以24 r/min转速围绕其水平轴旋转48 h。细胞分为Con组、Clino组、Clino+inhibitor-NC组和Clino+inhibitor-212-3p组。
1.2.5 实时荧光定量PCR 用RNAiso Plus提取bEnd.3细胞总RNA,并逆转录为互补DNA。使用PrimeScriptTMRT Master Mix Kit或Mir-X miRNA First-Strand Synthesis Kit将RNA逆转录成cDNA,以GAPDH或U6作为内参基因。采用CFX96 real-time PCR检测系统和SYBR®PremixExTaqTMII检测mRNA和miRNA的表达水平,采用Ct(2-ΔΔCt)计算样本间miRNA或mRNA的相对表达量。PCR引物序列见表2。

表2 基因引物序列
1.2.6 蛋白质印迹分析 胰酶消化,收集并裂解细胞提取bEnd.3细胞的总蛋白。超声裂解蛋白样本,在12 000 r/min、4 ℃下离心10 min并吸取上清后进行BCA定量。按照Western blotting操作说明进行凝胶电泳,转膜,50 g/L脱脂牛奶封闭2 h后与特异性一抗GAPDH(1∶1 000;Cell Signaling Technology,美国),增殖细胞核抗原(proliferating cell nuclear antige,PCNA)(1∶1 000;Cell Signaling Technology,美国)和SIRT1(1∶1 000;Proteintech,美国),4 ℃孵育过夜。然后,洗膜,将膜与二抗孵育2 h(1∶5 000;中杉金桥公司,中国),使用凝胶成像仪拍照。利用Image J软件进行定量分析。
1.2.7 CCK-8法检测细胞活性 将细胞以2×107个/L(100 μL/孔)的密度接种在96孔板中,并在37 ℃下孵育。分别于0、24、48、72 h加入CCK-8试剂(10 μL/孔),37 ℃孵育2 h,使用酶标仪检测A450 nm值。每组至少设3个重复,所有实验至少重复3次。
1.2.8 EdU检测细胞增殖 EdU是一种胸腺嘧啶类似物,可以在DNA合成过程中替代胸腺嘧啶掺入到新合成的DNA中以评估细胞增殖率。将细胞以1×108个/L的密度接种于6孔板中并培养过夜,每孔细胞加入50 μmol/L EdU试剂,37°C孵育4 h。严格按照EdU细胞增殖检测试剂盒说明书操作,EdU阳性细胞(红色)与4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)阳性细胞(蓝色)的比率表示细胞增殖率。
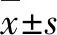
2 结果
2.1 模拟失重下miR-212-3p表达上调并抑制微血管内皮细胞增殖
为了探究miR-212-3p是否在模拟失重下差异表达,将微血管内皮细胞置于2D回转器培养24、48和72 h后进行qRT-PCR检测,结果表明miR-212-3p的表达显著升高,其中在48 h升高最明显(P<0.01,图1A)。为了进一步探究miR-212-3p在微血管内皮细胞中的作用,向bEnd.3细胞中转染mimic-NC、mimic-212-3p、inhibitor-NC或inhibitor-212-3p。与NC组相比,mimic组的PCNA蛋白水平表达显著下降,而inhibitor组的PCNA蛋白水平升高(P<0.01,图1B)。此外,CCK-8及EdU实验表明过表达miR-212-3p能够显著抑制微血管内皮细胞的增殖能力(P<0.05或P<0.01,图1C~D)。
A:模拟失重24、48、72 h后bEnd.3细胞的miR-212-3p 表达(bP<0.01 vs Con组);B:转染mimic-NC、mimic-212-3p、inhibitor-NC、inhibitor-212-3p后bEnd.3细胞的PCNA蛋白表达;C:EdU法测定细胞增殖率;D:CCK-8法测定细胞增殖速率 (aP<0.05, bP<0.01 vs NC组)。PCNA:增殖细胞核抗原;EdU:5-乙炔基-2′-脱氧尿苷;DAPI:4′,6-二脒基-2-苯基吲哚。图1 模拟失重下bEnd.3细胞中miR-212-3p的表达及功能变化
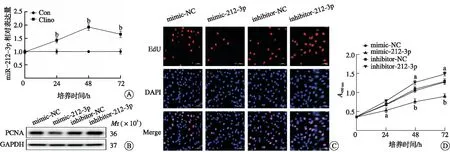
2.2 抑制miR-212-3p可部分缓解模拟失重导致的微血管内皮细胞增殖抑制
为了探究模拟失重能否通过miR-212-3p调节微血管内皮细胞的增殖,将inhibitor-212-3p转染bEnd.3细胞后在回转器中培养48 h。与Clino组相比,Clino+inhibitor-212-3p组PCNA蛋白表达增加,但低于Con组PCNA蛋白表达量(P<0.01,图2A)。CCK-8及EdU实验得到了相同的结果(图2B~C),提示沉默miR-212-3p可以减轻模拟失重导致的微血管内皮细胞增殖抑制,miR-212-3p或可成为潜在的干预靶点。
A:转染inhibitor-212-3p后模拟失重48 h,PCNA的蛋白表达;B:CCK-8法测定细胞增殖速率(aP<0.05, bP<0.01 vs Con组);C:EdU法测定细胞增殖率。PCNA:增殖细胞核抗原;EdU:5-乙炔基-2′-脱氧尿苷;DAPI:4′,6-二脒基-2-苯基吲哚。图2 miR-212-3p沉默可挽救模拟失重导致的微血管内皮细胞增殖抑制
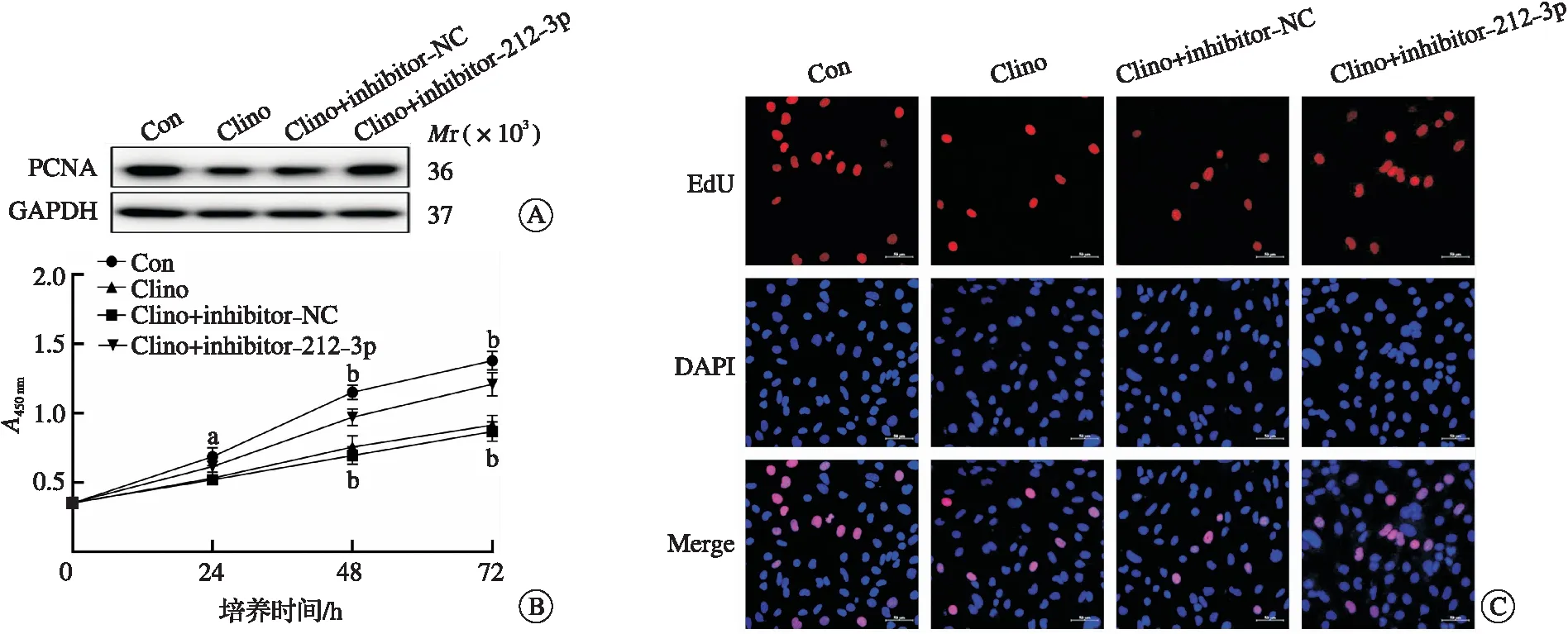
2.3 miR-212-3p靶向SIRT1并负调控SIRT1表达
为探究miR-212-3p调控微血管内皮细胞增殖的潜在机制,我们利用miRDB数据库筛选并验证出miR-212-3p的潜在靶点SIRT1。在模拟失重过程中,miR-212-3p表达水平升高,而SIRT1的表达降低(P<0.05,图3A)。向bEnd.3细胞中转染mimic-212-3p或inhibitor-212-3p后,qRT-PCR和Western blotting结果显示miR-212-3p能够显著降低细胞中SIRT1的mRNA和蛋白表达水平(P<0.01,图3B~C)。此外,已有研究通过荧光素酶报告基因证实了miR-212-3p和SIRT1之间的靶向结合关系[11-12]。miR-212-3p过表达可显著降低SIRT1 3′-UTR WT载体的荧光素酶活性,但对miR-212-3p结合位点突变的SIRT1 3′-UTR MUT载体没有影响。在模拟失重过程中抑制miR-212-3p可部分恢复失重导致的微血管内皮细胞中SIRT1表达量降低(P<0.01,图3D)。这些结果表明,SIRT1是miR-212-3p的一个重要靶点,且能感知机械刺激。
A:模拟失重24、48、72 h后bEnd.3细胞的SIRT1 mRNA表达(aP<0.05, bP<0.01);B:转染mimic-NC、mimic-212-3p、inhibitor-NC、inhibitor-212-3p后bEnd.3细胞的SIRT1 mRNA表达(bP<0.01);C:转染mimic-NC、mimic-212-3p、inhibitor-NC、inhibitor-212-3p后细胞中SIRT1蛋白表达;D:转染inhibitor-212-3p后模拟失重48 h,SIRT1的蛋白表达。PCNA:增殖细胞核抗原;EdU:5-乙炔基-2′-脱氧尿苷;DAPI:4′,6-二脒基-2-苯基吲哚。图3 miR-212-3p靶向SIRT1并负调控SIRT1表达
2.4 miR-212-3p依赖SIRT1负调控微血管内皮细胞增殖
为了验证miR-212-3p是否通过靶向SIRT1调节微血管内皮细胞功能,将mimic-212-3p和pcDNA3.1-SIRT1或其阴性对照共转染至bEnd.3细胞。与mimic-NC组相比,mimic组的微血管内皮细胞增殖能力显著降低(P<0.01,图4A);而共转染pcDNA3.1-SIRT1后,细胞中PCNA表达升高(P<0.05,图4A);CCK-8和EdU检测结果也表明转染pcDNA3.1-SIRT1可明显改善miR-212-3p导致的bEnd.3细胞增殖抑制(P<0.05,图4B~C),提示miR-212-3p依赖SIRT1负调控微血管内皮细胞增殖。
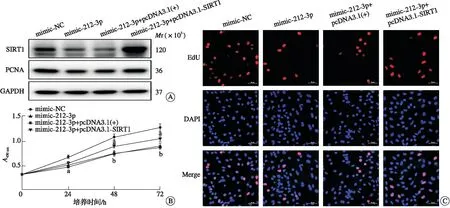
A:mimic-212-3p和pcDNA3.1-SIRT1或pcDNA3.1(+)共转染至bEnd.3细胞后SIRT1和PCNA蛋白的表达;B:CCK-8法测定细胞增殖速率(aP<0.05, bP<0.01 vs mimic-NC);C:EdU法测定细胞增殖率。PCNA:增殖细胞核抗原;EdU:5-乙炔基-2′-脱氧尿苷;DAPI:4′,6-二脒基-2-苯基吲哚。图4 miR-212-3p依赖SIRT1负调控微血管内皮细胞增殖
3 讨论
血管内皮是高度动态的组织,对机械刺激十分敏感。失重环境下血流动力学水平下降,血管局部剪切应力降低,从而导致血管内皮细胞形态、超微结构、以及分泌、增殖、凋亡和血管生成功能的改变[13-14]。研究表明,微重力损伤微循环功能,抑制微血管内皮细胞的增殖,促进细胞凋亡[2,15]。由于微血管内皮在调节血管稳态和局部血流中起着至关重要的作用,因此微重力导致的微血管内皮功能障碍与多种心血管疾病密切相关。为阐明模拟失重对微血管内皮细胞的影响,我们检测了模拟失重下bEnd.3细胞中miR-212-3p及SIRT1的表达变化,并探索了其潜在的机制。微重力导致的心血管功能失调目前仍是困扰中长期航天飞行的问题,因此迫切需要探索其潜在的分子机制,为制定有效的干预措施提供科学依据。
miRNAs参与血管生成的多个过程[16]。miR-29b通过靶向AKT3抑制VEGF和c-Myc的表达,从而抑制血管生成和肿瘤发生[17];miR-1908、miR-199a可以协同抑制ApoE/LRP1/LRP8信号通路,抑制黑色素瘤血管生成和肿瘤转移[18]。miR-212-3p作为一个肿瘤抑制因子,参与调节肿瘤细胞增殖、凋亡及迁移[19-20]。此外,研究报道miR-212-3p可通过靶向SGK3抑制胶质母细胞瘤血管生成和增殖[21]。本研究发现miR-212-3p是一个机械敏感性miRNA且在失重下表达增多。敲除及过表达实验结果表明miR-212-3p能够显著抑制微血管内皮细胞增殖;通过模拟失重下挽救实验进一步验证抑制miR-212-3p可以部分缓解模拟失重导致的微血管内皮细胞增殖抑制,但无法完全逆转,表明miR-212-3p参与模拟失重导致的增殖抑制。此外,通过生物信息学分析我们预测并进一步验证了miR-212-3p的下游靶基因SIRT1。PCR及Western blotting结果表明miR-212-3p能够在转录及转录后水平抑制SIRT1的表达,此外,有文献报道miR-212-3p能够直接靶向SIRT1的3′-UTR。然而目前关于模拟失重能否通过miR-212-3p/SIRT1通路调控微血管内皮细胞增殖功能的研究尚未报道,我们展开了进一步的探索和验证。
SIRT1是基因转录、细胞代谢的关键调控因子。研究表明SIRT1在血管内皮稳态、血管新生和内皮功能障碍的调节中至关重要。SIRT1介导的去乙酰化参与调控血管萌发和血管生成。SIRT1敲除显著抑制体新生血管萌芽及生成,导致斑马鱼和小鼠的血管形成缺陷和新生血管受损[22]。此外,SIRT1通过调控Nrf2信号通路在宫颈癌细胞增殖、凋亡及迁移侵袭过程中起着重要作用[23]。本实验发现SIRT1在模拟失重下表达下降,表明SIRT1对模拟失重敏感;miR-212-3p和pcDNA3.1-SIRT1共转染实验发现转染pcDNA3.1-SIRT1后可明显改善miR-212-3p导致的bEnd.3细胞增殖抑制,但增殖能力仍比阴性对照组低,表明miR-212-3p依赖SIRT1负调控微血管内皮细胞增殖。
本研究中,我们发现模拟失重促进bEnd.3细胞中miR-212-3p的表达,而抑制SIRT1的表达。分别向细胞中转染mimic-212-3p或inhibitor-212-3p进行功能实验发现,miR-212-3p能够抑制bEnd.3细胞中SIRT1的表达并抑制细胞增殖。此外,抑制miR-212-3p可以部分缓解模拟失重导致的微血管内皮细胞增殖抑制。以上实验结果提示miR-212-3p通过负调控SIRT1从而抑制微血管内皮细胞增殖。综上所述,本研究阐明了miR-212-3p/SIRT1通路在微血管内皮细胞中的作用,并为干预失重导致的心血管功能失调提供了一个潜在的治疗靶点。
