苯磺酸氨氯地平通过调控MAPK/ERK 信号通路影响大鼠主动脉夹层血管修复的研究
2022-08-02张璐廖辉王旭朱夔妞杨红霞唐雪龙
张璐 廖辉 王旭 朱夔妞 杨红霞 唐雪龙
主动脉夹层发生时主动脉壁真假两腔分离,起病急骤,患者可在短期内并发休克而死亡。当前,越来越多的技术用于改善和治疗主动脉夹层,但手术仍是主流治疗方式。虽然约70%的主动脉夹层患者可通过手术获得近期存活机会,但仍有不少患者在获救前已发生猝死,且死于手术后远期主动脉远端动脉瘤的形成与破裂的患者高达26%,因此主动脉夹层发病机制与治疗一直是心血管领域备受关注的难点[1]。苯磺酸氨氯地平片常被用于治疗高血压、冠心病,对于主动脉夹层的治疗亦具有调控作用,但其对于主动脉夹层患者主动脉壁的影响尚不明确。以往研究已证实,主动脉夹层的病理特点是动脉硬化、黏多糖聚集、平滑肌细胞增殖和纤维胶原重构,涉及多个信号分子通路相互作用[2]。丝裂原活化蛋白激酶/ 胞外信号调节激酶(mitogen-activated protein kinase/extracellular ignal-regulatedkinas,MAPK/ERK)信号通路近年来在恶性肿瘤领域研究广泛,被证实与细胞增殖、分化、凋亡、转移息息相关[3]。本研究探讨苯磺酸氨氯地平通过调控MAPK/ERK 信号通路对主动脉夹层大鼠主动脉壁的修复作用,现将结果报道如下。
1 材料和方法
1.1 实验动物 选择8~10 周龄无特定病原体级SD 大鼠50 只,体重220~240(231.4±8.6)g,购于北京维通利华实验动物技术有限公司[动物许可证号:SCXK(京)2012-0001]。饲养于湿度50%~60%,温度24~28 ℃的环境中,自由饮水,专室分笼饲养,隔日更换垫料,自由摄食。本研究经动物伦理委员会批准(批准文号:HSYJ2019001)。
1.2 主要器材、试剂 组化笔(批号:GT1001)购于美国Gene tech 公司;二氧化碳恒温培养箱(MCO-15AC 型) 购于日本SANYO 公司;洁净工作台(SW-CJ-1FD 型)购于苏州苏净安泰公司;显微镜(Ti-SR 型)购于日本尼康公司;涡旋混合器(TYXH-Ⅱ型)购于东莞天悦电子;移液枪购于北京Dragon公司;无水乙醇(批号:20191211 购于天津奥淇洛谱商贸有限公司,规格:500 mL/瓶);双氧水[豫卫消证字2019 第0027 号] 购于洛阳紫光健康科技开发有限公司,规格:100 mL/瓶);磷酸盐缓冲液(phosphate buffer saline,PBS)(批号:20180712,规格:500 mL/瓶)购于美国Hyclone 公司;基质金属蛋白酶(matrix metalloprotein,MMP)-2、MMP-6、金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinases,TIMP)1、TIMP2 购于上海晶抗生物;羟乙基乙二胺(amino ethyl ethanol amine,AEEA)购于南京邦诺生物科技有限公司;苯磺酸氨氯地平片(国药准字:H20083828,5 mg/片)购于山东凤凰制药股份有限公司。
1.3 动物分组与造模 采用随机数字表法将50 只大鼠分为模型组、低剂量组、中剂量组、高剂量组和对照组。除对照组外的4 组均行主动脉夹层造模,采用AEEA 150 mg·kg-1·d-1灌胃,每日9∶00~12∶00进行,连续14 d[4]。主动脉组织学切片内膜显著增厚,中膜变薄并可见断裂为造模成功。低剂量组、中剂量组、高剂量组在造模成功后分别给予0.04、0.08、0.16 mg·kg-1·d-1苯磺酸氨氯地平溶液灌胃,每日14∶00~15∶00 进行,连续30 d。对照组SD 大鼠于每日相同时间给予5 mL 的0.9%氯化钠溶液灌胃处理。
1.4 胸主动脉标本留取与镜下观察 按每100 g 大鼠体重给予0.3 mL 的水合氯醛腹腔注射,将5 组大鼠麻醉,常规消毒皮肤后沿胸骨正中线剪开大鼠胸腔,显露胸腔内器官,沿心脏上方主动脉根部进行游离,显露主动脉、主动脉降部和弓部至双侧髂动脉分叉处,取出心脏及胸腹主动脉,放置于等渗盐水中,于显微镜下分离结缔组织,保证留取的主动脉血管完整。观察5 组大鼠胸主动脉HE 染色结果。
1.5 相关蛋白检测 5 组大鼠应用十二烷基磺酸钠-聚丙烯酰胺凝胶提取总蛋白,采用Western blot 法实施电泳,每泳道40 μg,半干法转膜,以5.0%脱脂牛奶封闭,加入一抗孵育2 h,洗涤3 次,加入二抗孵育2 h,洗涤3 次显影,以β-actin 为内参统计MAPK/ERK 信号通路相关蛋白包括:大鼠肉瘤(rat sarcoma,Ras)、快速加速纤维肉瘤(rapidly accelerated fibrosarcoma,Raf)、MAPK、ERK1/2、MMP-2、MMP-6、TIMP1、TIMP2 表达水平,比较各组上述蛋白水平。
1.6 统计学处理 采用SPSS 22.0 统计软件。计量资料以表示,多组间比较以单因素方差分析,组间两两比较采用LSD-t 检验;计数资料组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 5 组大鼠胸主动脉HE 染色结果 对照组胸主动脉内膜、中膜、外层结构正常;模型组血管壁撕裂,出现双桶状的主动脉;低剂量组、中剂量组、高剂量组可见不同程度血管壁撕裂,但主动脉血管壁撕裂程度依次降低。见图1。
2.2 5 组大鼠Ras、Raf、MAPK、ERK1/2 蛋白表达水平比较 5 组大鼠Ras、Raf、MAPK、ERK1/2 蛋白表达水平比较,差异均有统计学意义(均P<0.01)。低剂量组、中剂量组、高剂量组、模型组上述指标水平均高于对照组,低剂量组、中剂量组、模型组上述指标水平均高于高剂量组,差异均有统计学意义(均P<0.05),见表1。5 组大鼠Ras、Raf、MAPK、ERK1/2蛋白电泳图见图2。
2.3 5 组大鼠MMP-2、MMP-6、TIMP1、TIMP2 蛋白表达水平比较 5 组大鼠MMP-2、MMP-6、TIMP1、TIMP2 蛋白表达水平比较,差异均有统计学意义(均P<0.01)。低剂量组、中剂量组、高剂量组、模型组MMP-2、MMP-6 蛋白表达水平均高于对照组,TIMP1、TIMP2 蛋白表达水平均低于对照组,模型组、低剂量组、中剂量组MMP-2、MMP-6 蛋白水平均高于高剂量组,TIMP1、TIMP2 蛋白水平均低于高剂量组,差异均有统计学意义(均P<0.05),见表2。5组大鼠MMP-2、MMP-6、TIMP1、TIMP2 蛋白电泳图见图3。
3 讨论
主动脉夹层是指主动脉内膜破裂形成破口,血液进入薄弱主动脉中膜,正常动脉壁分离诱发的血流动力学障碍类疾病,发病率约为1/10 万~1/20 万[5]。虽然主动脉夹层较为少见,但危险度较高,致残致死风险较大,因此认清主动脉夹层的发病机制,对防治主动脉夹层意义重大。成功建立主动脉夹层模型是进行主动脉夹层实验研究的基础。早期主动脉夹层模型采用犬等动物,但因动物体型较大、费用较高、操作难度大等原因应用受限,现常选取小型动物进行试验。血管紧张素Ⅱ诱导法造模已被证实成功有效,但涉及微量泵埋植,操作难度及费用增加[6]。本研究采用AEEA 灌胃处理造模,成功率较高,致死率较低,模型症状也较明显。
本研究5 组大鼠行HE 染色发现,对照组见胸主动脉内膜、中膜、外层结构正常;而模型组可见血管壁撕裂,出现双桶状的主动脉;低剂量组、中剂量组、高剂量组见不同程度血管壁撕裂,但依次降低,说明经不同剂量苯磺酸氨氯地平处理后血管壁异常得到改善,提示苯磺酸氨氯地平可修复主动脉夹层大鼠主动脉壁,且在一定浓度范围内剂量越高,修复效果越佳。苯磺酸氨氯地平是第三代钙离子阻滞剂的代表药物,可通过氨基侧链与带负电细胞膜结合,发挥长效钙离子阻滞效应,从而产生24 h 内平稳控制血压效果。
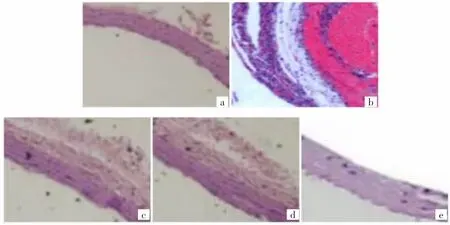
图1 5 组大鼠大鼠胸主动脉镜下观察所见(a:对照组;b:模型组;c:低剂量组;d:中剂量组;E:高剂量组,HE 染色,×400)
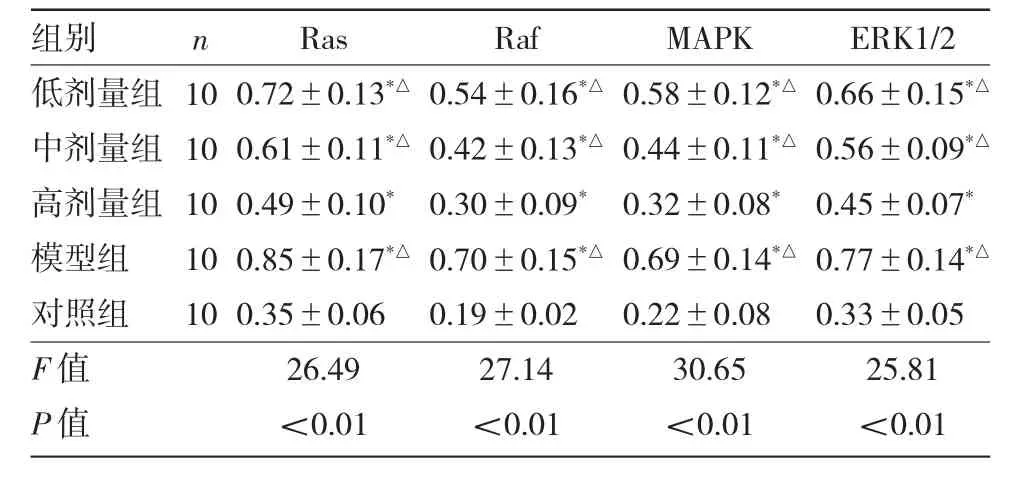
表1 5 组大鼠Ras、Raf、MAPK、ERK1/2 蛋白表达水平比较
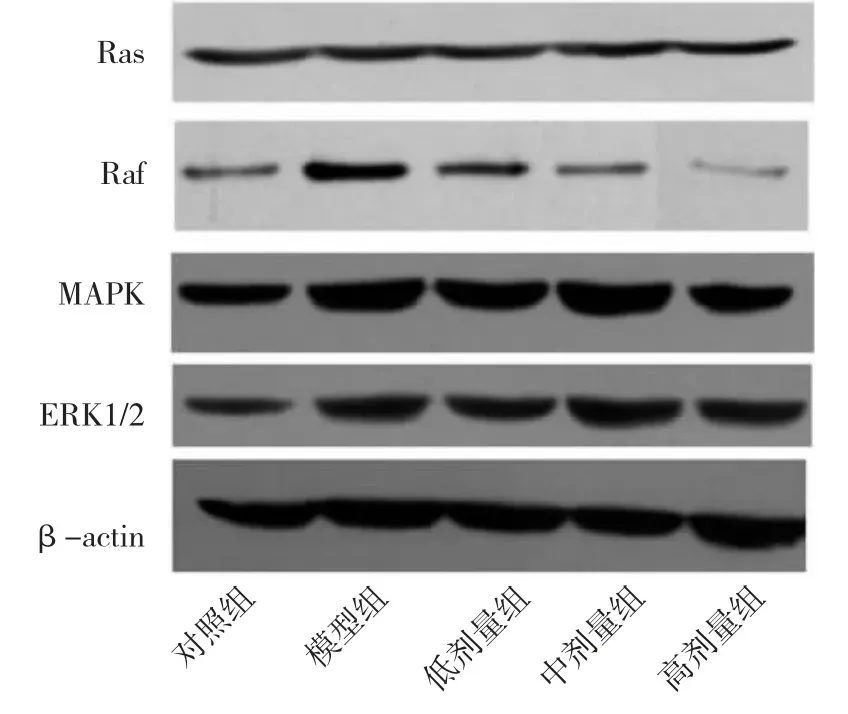
图2 5 组大鼠Ras、Raf、MAPK、ERK1/2 蛋白表达的电泳图
血管平滑肌细胞是主动脉中膜主要构成成分[7]。近年来研究发现,血管平滑肌细胞的增殖与迁移、细胞外基质稳态失衡与主动脉夹层形成有关,而MAPK/ERK 信号通路可调控血管平滑肌细胞生物学行为、细胞外基质稳态[8]。Ras、Raf、MAPK、ERK1/2、MMP-2、MMP-6、TIMP1、TIMP2 为MAPK/ERK 信号通路上下游重要分子,其中Ras 是受体酪氨酸激酶介导信号通路一种关键分子,连接上下游信号转导分子,具有开关作用[9-10];Raf 是Ras 下游分子,可激活Ras-Raf-MEK-ERK 通路[11]。在晚期糖基化终末产物试验中发现,ERK1/2 参与人主动脉血管平滑肌细胞的增殖[12]。
本研究结果显示,模型组Ras、Raf、MAPK、ERK1/2、MMP-2、MMP-6 蛋白水平均高于对照组,TIMP1、TIMP2 蛋白水平低于对照组,提示MAPK/ERK信号通路参与了主动脉夹层发病,可能与动脉壁异常病理变化有关。且低剂量组、中剂量组、高剂量组Ras、Raf、MAPK、ERK1/2、MMP-2、MMP-6 蛋白水平依次降低,TIMP1、TIMP2 蛋白水平依次升高,提示苯磺酸氨氯地平可调控MAPK/ERK 信号通路表达,且其调控作用具有剂量依赖性,这可能是其发挥动脉壁修复效果的作用机制之一,亦提示MAPK/ERK信号通路可能为主动脉夹层的治疗提供一个新靶点,而TIMP1、TIMP2 激活剂可能为主动脉夹层的治疗提供一个新思路。
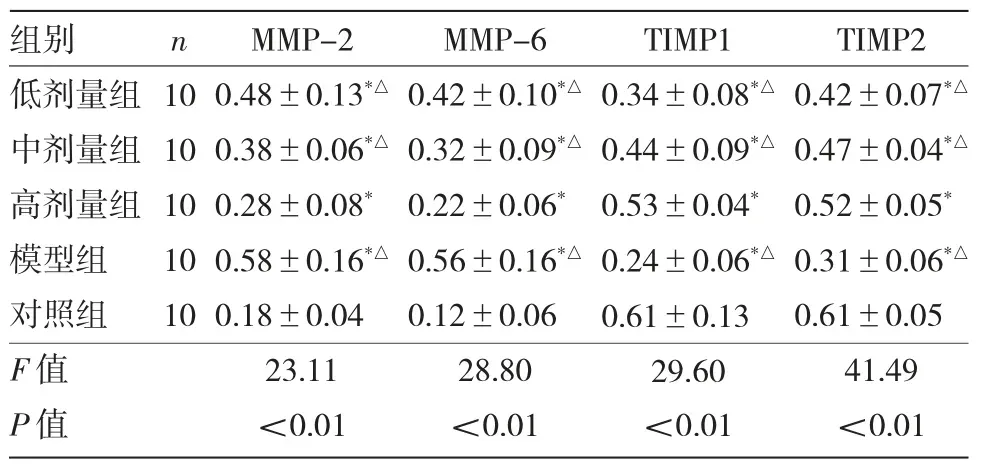
表2 5 组大鼠MMP-2、MMP-6、TIMP1、TIMP2 蛋白表达水平比较

图3 5 组大鼠MMP-2、MMP-6、TIMP1、TIMP2 蛋白表达的电泳图
细胞外基质可为血管壁细胞正确行使功能及血管壁完整性提供结构框架,研究发现其不仅保证了血管壁弹性,亦可通过与血管壁细胞相互作用,为细胞传递调控信号如分化、增殖、迁移等,从而调控血管平滑肌细胞形态、血管壁对生长因子反映能力[13-14]。MMP 是分解细胞外基质蛋白酶的总称,其中MMP-2、MMP-6 为MMP 家族成员,主要作用除降解细胞外基质外,还可作用于非基质蛋白质,参与信号传导[15]。而TIMP1、TIMP2 为MMP 抑制因子,与MMP 具有相反生理功能[16-17]。动物学实验表明,用球囊对血管内膜剥脱后,MMP-2、MMP-6 表达水平可升高,呈现出一致性变化规律,本研究观点存在与其相似之处[18]。球囊导管损伤血管内皮家兔试验证实,MMP-2、MMP-6 的表达时程与血管平滑肌迁移相一致,佐证了MMP-2、MMP-6 均参与血管损伤后的重建过程,提示应用TIMP1、TIMP2 激活剂调控MMP-2、MMP-6 可能有利于防治主动脉夹层[19]。值得注意的是,低剂量组、中剂量组、高剂量组MAPK/ERK 信号通路相关指标虽得到明显改善,但与对照组相比,各观察指标差异仍具有统计学意义,说明单一依赖苯磺酸氨氯地平对动脉壁修复作用有限,可能需联合其他干预方案,详细配伍干预方法有待后续深入探讨。
综上所述,MAPK/ERK 信号通路参与AEEA 诱导主动脉夹层的形成过程,苯磺酸氨氯地平可通过调控MAPK/ERK 信号通路发挥主动脉壁修复作用,且其作用在一定范围内具有剂量依赖性,可能为主动脉夹层的治疗提供一个新思路。