C/EBPβ 对心房肌细胞KCNQ1基因表达的调控作用研究
2022-08-02胡莎莎应永军卢瑛
胡莎莎 应永军 卢瑛
心房颤动(下称房颤)是最常见的心律失常,全球患者约有3 350 多万,并且随着人口老龄化,房颤的发病率逐年增高[1]。目前房颤的治疗主要包括抗凝、控制心室率以及复律三个方面,但由于房颤的发病机制尚未完全阐明,不管是药物复律还是导管消融,房颤的复发率仍然较高[2]。目前研究发现,多种离子通道异常可导致房颤的发生增加。KCNQ1 是国内鉴定的第1 个与房颤有关的离子通道编码基因,其功能的增强型突变(S-140G)可诱导Iks电流增强,导致家族性房颤的发生[3]。目前,KCNQ1 功能增强型突变被认为与房颤密切相关,但有关KCNQ1 的转录调控模式报道较少。本研究通过筛选KCNQ1 的转录因子,探讨其与房颤的关系,为房颤治疗提供新靶点,现报道如下。
1 材料和方法
1.1 主要材料 转录因子筛选板购自美国Signosis公司(批号:FA-1001),染色质免疫沉淀试剂盒购自美国CST 公司(批号:56383),RPMI 1640、B27、碱性成纤维细胞生长因子(basic fibroblast grouth factor,bFGF)购自美国Thermofisher 公司(批号:31870082、17504044、PHG0360),activin A、Noggin、维甲酸(retinoic acid,RA)购自美国Sigma 公司(批号:GF300、GF173、R2625),Dickkopf 相关蛋白1(dickkopf-related protein 1,DKK1)购自美国R&D 公司(批号:5439-DK),KCNQ1、CCAAT/ 增 强 子 结 合 蛋 白β(CCAAT/enhancer binding protein beta,C/EBPβ)抗体、骨成型蛋白4(bone morphogenetic protein 4,BMP4)购自美国Abcam 公司(批号:ab84819、ab32358、ab87063)。
1.2 方法
1.2.1 生物信息学分析 从Ensembl 数据库(www.ensembl.org)下载人KCNQ1 启动子序列,启动子序列定义为KCNQ1 基因第1 个外显子前面的2 000bp 序列。将此序列输入Promo3 数据库(http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3)进行检索。
1.2.2 转录因子筛选板筛选 转录因子筛选采用转录因子筛选板(美国Signosis 公司)进行。具体操作如下:合成上述KCNQ1 启动子片段。提取心房肌细胞核蛋白,将核蛋白、转录因子探针及启动子片段混合孵育,孵育结束后,分离游离探针与转录因子+启动子复合物,随后将结合于转录因子上的结合探针洗脱,采用微孔板杂交,在化学发光仪上检测结合于转录因子上的探针,结果以相对光单位表示。由于启动子片段可与转录因子探针竞争性结合转录因子,若某转录因子可与KCNQ1 启动子结合,则该转录因子与相应的探针结合就减弱,相对光单位减少,心肌细胞提取物相对光单位/(心肌细胞提取物+KCNQ1 启动子片段组相对光单位)升高。
1.2.3 细胞培养 采用Zhang 等[4]报道的方法,将人胚胎干细胞诱导分化成心房肌细胞。具体操作如下:首先使用RPMI 1640 和B27 对人胚胎干细胞H7 进行培养,第1 天加入BMP4 25 ng/mL 和bFGF 6 ng/mL,第2 天加入activin A 100 ng/mL,第4、5 天加入Noggin 250 ng/mL,第6~8 天加入RA 1 μm,第6~11天加入DKK1 200 ng/mL。在第14 天,使用免疫荧光检测分化效率。
1.2.4 心房肌细胞体外快速起搏 采用美国Ion Optix 公司系统进行心房肌细胞快速起搏(快速起搏组),将待处理心房肌细胞接种于6 孔细胞培养板,插入刺激电极进行快速电刺激,刺激参数:电压18 V,频率5 Hz,脉宽4 ms,刺激时间6 h;对照组则不进行起搏。
1.2.5 慢病毒包装及细胞感染 将C/EBPβ 编码基因构建至PLVX-IRES-ZSGREEN1 载体,得到用于过表达C/EBPβ的慢病毒穿梭载体。在网站http://crispr-era.stanford.edu/ 设计靶向C/EBPβ 启动子区sgRNA 序列,得到评分最高的序列为:GAAAACGCGCTCCGGGTGCC。将上述序列构建至载体PLV hUbC-Cas9-KRAB T2A GFP 中,得到C/EBP 抑制表达的慢病毒穿梭载体。使用上述两种穿梭载体,结合慢病毒包装载体pspax2 和pmd2.g,共同转染HEK293T 细胞,得到慢病毒,使用纯化试剂盒对慢病毒进行纯化,并测定慢病毒滴度。使用得到的慢病毒,用感染复数10 感染心房肌细胞,荧光显微镜下观察感染效率,分别选取C/EBPβ抑制表达、慢病毒感染效率50%以上的心房肌细胞和过表达C/EBPβ、慢病毒感染效率50%以上的心房肌细胞作为C/EBP β抑制组、过表达组。另选用一组心房肌细胞不插入任何慢病毒穿梭载体作为对照组。
1.2.6 KCNQ1 mRNA 表达检测 采用染色质免疫沉淀法(chromatin immunoprecipition,Chip)[5],试剂盒购自美国CST 公司(批号:56383)。使用多聚甲醛对心房肌细胞进行固定,核酸酶对染色质进行消化。再使用蛋白A/G 琼脂糖珠对样本进行洗涤,加入C/EBPβ 抗体或IgG 抗体进行孵育。孵育完成后,加入5 M 氯化钠和蛋白酶K 并加热对样本进行解交联,沉淀下来的DNA 进行过柱纯化。纯化产物进行PCR 扩增后电泳。引物序列如下,上游引物:TTTGCTAATGGTGCTTCT;下游引物:GGCTCAAGTGTAAAGGGT。
1.2.7 KCNQ1 启动子结合表达 采用荧光定量PCR 检测。抽提细胞总RNA,随后进行逆转录,逆转录完成后进行荧光定量PCR,通过Ct 值计算快速起搏组和对照组的相对表达量。所用的引物序列如下,上游引物:GCGTCTCCATCTACAGCACG;下游引物:GAAGTGGTAAACGAAGCATTTCC。
1.2.8 KCNQ1、C/EBPβ 表达检测 采用蛋白质印迹法。抽提细胞蛋白,然后进行电泳和转膜,一抗孵育过夜,使用HRP 标记二抗进行孵育,最后采用ECL 显影。一抗浓度为KCNQ1 1∶1 000,C/EBPβ 1∶1 000。
1.2.9 Iks电流测定 在倒置显微镜下,找到慢病毒感染后带荧光的细胞,操纵玻璃电极微操纵器将记录电极接触到细胞,然后给予负压作用,促进细胞形成GΩ 封接。形成GΩ 封接后,进行快速电容补偿,然后持续给予负压作用,吸破细胞膜,形成全细胞记录模式。在全细胞记录模式下,进行慢速电容补偿并记录膜电容及串联电阻的数值。细胞Iks的电压刺激方案如下:保持电压-80 mV,予-40~+60 mV、步阶电压为10 mV、时长4 000 ms 的去极化脉冲,随后复极至-40 mV,记录2 000 ms,回到钳制电位。记录各个电压下的电流,计算电流密度。
1.3 统计学处理 采用SPSS 22.0 统计软件。计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t 检验;计数资料组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 KCNQ1 的转录因子筛选结果 生物信息分析发现KCNQ1 启动子上存在多个C/EBPβ 的结合位点。筛选试验发现,C/EBPβ、过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPAR)和YY1 转录因子可与KCNQ1 启动子片段相结合,其中C/EBPβ 与KCNQ1 启动子片段的结合能力最强。见图1(插页)。
2.2 快速起搏组与对照组中KCNQ1 mRNA、KCNQ1、C/EBPβ、C/EBPβ 与KCNQ1 启动子片段结合表达的比较 快速起搏组和对照组中KCNQ1 mRNA 表达分别为3.11±0.85 和1.02±0.25,差异有统计学意义(P<0.05)。与对照组比较,快速起搏组KCNQ1 和C/EBPβ 蛋白水平均上调,C/EBP 与KCNQ1 启动子片段结合显著增加,差异均有统计学意义(均P<0.05),见图2。
2.3 C/EBPβ 抑制组、过表达组与对照组中KCNQ1 mRNA 表达水平比较 对照组和C/EBPβ 过表达组KCNQ1 mRNA 表达水平分别为1.03±0.31 和2.68±0.55,而对照组与C/EBPβ 抑制组KCNQ1 mRNA 表达水平分别为1.02±0.22 和0.21±0.05,差异均有统计学意义(均P<0.05),见图3。

图2 快速起搏组与对照组中KCNQ1 mRNA、KCNQ1、C/EBPβ 及C/EBPβ 与KCNQ1 启动子片段结合表达的比较(a:快速起搏组与对照组KCNQ1 mRNA 表达比较,*P<0.05;b:对照组与快速起搏组KCNQ1 蛋白印记表达图;c:对照组与快速起搏组C/EBPβ 蛋白印记表达图;d:对照组与快速起搏组C/EBPβ 和KCNQ1 启动子片段结合比较)
2.4 C/EBPβ 抑制组、过表达组与对照组Iks电流水平比较 与对照组比较,C/EBPβ 过表达组Iks膜电位上调,而C/EBPβ 抑制组Iks膜电位下调,差异均有统计学意义(均P<0.05)。在+60 mV 电压下,对照组、C/EBPβ 抑制组和过表达组的电流峰值分别为(7.40±2.20)、(4.91±1.45)和(8.78±2.09)pA/pF,与对照组比较,C/EBPβ 过表达组电流峰值水平升高,而C/EBPβ 抑制组电流峰值水平降低,差异均有统计学意义(均P<0.05),见图4。
3 讨论
房颤是临床常见的心律失常之一,可导致脑卒中、血栓栓塞、心力衰竭、心肌梗死等,降低患者的生活质量[6]。在目前的治疗水平下,房颤的致死率和致残率仍然较高。近年来房颤的遗传学研究已经取得了较大进展,但是有关房颤发生机制方面的研究仍有不足。KCNQ1 是第一个被报道与房颤发生有关的离子通道编码基因,其增强突变可引起家族性房颤的发生。因此,KCNQ1 的转录调控机制可能为房颤的治疗提供一个潜在靶点。
KCNQ1 位于人类染色体11p15.5,长约400 kb,由17 个外显子构成。其编码的KvLQT1 主要在心肌内表达[7]。KCNQ1 基因突变将导致心脏缓慢激活K+通道的功能丧失,诱发房颤。本研究发现,在快速起搏心房肌细胞中KCNQ1 表达明显高于对照组,证实KCNQ1 与房颤密切相关。C/EBPβ 可转录许多炎症因子,导致炎症增强[8]。有研究认为,房颤与心房炎症密切相关[9-13]。本研究发现,KCNQ1 启动子片段上有多个C/EBPβ 结合位点。因此,笔者推测C/EBPβ 可能通过转录调控KCNQ1 导致Iks增强,进一步导致心房肌组织有效不应期的缩短,诱导房颤发生。

图3 C/EBPβ 抑制组、过表达组与对照组中KCNQ1 mRNA 和蛋白表达(a:C/EBPβ 过表达组和对照组中KCNQ1 mRNA 蛋白表达比较及电泳图;与对照组比较,*P<0.05;b:C/EBPβ 抑制组和对照组中KCNQ1 mRNA 蛋白表达比较及电泳图;与对照组比较,*P<0.05)
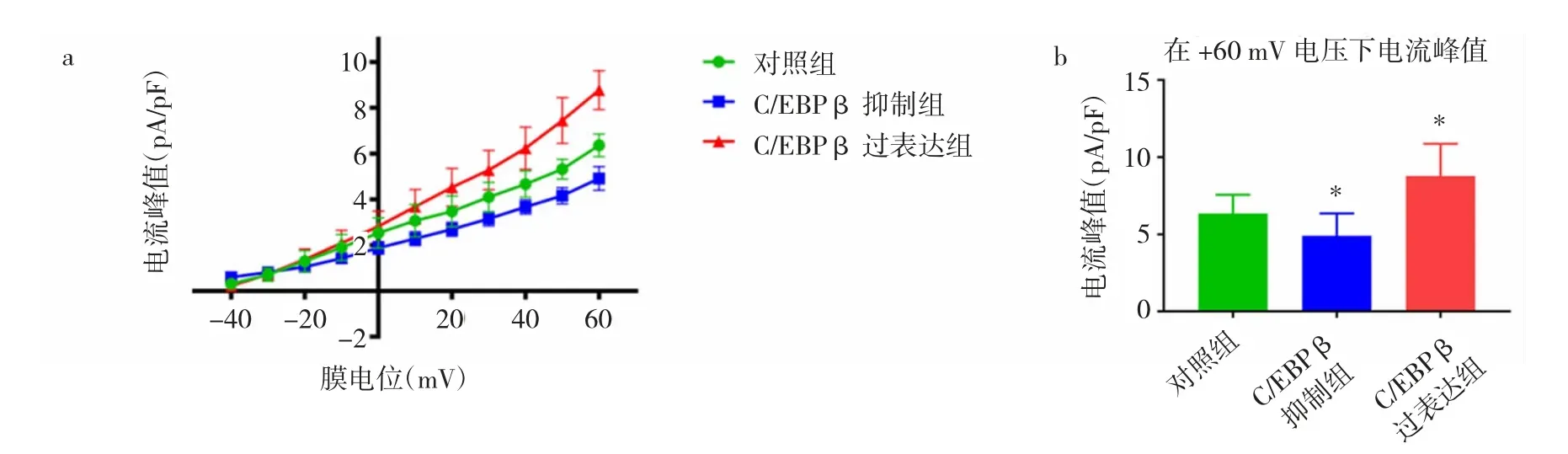
图4 C/EBPβ 抑制组、过表达组与对照组Iks 膜电位、电流峰值的电流密度比较(a:C/EBPβ抑制组、过表达组和对照组Iks 膜电位水平;b:在+60 mV 电压下对照组、C/EBPβ 抑制组和过表达组的电流峰值水平比较,与对照组比较,*P<0.05)
本研究通过染色质免疫沉淀实验发现,快速起搏心房肌细胞中C/EBPβ、KCNQ1 mRNA 和蛋白水平及C/EBP 与KCNQ1 启动子结合显著高于对照组,说明C/EBPβ 和KCNQ1 参与了房颤的发生。实验进一步对C/EBPβ 抑制组、C/EBPβ 过表达组和对照组进行分析,发现C/EBPβ 过表达组KCNQ1 mRNA、蛋白表达水平及Iks电流明显高于对照组,而C/EBPβ 抑制组KCNQ1 mRNA、蛋白表达水平及Iks电流明显低于对照组,说明C/EBPβ 与KCNQ1 启动子结合可增强KCNQ1 表达,促进Iks增大。
综上所述,本研究发现心房肌细胞快速起搏时C/EBPβ 表达升高,C/EBPβ 与KCNQ1 启动子结合增强,诱导KCNQ1 的转录增加,引起Iks增加。因而,C/EBPβ 可作为一个房颤治疗的潜在靶点。但本研究局限于细胞实验,未进行动物实验,其结果是否符合动物或人体的病理生理过程尚需进一步研究。