熊果酸对心肌缺血损伤的保护作用及相关机制研究
2022-08-02孙娜莎陈祺松田港
孙娜莎 陈祺松 田港
心血管疾病是常见的疾病,其发病率及病死率均较高[1]。心肌缺血是缺血性心脏病的主要原因,由于心脏血液灌注减少,导致心脏供氧不足,心肌能量代谢出现异常,从而不能支持正常的心脏功能[2]。持续性心肌缺血是缺血性心脏病患者猝死的主要原因[3]。研究发现,心肌缺血可诱导心肌细胞凋亡,但具体机制尚不明确[4]。Rho 是一种小鸟苷三磷酸结合蛋白,其中RhoA 是目前临床研究最多的家族成员,它通过激活下游Rho 激酶ROCK 参与生理功能的调节,包括细胞黏附、增殖和凋亡等[5-6]。熊果酸是一种天然五环三萜类化合物,具有抗氧化、抗炎、抗病毒、抗肿瘤、降血脂等多种生物活性,但其对心肌缺血损伤的保护作用尚不明确[7]。鼠源H9c2 心肌损伤细胞模型、皮下注射异丙肾上腺素大鼠心肌缺血模型是研究心肌缺血损伤的两种常用体内外模型[8],因此本研究利用这两种模型就熊果酸对心肌缺血损伤的保护作用及相关机制作一探讨,现将结果报道如下。
1 材料和方法
1.1 细胞与动物 鼠源心肌细胞H9c2 购自中国科学院典型培养物保藏委员会细胞库。36 只无特定病原体的成年雄性SD 大鼠[SCXK(浙)2019-0004]购自杭州子源实验动物有限公司,约8 周龄,体重250~300 g,饲养在温度(23±2)℃、湿度(50±5)%、光照/黑暗周期12 h 的环境中,自由饮食、饮水,自适应饲养1 周后进行实验。本实验在浙江中医药大学完成。
1.2 主要试剂 胎牛血清(批号:16140089)、青霉素/链霉素(批号:15140122)、DMEM 培养基(批号:11965092)均购自美国Gibco 公司;异丙肾上腺素(批号:55627)、熊果酸(批号:U6753,纯度>90%)均购自美国Sigma-Aldrich 公司;二甲基亚砜(批号:D103277)购自中国阿拉丁公司;Annexin-V 细胞凋亡检测试剂盒Ⅰ(批号:556547)购自美国BDPharmingen 公司,聚偏二氟乙烯膜(批号:HVLP04700)购自德国Millipore 公司;一抗Bax(批号:ab32503)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(批号:ab181602-100)、Bcl-2(批号:ab62557)、RhoA(批号:ab187027)、ROCK1(批号:ab45171)、辣根过氧化物酶偶联二抗(批号:ab205718)、强化学发光底物试剂盒(批号:ab133406)均购自美国Abcam 公司。2,3,5-氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC;批号:20110106)、苏木素-伊红(hematoxylineosin,HE)染色液(批号:20160630)、肌酸激酶同工酶(creatine kinase-MB,CK-MB)试剂盒(批号:20160512)、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(批号:20160514)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒(批号:20160421)均购自南京建成生物工程研究所;RIPA 裂解液(批号:P0013B)、BCA 蛋白浓度定量试剂盒(批号:P0010)、磷酸蛋白酶抑制剂(批号:P1006)均购自碧云天生物技术研究所;辣根过氧化物酶标记山羊抗兔免疫球蛋白G 二抗(批号:7074)购自美国Cell Signaling 公司。
1.3 体外细胞实验
1.3.1 细胞分组与处理 将H9c2 细胞分为对照组、模型组、熊果酸组;培养于37 ℃、5%CO2的含10%胎牛血清+1%青霉素/ 链霉素的DMEM 培养基中。模型组、熊果酸组采用94%N2+5%CO2+1%O2低氧培养箱培养H9c2 细胞24 h,以构建心肌损伤细胞模型[4]。熊果酸组加入75 μmol/L(通过预实验最终确定给药浓度为75 μmol/L)熊果酸作用24 h;对照组、模型组不作任何处理。
1.3.2 细胞凋亡率检测 采用流式细胞术。将3 组H9c2 细胞按5×103个/孔的密度接种至96 孔板上,生长过夜。使用Annexin-V 细胞凋亡检测试剂盒Ⅰ进行检测,收集细胞并用异硫氰酸荧光素标记的膜联蛋白-V 和碘化丙啶染色,室温下避光孵育15 min 后,利用流式细胞仪检测细胞凋亡情况,计算细胞凋亡率。
1.3.3 细胞Bax、Bcl-2、RhoA、ROCK1 蛋白表达水平检测 采用蛋白质印迹法。取3 组H9c2 细胞,用RIPA 裂解液提取蛋白质,用BCA 试剂盒测定蛋白质浓度。计算相应的样品体积,加入相应缓冲液后,热变性10 min;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转移到聚偏二氟乙烯膜上,封闭2 h;洗涤后加入一抗Bax(1∶500)、GAPDH(1∶1 000)、Bcl-2(1∶500)、RhoA(1∶500)、ROCK1(1∶500),4 ℃孵育过夜;洗膜后,与辣根过氧化物酶偶联二抗(1∶10 000)在室温下孵育2 h。使用高灵敏度强化学发光底物试剂盒进行可视化和成像。以GAPDH 为内参,利用Image 量化信号分析目的蛋白相对表达量。
1.4 动物体内实验
1.4.1 大鼠分组与处理 按随机数字表法将大鼠分为对照组、模型组、熊果酸组,每组12 只。熊果酸组按40 mg/kg 剂量[9]给予熊果酸,对照组、模型组给予相同剂量的5%二甲基亚砜,连续给药7 d。第8~9天,模型组、熊果酸组大鼠皮下注射异丙肾上腺素(85 mg/kg)连续2 d(1 次/d,间隔24 h)[9]。在大鼠心脏功能指标及血清学检测后,处死大鼠并取心肌组织进行组织学观察、心肌缺血面积百分比检测以及心肌组织RhoA、ROCK 蛋白表达水平检测。
1.4.2 大鼠心脏功能指标检测 腹腔注射戊巴比妥钠麻醉大鼠后,将聚乙烯导管通过右颈动脉插入左心室,并连接到MPA 心功能采集和分析系统(上海奥尔科特生物技术有限公司)中的压力传感器,检测大鼠左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末压(left ventricular end-diastolic pressure,LVEDP)、左心室压力最大上升速率(maximum rate of rise of left ventricular pressure,LV+dp/dtmax)、左心室压力最大下降速率(maximum rate of fall of left ventricular pressure,LV-dp/dtmax)。
1.4.3 大鼠血清CK-MB、LDH 和AST 水平检测采用酶联免疫吸附试验法。大鼠尾静脉采血,4 ℃下4 000 r/min 离心10 min,分离血清样品,使用相应的试剂盒检测大鼠血清CK-MB、LDH、AST 水平。
1.4.4 大鼠心肌组织学观察 采用HE 染色。取心肌组织,10%甲醛溶液固定,切片至厚度约4 μm,常规HE 染色。在光学显微镜下观察心肌组织病理学形态变化。
1.4.5 大鼠心肌缺血面积百分比检测 取大鼠心脏,分离心室,将心室分成5 个平行部分并置于2%TT 溶液中;37 ℃孵育15 min。使用Image 图像分析软件计算心肌缺血面积百分比。
1.4.6 大鼠心肌组织RhoA、ROCK1 蛋白表达水平检测 采用蛋白质印迹法,具体步骤同1.3.3。
1.5 统计学处理 采用SPSS 20.0 和GraphPad Prism 8.0 统计软件。计量资料以表示,组间比较采用单因素方差分析,两两比较采用SNK-q 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 体外细胞实验结果
2.1.1 3 组H9c2 细胞凋亡率比较 3 组H9c2 细胞凋亡率比较,差异有统计学意义(P<0.05)。与对照组比较,模型组H9c2 细胞凋亡率明显升高(P<0.05);与模型组比较,熊果酸组H9c2 细胞凋亡率明显降低(P<0.05),见图1。
2.1.2 3 组H9c2 细胞凋亡相关蛋白表达水平比较3 组H9c2 细胞凋亡相关蛋白表达水平比较,差异均有统计学意义(均P<0.05)。与对照组比较,模型组H9c2 细胞Bcl-2 蛋白表达水平无明显变化(P>0.05),Bax 蛋白表达水平明显升高(P<0.05);与模型组比较,熊果酸组H9c2 细胞Bcl-2 蛋白表达水平明显升高(P>0.05),Bax 蛋白表达水平明显降低(P<0.05),见图2。
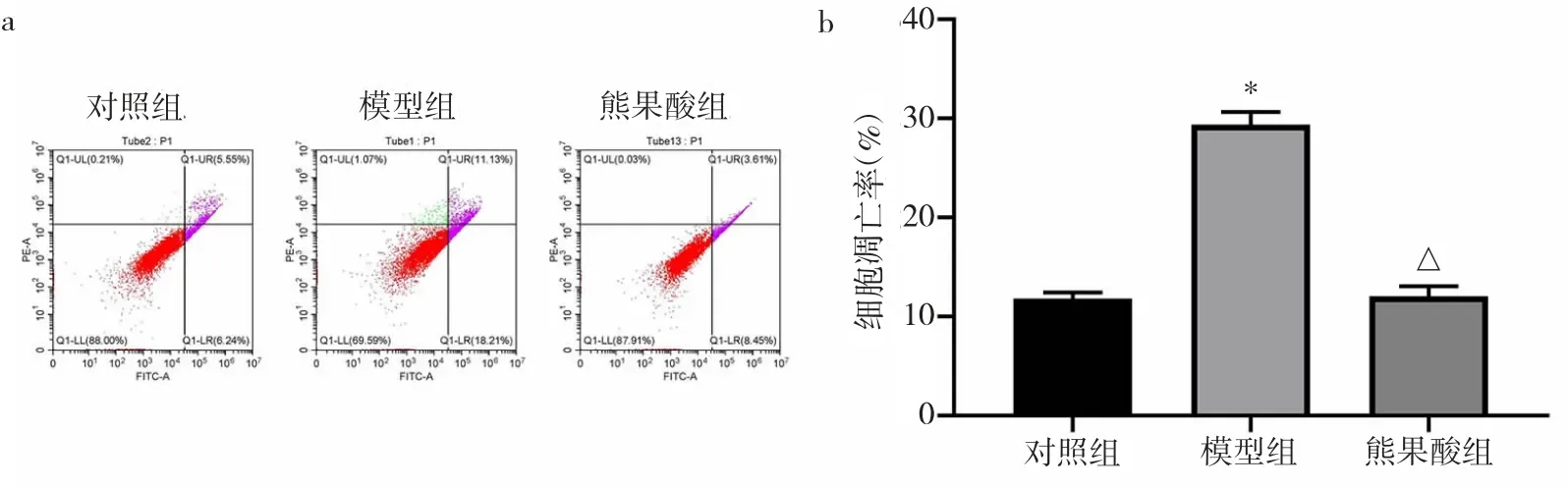
图1 3 组H9c2 细胞凋亡率比较(a:流式细胞图:b:柱状图,与对照组比较,*P<0.05,与模型组比较,△P<0.05)
2.1.3 3 组H9c2 细胞RhoA、ROCK1 蛋白表达水平比较 3 组H9c2 细胞RhoA、ROCK1 蛋白表达水平比较,差异均有统计学意义(均P<0.05)。与对照组比较,模型组H9c2 细胞RhoA、ROCK1 蛋白表达水平均明显升高(均P<0.05);与模型组比较,熊果酸组H9c2 细胞RhoA、ROCK1 蛋白表达水平均明显降低(均P<0.05),见图3。
2.2 动物体内实验结果
2.2.1 3 组大鼠心脏功能指标比较 3 组大鼠心脏功能指标比较,差异均有统计学意义(均P<0.05)。与对照组比较,模型组大鼠LVSP、LV+dp/dtmax、LV-dp/dtmax均明显降低(均P<0.05),而LVEDP 明显升高(P<0.05);与模型组比较,熊果酸组大鼠LVEDP 明显降低(P<0.05),而LV+dp/dtmax、LV-dp/dtmax均明显升高(均P<0.05),见图4。
2.2.2 3 组大鼠血清CK-MB、LDH 和AST 水平比较3 组大鼠血清CK-MB、LDH 和AST 水平比较,差异均有统计学意义(均P<0.05)。与对照组比较,模型组大鼠血清CK-MB、LDH 和AST 水平均明显升高(均P<0.05);与模型组比较,熊果酸组大鼠血清CK-MB、LDH 和AST 水平均明显降低(均P<0.05),见表1。
2.2.3 3 组大鼠心肌组织学及心肌缺血面积百分比比较 HE 染色结果显示,对照组大鼠心肌组织显示出完整的心脏结构,无红细胞或炎性细胞浸润;模型组大鼠心肌组织可见明显间质增大、血管扩张;熊果酸组大鼠心肌细胞排列紧密,且无炎性细胞浸润,见图5a。3 组大鼠心肌缺血面积百分比比较,差异有统计学意义(P<0.05)。与对照组比较,模型组大鼠心肌缺血面积百分比明显增加(P<0.05);与模型组比较,熊果酸组大鼠心肌缺血面积百分比明显减少(P<0.05),见图5b。
2.2.4 3 组大鼠心肌组织RhoA、ROCK1 蛋白表达水平比较 3 组大鼠心肌组织RhoA、ROCK1 蛋白表达水平比较,差异均有统计学意义(均P<0.05)。与对照组比较,模型组大鼠心肌组织RhoA、ROCK1蛋白表达水平均明显升高(均P<0.05);与模型组比较,熊果酸组大鼠心肌组织RhoA、ROCK1 蛋白表达水平均明显降低(均P>0.05),见图6。
3 讨论
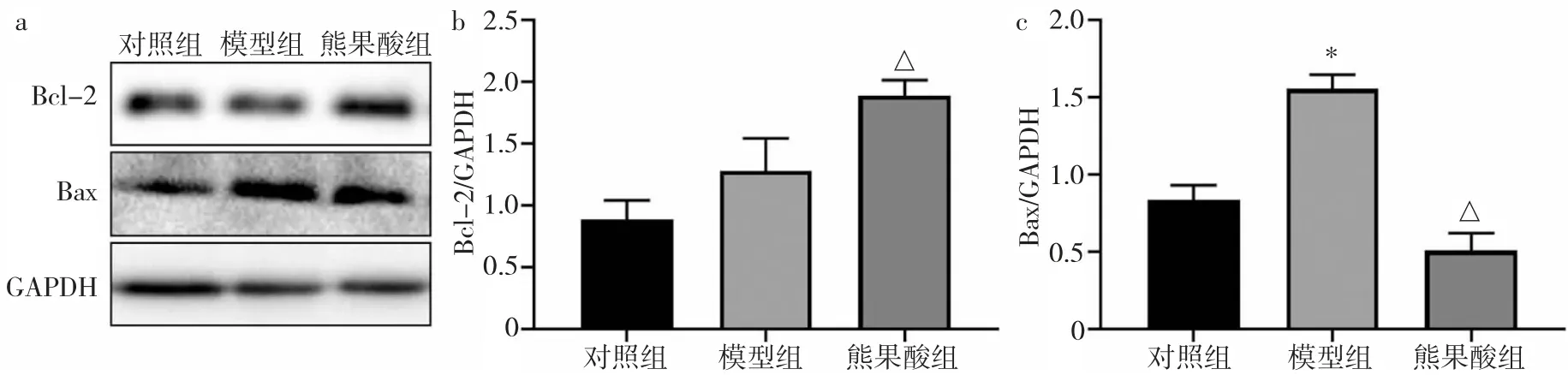
图2 3 组H9c2 细胞凋亡相关蛋白表达水平比较(a:电泳图;b:Bcl-2 蛋白表达水平比较的柱状图,与模型组比较,△P<0.05;c:Bax 蛋白表达水平比较的柱状图,与对照组比较,*P<0.05,与模型组比较,△P<0.05)
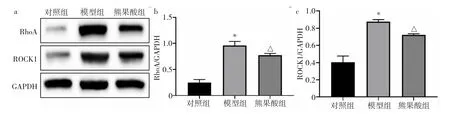
图3 3 组H9c2 细胞RhoA、ROCK1 蛋白表达水平比较(a:电泳图;b:RhoA 蛋白表达水平比较的柱状图,与对照组比较,*P<0.05,与模型组比较,△P<0.05;c:ROCK1 蛋白表达水平比较的柱状图,与对照组比较,*P<0.05,与模型组比较,△P<0.05)

图4 3 组大鼠心脏功能指标比较(a:LVSP;b:LVEDP;c:LV+dp/dtmax;d:LV-dp/dtmax)
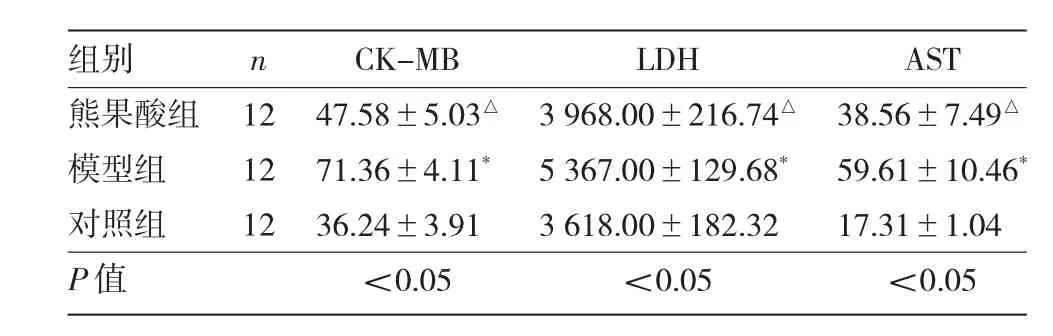
表1 3 组大鼠血清CK-MB、LDH 和AST 水平比较(U/L)
缺血性心脏病是一种以心肌供血减少为特征的疾病,通常由冠状动脉疾病引起[2]。研究表明,熊果酸对大鼠心肌缺血损伤具有保护作用[9]。本研究通过鼠源H9c2 心肌损伤细胞模型证实熊果酸的心肌保护作用,结果显示熊果酸能减少缺氧引起的H9c2 细胞凋亡。
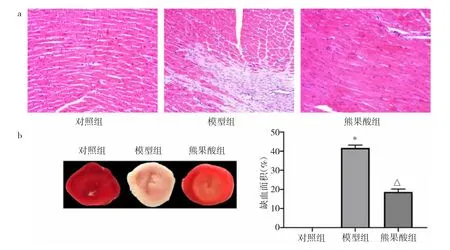
图5 3 组大鼠心肌组织学及心肌缺血面积百分比比较(a:心肌组织学观察,HE 染色,×400。b:熊果酸对缺血诱导的心脏心肌缺血面积的影响及心肌缺血面积比较的柱状图;深色代表健康区域,浅色代表缺血区域,TTC 染色;与对照组比较,*P<0.05,与模型组比较,△P<0.05)
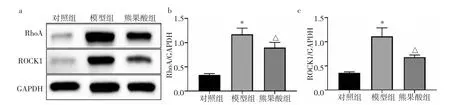
图6 3 组大鼠心肌组织RhoA、ROCK1 蛋白表达水平比较(a:电泳图;b:RhoA 蛋白表达水平比较的柱状图,与对照组比较,*P<0.05,与模型组比较,△P<0.05;c:ROCK1 蛋白表达水平比较的柱状图,与对照组比较,*P<0.05,与模型组比较,△P<0.05)
本研究进一步构建大鼠心肌缺血模型,在大鼠体内证实熊果酸的心肌保护作用可能通过RhoA/ROCK通路来实现。本研究结果显示,异丙肾上腺素诱导的大鼠模型具有典型的心肌缺血特征,如血清AST、CK-MB、LDH 水平升高,心肌缺血面积增加,心脏组织炎性浸润和间质增大等,与相关文献报道一致[2]。当细胞膜受损时,受损的心肌细胞缺乏脱氢酶,而脱氢酶可降低总胆固醇水平,升高CK-MB、LDH 水平[10]。此外,心肌含有丰富的心肌梗死诊断标志物,如CK-MB、AST 等,一旦代谢受损,这些标志物会被释放到细胞外液中[11]。在糖尿病心肌病大鼠中,熊果酸能恢复心脏标志物LDH、CK-MB 水平[12]。本研究结果显示,熊果酸组大鼠血清AST、CK-MB 和LDH 水平降低,心肌缺血面积百分比减小,心肌组织学得到明显改善,表明熊果酸具有心肌保护作用。本研究还测量了LVSP、LVEDP、LV+dp/dtmax、LV-dp/dtmax等心脏功能指标,结果显示熊果酸组大鼠心脏功能指标得到明显改善,与熊果酸能改善糖尿病大鼠心脏收缩及舒张功能的结果一致[11]。心肌缺血通常会诱导心肌细胞凋亡,并参与病理过程。最近研究表明,熊果酸能抑制心肌细胞凋亡,调节各种生理过程[7,9]。
细胞凋亡是心肌缺血的主要机制。Bcl-2 是凋亡途径的一组重要调节因子,可通过抑制线粒体细胞色素C 释放,对凋亡产生抑制作用;而Bax 是诱导凋亡的关键成分,能使细胞色素C 从线粒体中释放,具有促凋亡作用[13]。本研究结果显示,在缺氧条件下,H9c2 细胞Bax、Bcl-2 蛋白表达水平均明显升高。RhoA/ROCK 通路是一种分子开关,该通路调节细胞内的多种生物学功能,包括细胞黏附、增殖、凋亡和基因表达等[14]。越来越多的证据表明,RhoA/ROCK 通路可能参与心血管疾病的发生、发展[6,14-15]。相关文献报道RhoA/ROCK 通路在体内心脏缺血/再灌注损伤中被激活,使用ROCK 抑制剂法舒地尔能抑制JNK 介导的凋亡诱导因子易位,从而减少心肌梗死面积,降低细胞凋亡水平[14]。此外,RhoA/ROCK 的激活通过p53 上调Bax,以诱导线粒体死亡通路和心肌细胞凋亡[15]。Guan 等[16]发现ROCK 活性和Bax、Bcl-2蛋白表达水平在链脲佐菌素诱导的糖尿病大鼠心脏中明显上调,而法舒地尔能保护心脏免受糖尿病引起的心肌细胞凋亡。而本研究在大鼠体内实验中亦发现,大鼠心肌缺血发生后心肌组织RhoA、ROCK 蛋白表达水平均明显升高,而熊果酸处理后均明显降低。
综上所述,熊果酸可能通过抑制RhoA/ROCK途径来抑制心肌细胞凋亡,从而对心肌缺血损伤起保护作用。