不同品种肉桂中酚类物质抗氧化和抑制糖消化酶活性比较研究
2022-08-01刘瑶瑶钟赛意李会鹏王卫飞黎尔纳庞道睿廖森泰邹宇晓
刘瑶瑶, 钟赛意, 李会鹏, 王卫飞, 黎尔纳, 庞道睿,*,廖森泰, 邹宇晓,*
(1.广东海洋大学 食品科技学院, 广东 湛江 524088; 2.广东省农业科学院 蚕业与农产品加工研究所/农业农村部功能食品重点实验室/广东省农产品加工重点实验室/岭南现代农业科学与技术广东省实验室茂名分中心, 广东 广州 510610)
肉桂(CinnamomumcassiaPresl)是一种樟科樟属多年生乔木植物,广泛种植于广东、广西、海南、台湾和云南等纬度低、日照充足的山区或丘陵地区,因具有特殊的香味而被用作食品调味料。肉桂含有酚酸、黄酮、挥发油以及多糖等生物活性成分,具有抗氧化、降血糖、抗炎、抑菌防腐和抗肿瘤等多种健康效应[1]。
糖尿病是一种由于胰岛素分泌缺陷或胰岛素作用障碍所致的以高血糖为特征的慢性代谢紊乱疾病[2]。抑制人体消化酶是治疗糖尿病的手段之一,有效抑制消化酶的活性可减缓餐后血糖水平的提高[3]。天然产物兼具结构和生物活性的多样性,在抑制糖消化酶活性中发挥着重要作用[4],而肉桂的降血糖活性已逐渐引起国内外学者的关注。有研究表明,肉桂酚酸和黄酮类成分可能具有α-葡萄糖苷酶和α-淀粉酶抑制活性,但不同的研究结果之间存在较大差异[5-6],推测原料品种的不同可能是导致差异的原因之一[7-8]。目前关于比较不同品种肉桂对糖消化酶抑制活性的影响并探究其物质基础的研究仍鲜有报道,因此,考察品种对肉桂原料中酚类成分组成及其抗氧化、抑制糖消化酶活性的影响,探明其内在联系和规律具有一定的意义。本实验拟以台湾土肉桂、清化肉桂、云野肉桂和西江肉桂4个生产主栽品种为研究对象,比较不同品种肉桂酚类物质的含量及其抗氧化、抑制糖消化酶活性的差异,探究其活性物质与酶半数抑制浓度的相关性,以抗氧化活性和抑制糖消化酶活性为指标,希望筛选出优质的肉桂品种,并通过UHPLC-MS/MS分析产生糖消化酶抑制活性的化合物,以期为肉桂的精深加工和功能食品开发提供理论依据。
1 材料与方法
1.1 材料与试剂
台湾土肉桂、清化肉桂、云野肉桂和西江肉桂4个品种均由广西林业科学院经济林研究所提供。秋季肉桂采收期收获,新鲜肉桂皮经55 ℃热风干燥48 h后用粉碎机粉碎,过40目筛,得到肉桂干粉,室温密封保存备用。
水溶性维生素E(Trolox)、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)、荧光素钠盐、α-D-葡萄糖苷酶、对硝基苯-α-D-吡喃葡萄糖苷(PNPG)、α-淀粉酶和小鼠肠丙酮粉,美国Sigma公司;没食子酸、儿茶素和阿卡波糖,上海阿拉丁试剂公司。实验所用试剂均为分析纯。
1.2 仪器与设备
SB- 1300型旋转蒸发仪,日本东京理化器械株式会社公司;UV- 2450型紫外可见分光光度计,日本岛津有限公司;TECAN infinite 200型酶标仪,瑞士TECAN公司;QTRAP 6500+型液相色谱串联质谱,美国AB-SCIEX公司。
1.3 实验方法
1.3.1不同品种肉桂游离态多酚粗提物的制备
采用溶剂提取法[9]制备肉桂游离态多酚粗提物。称取不同品种肉桂粉10 g,按料液比1∶30(g∶mL)加入300 mL体积分数为70%的乙醇溶液,70 kHz超声提取0.5 h,在5 000 r/min,4 ℃下离心10 min,收集上清液,残渣重复提取两次,合并上清液。于45 ℃条件下旋转蒸发去除乙醇溶剂,定容至25 mL,贮存于-20 ℃冰箱,备用。
1.3.2不同品种肉桂结合态多酚粗提物的制备
采用氢氧化钠消化法[10]制备肉桂结合态多酚粗提物。室温下向1.3.1得到的肉桂残渣中加入4 mol/L NaOH溶液15 mL,消化并震荡90 min,用盐酸将消化后样品的pH值调节到2.0,并用乙酸乙酯萃取5次。将乙酸乙酯萃取液合并后,45 ℃旋转蒸发至干,用蒸馏水定容至10 mL,置于-20 ℃冰箱,备用。
1.3.3多酚粗提物中酚类物质含量的测定
采用福林酚法[11]测定肉桂多酚含量。取待测样品0.5 mL于干净的试管,加入2 mL去离子水、0.5 mL福林酚试剂,混匀静置6 min,加入5 mL质量分数为7%的Na2CO3溶液中和,加入4 mL去离子水混匀,室温放置90 min,于760 nm处测定其吸光度值。以0.025~0.600 mg/mL没食子酸为标准品在相同条件下测定吸光度,得到标准曲线方程为y=4.458 7x+0.076 1,相关系数R2=0.999 2。肉桂多酚含量以单位质量(g)肉桂干样品中所含没食子酸当量(mg)计,mg/g。
1.3.4多酚粗提物中黄酮类物质含量的测定
采用硼氢化钠- 四氯苯醌法[12]测定肉桂黄酮含量。取待测样品1 mL,用氮气吹干后,加入1 mL体积比为1∶1的四氢呋喃- 乙醇混合溶液复溶。加入0.5 mL 50 mmol/L的NaBH4溶液和0.5 mL 74.6 mmol/L的AlCl3溶液,室温震荡30 min,再加入0.5 mL 50 mmol/L的NaBH4溶液,重复震荡30 min。加入2 mL提前预冷的8 mmol/L的冰乙酸溶液,避光反应15 min,反应结束后,加入1 mL 20 mmol/L的四氯对醌溶液。将各试管放入95 ℃的油浴锅中油浴1 h,再用自来水冷却,用甲醇精确定容至4 mL。向各试管中加入1 mL质量分数为16%的香草醛甲醇溶液和2 mL浓盐酸,混匀,遮光反应15 min。反应结束后,离心,取上清液于490 nm处测定吸光度值。以0.000 3~0.008 0 mol/L儿茶素为标准品在相同条件下测定吸光度,得到标准曲线方程为y=0.000 5x+0.185,相关系数R2=0.999 1。黄酮含量以单位质量(g)肉桂干样品中所含儿茶素当量(mg)计,mg/g。
1.3.5体外抗氧化活性测定
1.3.5.1 ORAC抗氧化活性测定
参照Feng等[13]的方法。待测样品用磷酸盐缓冲液稀释,并加入96孔板中,于37 ℃孵育10 min,加入荧光素钠盐,于37 ℃孵育20 min,最后加入AAPH激发液。采用荧光酶标仪(激发波长485 nm,发射波长535 nm)测定荧光衰减情况。ORAC值以单位质量(g)肉桂干样品中所含Trolox的物质的量(μmol)表示,μmol/g。
1.3.5.2 羟自由基清除能力测定
参考姚宏亮等[14]的方法。分别取0.4 mg/mL待测样品,按试剂盒所标明操作方法进行实验。采用相同浓度的维生素C作阳性对照,按式(1)计算羟自由基(·OH)的清除率。

(1)
式(1)中:Aa为对照组吸光度,Ab为样品组吸光度。
1.3.5.3 超氧阴离子自由基清除能力测定
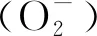

(2)
式(2)中:Aa为对照组吸光度,Ab为样品组吸光度。
1.3.6糖消化酶抑制活性的测定
1.3.6.1 α-葡萄糖苷酶抑制活性的测定
参考Jiang等[16]的方法,并略加修改。取50 μL系列稀释浓度的待测样品于96孔板,加入50 μL 10 U/mL α-葡萄糖苷酶溶液(pH值为6.8,0.1 mol/L PBS配制),于37 ℃恒温孵育10 min。继续加入50 μL 0.5 mmol/L p-NPG,37 ℃恒温孵育20 min,放入冰水浴5 min降低酶活,再加入50 μL 1 mol/L Na2CO3终止反应,于405 nm处测定其吸光度值。以阿卡波糖为阳性对照,按式(3)计算α-葡萄糖苷酶活性抑制率。

(3)
式(3)中:Aa为样品组吸光度,Ab为样品背景组吸光度(等体积缓冲液替代酶液),Ac为对照组吸光度(等体积缓冲液替代样品液),Ad为对照背景组吸光度(等体积缓冲液替代样品和酶液)。
1.3.6.2 α-淀粉酶抑制活性的测定
参考Jiang等[16]的方法,并略加修改。取50 μL系列稀释浓度的待测样品于离心管中,加入50 μL 10 U/mL α-淀粉酶溶液(pH值为7,0.1 mol/L PBS配制),在37 ℃恒温孵育10 min。随后加入50 μL质量分数为0.1%的淀粉溶液,按照1.3.6.1方法孵育20 min,冰水浴5 min,再加入100 μL DNS,沸水浴5 min,冷却后于540 nm处测定其吸光度,以阿卡波糖为阳性对照,按式(3)计算α-淀粉酶活性抑制率。
1.3.6.3 鼠源二糖酶抑制活性的测定
参考Li等[17]的方法。取20 μL系列稀释浓度的待测样品于96孔板中,加入50 μL麦芽糖酶和蔗糖酶(鼠小肠丙酮粉配置),加入56 mmol/L的蔗糖溶液或7 mmol/L的麦芽糖溶液50 μL启动反应,在37 ℃反应30 min。随后加入50 μL 0.05 mol/L的Tris-HCl溶液终止反应。以阿卡波糖为阳性对照,磷酸盐缓冲液(pH值为6.8)代替样品作为空白对照,磷酸盐缓冲液代替酶液作为对照组,采用葡萄糖测定试剂盒测定反应产生的葡萄糖的含量。按式(5)计算二糖酶活性抑制率。

(5)
式(5)中:Aa为对照组吸光值,Ab为样品组吸光值,Ac为空白对照组吸光值。
1.3.7游离态多酚粗提物多酚化合物分析
基于不同品种肉桂游离酚和结合酚粗提物对糖消化酶的抑制活性比较,进一步采用UHPLC-MS/MS[18-21]对不同品种肉桂游离态多酚粗提物酚类化合物进行定性和定量分析。肉桂游离态多酚粗提物经真空冷冻干燥后,研磨(30 Hz,1.5 min)至粉末状。称取不同品种肉桂冻干粉50 mg,按料液比1∶10(mg∶μL)加入500 μL体积分数为50%的甲醇水溶液(含体积分数为0.1%的盐酸),超声5 min,在12 000 r/min,4 ℃下离心3 min,收集上清液,重复提取1次,合并两次上清液,过膜,用于UHPLC-MS/MS分析。
色谱条件:采用Acquity UPLC BEH C18型色谱柱(2.1 mm×100 mm,1.7 μm)。流动相:A为超纯水(含体积分数为0.1%的甲酸),B相为甲醇(含体积分数为0.1%的甲酸);梯度洗脱(0 min,体积分数为5%的B;6 min,体积分数为50%的B;12 min,体积分数为95%的B保持2 min;14 min,体积分数为5%的B平衡2 min);流速0.35 mL/min,柱温40 ℃,进样量2 μL。
质谱条件:采用电喷雾离子源(electrospray lonization,ESI),收集正离子模式数据。离子源温度550 ℃,气帘气(curtain gas,CUR)35psi;正离子模式下喷雾电压5 500 V。在Q-Trap6500+中,每个离子对是根据优化的去簇电压(declustering potential,DP)和碰撞能(collision energy,CE)进行扫描检测。
质谱分析:通过数据库MWDB(metware database)对质谱检测结果进行定性分析;利用三重四级杆质谱的多反应监测模式对鉴定的化合物进行定量分析。
1.4 数据处理
所有实验均重复3次,结果以平均值±标准偏差表示。用SPSS 21.0软件对数据进行分析,得到相应的半数抑制浓度(IC50)值;用Duncan’s多重比较方法进行显著性方差分析。相关性采用Pearson Correlation法分析。
2 结果与分析
2.1 不同品种肉桂中酚类物质含量比较
不同品种肉桂中游离态和结合态酚类化合物含量分析结果见图1。由图1(a)可知,4个不同品种肉桂的游离态多酚和结合态多酚含量变幅介于55.99~66.57 mg/g和3.15~5.04 mg/g,所有品种中游离态多酚含量都明显高于结合态多酚。4个品种肉桂中,台湾土肉桂和清化肉桂的游离态多酚含量显著高于其他两个品种(P<0.05)。4个品种肉桂中,台湾土肉桂的结合态多酚的含量最高[(5.04±0.19)mg/g],并且显著高于其他品种肉桂(P<0.05)。
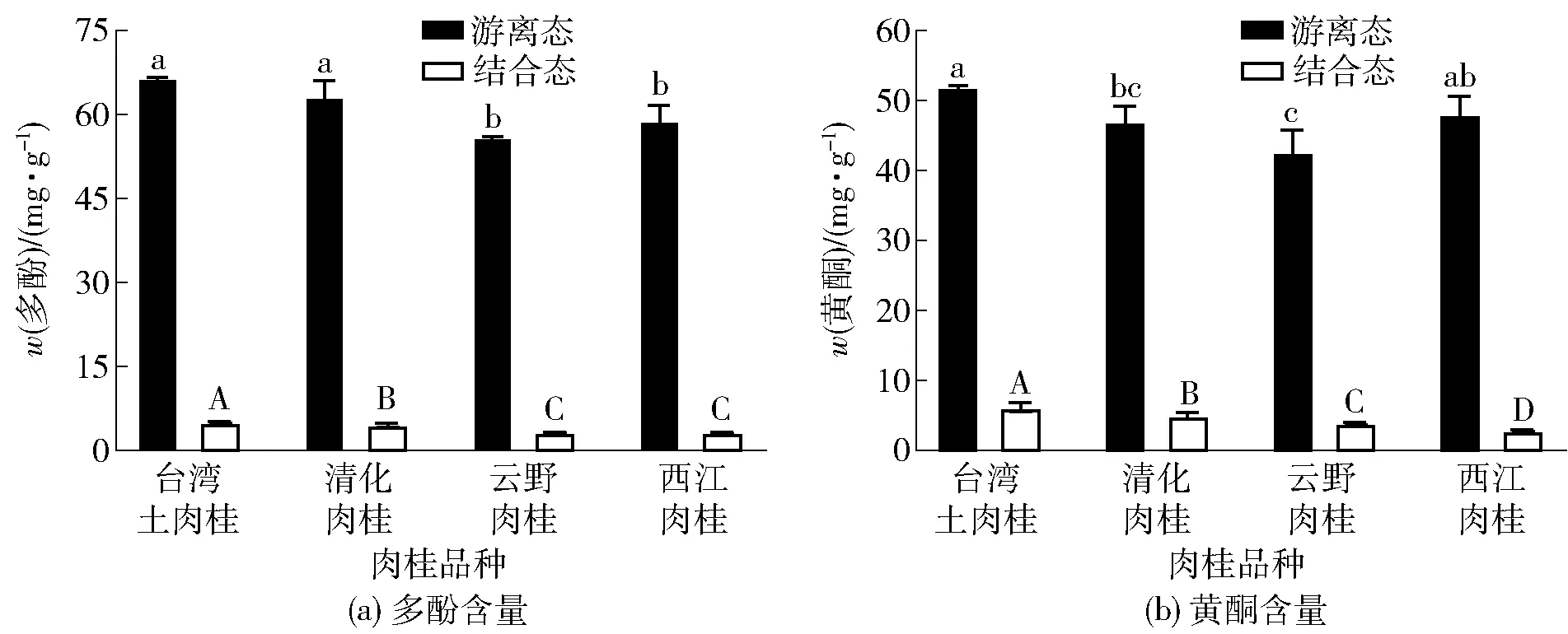
不同字母表示各组数据间差异显著(P<0.05)。
由图1(b)可知,4个不同品种肉桂的游离黄酮和结合黄酮含量介于42.57~51.9 mg/g和2.82~6.15 mg/g,所有品种中游离态黄酮含量明显高于结合态黄酮含量。台湾土肉桂游离态黄酮含量最高,为(51.90±0.57)mg/g,显著高于清化肉桂和云野肉桂(P<0.05)。台湾土肉桂的结合态黄酮的含量最高[(6.15±0.86)mg/g],显著高于其他品种(P<0.05)。
由图1(a)和(b)可知,所有品种中游离态多酚和黄酮含量明显高于结合态多酚和黄酮含量。不同品种肉桂总多酚和总黄酮的含量亦存在显著性差异(P<0.05)。台湾土肉桂的总多酚和总黄酮含量最高,分别为(71.62±0.40)mg/g和(58.05±1.42)mg/g。
本研究结果表明,品种对肉桂中酚类物质含量影响显著。品种差异以及气候、光照强度、土壤类型等因素都会影响植物原料中的生物活性物质组成及含量[22];此外活性物质含量还与提取温度、时间、pH值和溶剂极性等因素有关[23]。研究中所用肉桂的产地、提取方法、生长年限、采收部位基本一致。可以判断,不同品种是造成肉桂酚类物质含量存在差异的主要原因。
2.2 不同品种肉桂体外抗氧化活性比较
不同品种肉桂游离态和结合态粗提物的ORAC抗氧化活性分析结果见图2。由图2(a)可知,不同品种肉桂中游离态多酚粗提物ORAC值都明显高于结合态多酚粗提物。台湾土肉桂游离态和结合态多酚粗提物氧自由基吸收能力最强,并且显著高于其他品种(P<0.05),分别为(923.84±18.95)μmol/g和(36.67±7.44)μmol/g。
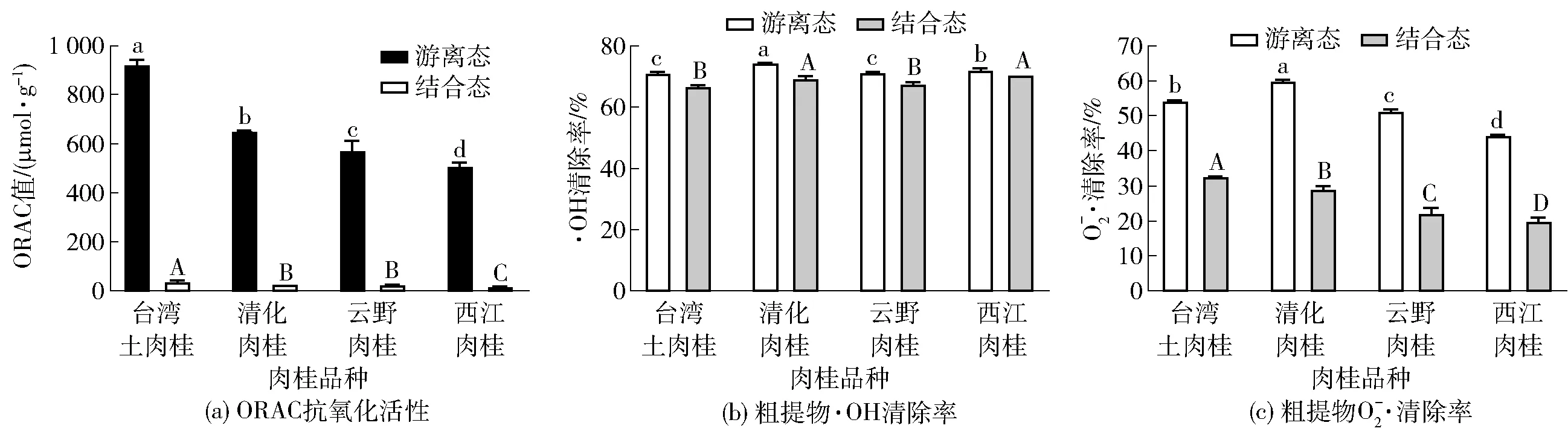
不同字母表示各组数据间差异显著(P<0.05)。
本研究结果表明,不同品种肉桂抗氧化活性存在显著性差异,酚类物质含量的不同可能是造成差异的主要原因。多酚复杂芳环结构可以通过终止链式反应有效地使活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)失活[24]。肉桂粗提物通过清除过氧自由基、羟自由基和超氧阴离子进而发挥抗氧化作用。
2.3 不同品种肉桂游离态和结合态粗提物对糖消化酶抑制活性比较
α-葡萄糖苷酶、α-淀粉酶、二糖酶是与碳水化合物消化吸收有关的几种酶[25]。本研究用半数抑制浓度(IC50)评价肉桂游离态和结合态多酚粗提物对碳水化合物消化过程中抑制肠道消化酶类活性的影响,IC50值越小,表明其对糖消化酶抑制活性越强。
2.3.1对α-葡萄糖苷酶抑制活性比较
不同品种肉桂游离态和结合态多酚粗提物对α-葡萄糖苷酶的抑制作用分析结果见图3。由图3(a)可知,4个品种肉桂游离态多酚粗提物对α-葡萄糖苷酶的抑制效果均显著优于对照组(P<0.05)。台湾土肉桂在4个品种游离态多酚粗提物中活性最强,显著优于其他品种(P<0.05),IC50值为(1.87±0.05)g/L。由图3(b)可知,清化肉桂结合态多酚粗提物对α-葡萄糖苷酶的抑制作用显著高于其他品种(P<0.05),IC50值为(68.51±0.61)g/L。其次分别为台湾土肉桂[(76.88±1.20)g/L]、西江肉桂[(103.58±2.40)g/L]和云野肉桂[(114.92±1.11)g/L],与阳性对照组对比,差异显著(P<0.05)。本研究结果表明,不同品种肉桂中游离态多酚粗提物对α-葡萄糖苷酶的抑制效果都明显优于结合态多酚粗提物。
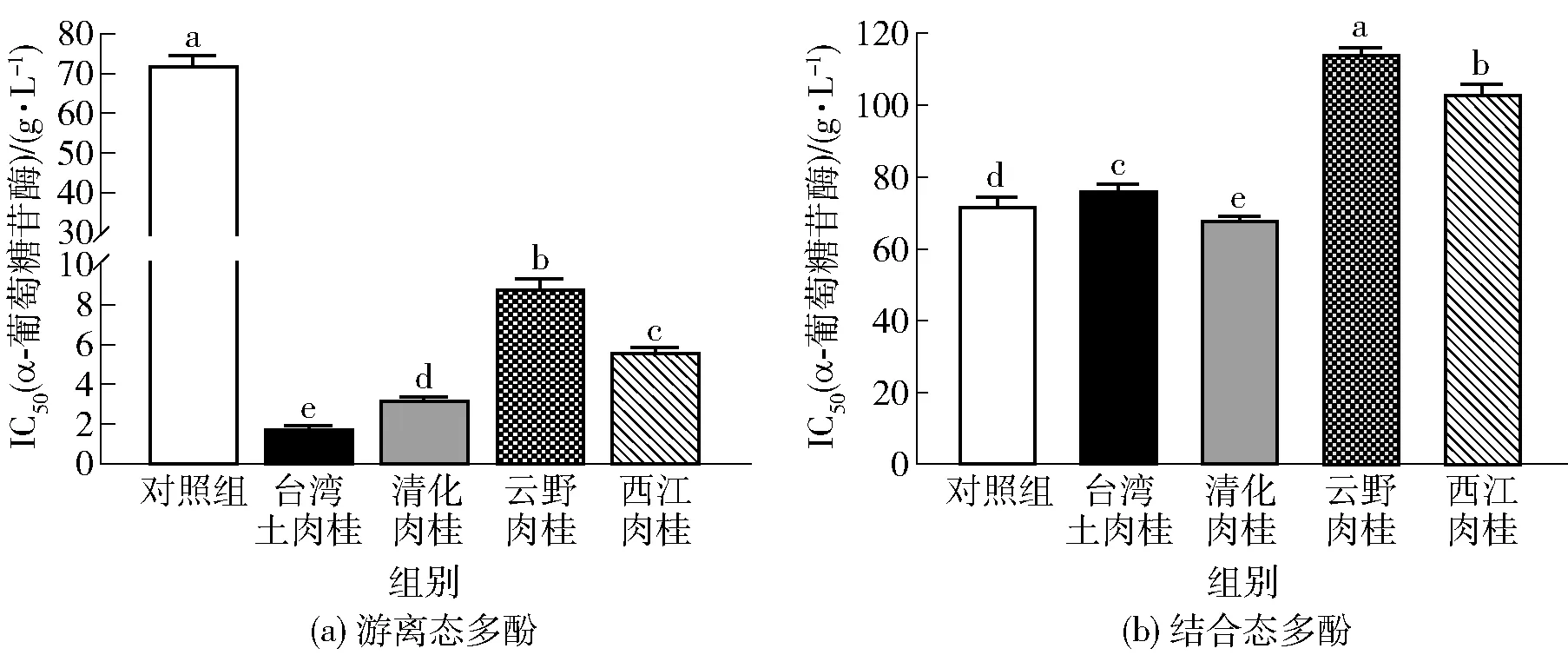
不同字母表示各组数据间差异显著(P<0.05)。
2.3.2对α-淀粉酶抑制活性比较
不同品种肉桂游离态和结合态多酚粗提物对α-淀粉酶的抑制作用分析结果见图4。由图4(a)可知,对照组对α-淀粉酶的抑制效果显著优于4个品种肉桂游离态多酚粗提物(P<0.05)。4个不同品种肉桂游离态多酚粗提物对α-淀粉酶的抑制效果由高到低依次为西江肉桂[(24.82±3.66)g/L]、台湾土肉桂[(38.06±7.01)g/L]、云野肉桂[(62.19±0.49)g/L]、清化肉桂[(86.95±11.13)g/L]。由图4(b)可知,台湾土肉桂和清化肉桂结合态多酚粗提物对α-淀粉酶的抑制作用显著高于其他品种(P<0.05),IC50值分别为(405.31±13.95)g/L和(424.81±2.14)g/L。对照组对α-淀粉酶的抑制作用显著优于台湾土肉桂和清化肉桂结合态多酚粗提物(P<0.05)。本研究结果表明,对照组对α-淀粉酶的抑制效果优于肉桂游离态和结合态多酚粗提物。

不同字母表示各组数据间差异显著(P<0.05)。
2.3.3对二糖酶抑制活性比较
2.3.3.1 对麦芽糖酶抑制活性比较
不同品种肉桂游离态和结合态多酚粗提物对麦芽糖酶的抑制作用见图5。由图5(a)可知,对照组对麦芽糖酶的抑制效果显著优于4个品种肉桂游离态多酚粗提物(P<0.05)。台湾土肉桂和清化肉桂对麦芽糖酶的抑制效果显著优于其他两个品种(P<0.05),IC50值分别为(19.51±0.68)g/L和(21.92±1.34)g/L。如图5(b)可知,云野肉桂结合态多酚粗提物对麦芽糖酶的抑制作用显著高于其他品种(P<0.05),IC50值为(506.72±12.91)g/L。西江肉桂结合态多酚粗提物对麦芽糖酶的抑制作用最低,IC50值为(651.49±8.31)g/L,4个品种肉桂结合态多酚粗提物对麦芽糖酶的抑制活性与对照组相比,差异均显著(P<0.05)。对照组对麦芽糖酶的抑制效果优于肉桂游离态和结合态多酚粗提物。

不同字母表示各组数据间差异显著(P<0.05)。
2.3.3.2 对蔗糖酶抑制活性比较
不同品种肉桂游离态和结合态多酚粗提物对蔗糖酶的抑制作用见图6。由图6(a)可知,台湾土肉桂、清化肉桂、云野肉桂和西江肉桂游离态多酚粗提物对蔗糖酶IC50值分别为(19.51±0.68)、(21.92±1.34)、(29.51±1.41)、(45.65±2.37)g/L。与对照组相比,4个品种肉桂游离态多酚粗提物的抑制效果显著低于对照组(P<0.05)。台湾土肉桂游离态多酚对蔗糖酶的抑制作用显著高于其他品种(P<0.05)。如图6(b)可知,4个不同品种肉桂结合态多酚粗提物对蔗糖酶的抑制效果由高到低依次为台湾土肉桂[(280.31±7.79)g/L]、清化肉桂[(454.42±14.66)g/L]、云野肉桂[(624.43±7.21)g/L]、西江肉桂[(964.94±30.93)g/L],4个品种肉桂结合态多酚粗提物对蔗糖酶的抑制活性与对照组相比,差异均显著(P<0.05)。本研究结果表明,对照组对蔗糖酶的抑制效果优于肉桂游离态和结合态多酚粗提物。
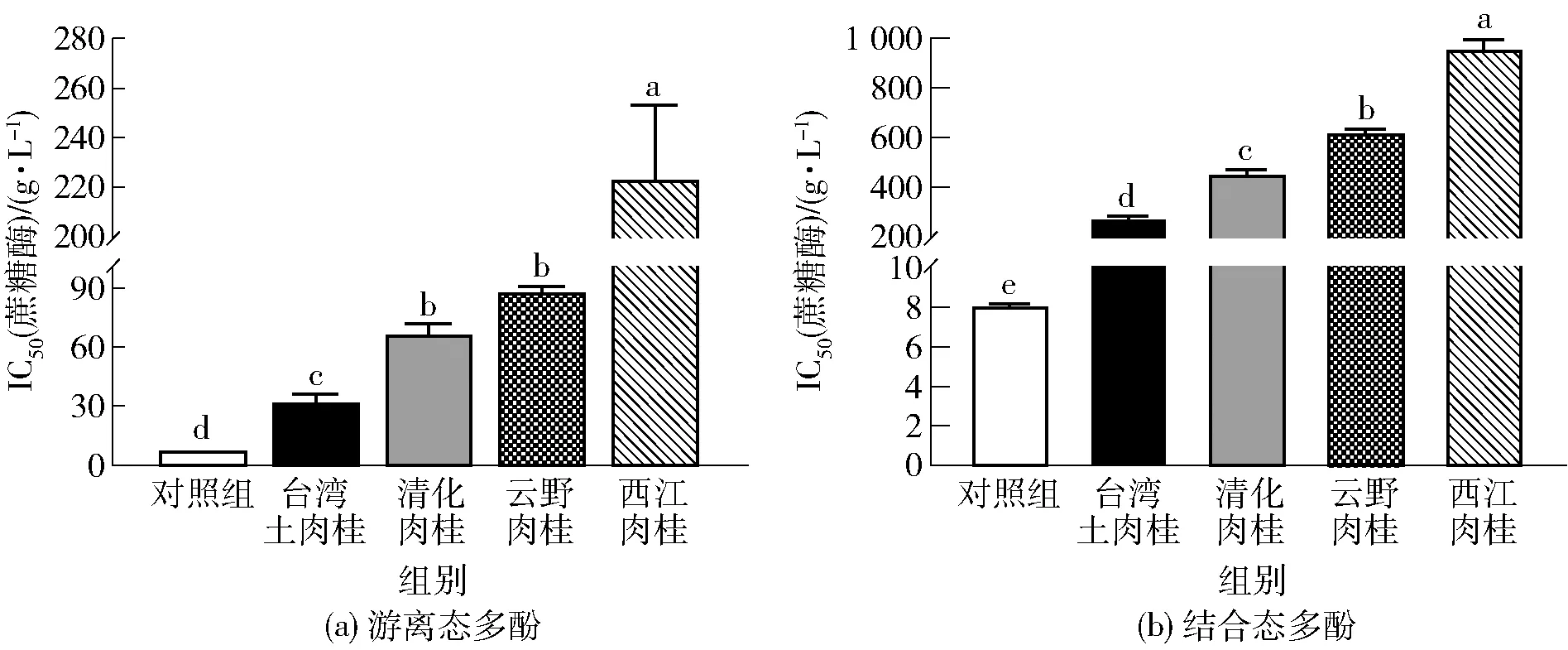
不同字母表示各组数据间差异显著(P<0.05)。
通过研究4种肉桂的游离态和结合态多酚粗提物对多种糖消化酶的抑制活性,发现肉桂游离态和结合态多酚粗提物均具有抑制糖消化酶的活性;且不同品种肉桂中游离态多酚粗提物对糖消化酶的抑制活性都明显高于结合态多酚粗提物。通过比较发现,台湾土肉桂较其他3个品种肉桂表现出更强的糖消化酶抑制活性。
2.4 相关性分析
肉桂酚类物质含量与抑制糖消化酶活性的相关性分析结果见表1。由表1可知,α-葡萄糖苷酶IC50值与游离态多酚、结合态多酚和结合态黄酮含量呈极显著负相关,R2位于-0.709~-0.915(P<0.01),即游离多酚、结合多酚和结合黄酮含量越高,IC50值越低,α-葡萄糖苷酶抑制活性越强;α-葡萄糖苷酶IC50值与游离态黄酮含量呈显著负相关,相关系数为-0.679(P<0.05);此外,蔗糖酶IC50值与结合态多酚和黄酮含量均呈极显著负相关,R2分别为-0.876和-0.948;α-淀粉酶IC50值与结合态多酚含量呈显著负相关(P<0.05),R2为-0.604;麦芽糖酶IC50与游离态多酚、结合态多酚、游离态黄酮和结合态黄酮含量的R2均小于0.4,可认为呈弱相关。该结果表明,肉桂粗提物对麦芽糖酶抑制活性不仅取决于多酚和黄酮含量,也可能与其他活性成分(如多糖或皂苷)有关[26-27]。本研究结果表明,肉桂多酚和黄酮具有较强的α-葡萄糖苷酶、α-淀粉酶和蔗糖酶抑制活性,而对麦芽糖酶无抑制活性。
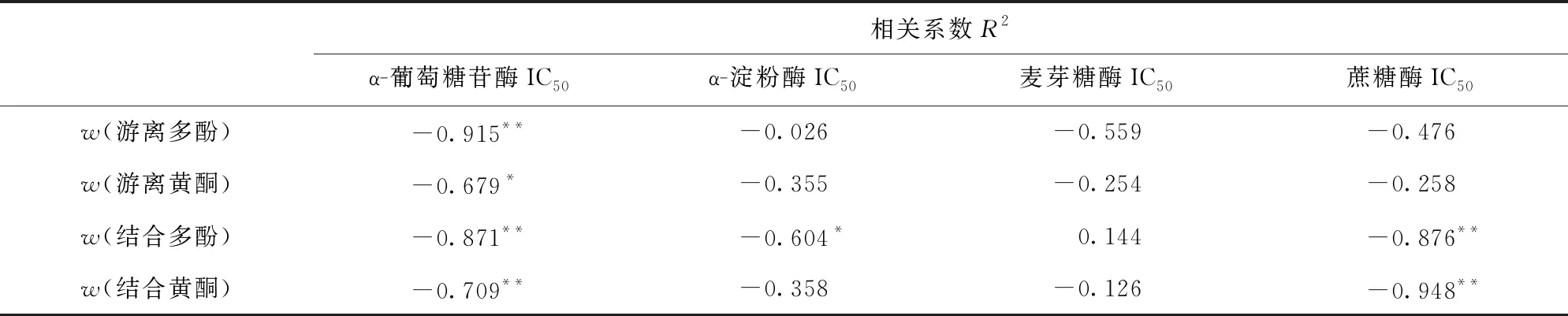
表1 肉桂酚类物质与其抑制糖消化酶活性相关性分析
2.5 多酚粗提物酚类化合物分析
不同品种肉桂游离态多酚粗提物黄酮类化合物分析结果见表2。黄酮类物质可能是植物抑制α-葡萄糖苷酶重要活性物质基础[28]。由于肉桂游离酚粗提物中成分较多,深入分析发现:肉桂粗提取物中黄酮含量与α-葡萄糖苷酶的抑制活性显著相关(R2=-0.679)。因此,黄酮类物质可能是肉桂粗提物中抑制α-葡萄糖苷酶的主要物质基础。分析肉桂中黄酮组成(表2),共鉴定出40种肉桂酚类化合物,原花青素A2、原花青素B1、原花青素B2、原花青素B3、原花青素C1、槲皮素-3-O-葡萄糖苷和芦丁是其主要成分。有研究表明,黄酮的生物活性可能与黄酮骨架A、B和C环上羟基的数量和位置密切相关[29]。原花青素类结构中含有多个酚羟基,其黄酮骨架上A环上的5位羟基和B环上的羟基数目可能是其对α-葡萄糖苷酶产生较强的抑制活性的原因[30-31]。原花青素类物质在4个品种中含量都很高,所以是不同品种肉桂抑制糖消化酶的主要活性物质之一,从而使4个品种肉桂酚类物质提取物均表现出较强的糖消化酶抑制活性。值得注意的是,台湾土肉桂较其他3个品种肉桂表现出更强的糖消化酶抑制活性。分析台湾土肉桂的黄酮类物质组成,不难发现其槲皮素-3-O-葡萄糖苷和芦丁含量均显著高于其他品种(P<0.05),分别为(39.21±2.90)μg/g和(37.98±2.16)μg/g。酶抑制动力学研究结果表明,槲皮素-3-O-葡萄糖苷和芦丁通过混合竞争抑制显示出强的α-葡萄糖苷酶抑制活性[32]。Goncalves等[33]研究了多种酚类单体对α-葡萄糖苷酶和α-淀粉酶的抑制活性,发现芦丁显示出极强的抑制活性(IC50值为1.3 μmol/L);Flores-bocanegra等[34]证明了槲皮素-3-O-葡萄糖苷对α-葡萄糖苷酶和α-淀粉酶也具有较强的抑制活性。荧光淬灭光谱研究结果显示,槲皮素-3-O-葡萄糖苷和芦丁能与α-葡萄糖苷酶通过疏水相互作用和氢键驱动形成强基态复合物,并导致酶的内源荧光猝灭。槲皮素-3-O-葡萄糖苷和芦丁强的α-葡萄糖苷酶抑制活性还与糖苷结构取代C3-OH基团有关。研究表明,糖苷结构取代C3-OH基团,导致了槲皮素-3-O-葡萄糖苷及芦丁空间结构增大,从而可能提高了其黄酮对α-葡萄糖苷酶的抑制活性[32]。因此,槲皮素-3-O-葡萄糖苷和芦丁是台湾土肉桂较其他3个品种肉桂表现出更强的糖消化酶抑制活性的主要原因之一。
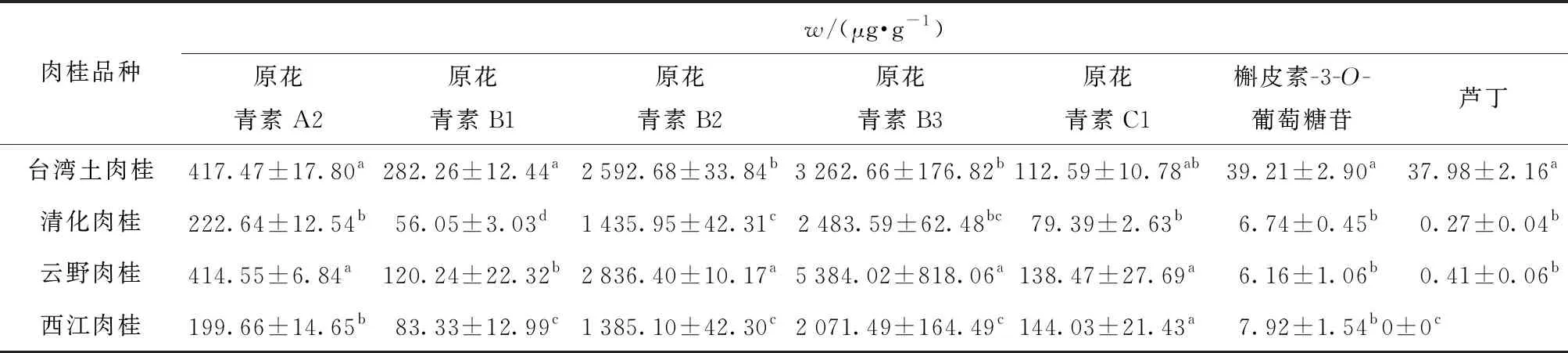
表2 肉桂主要黄酮类成分含量
3 结 论
本研究表明,4个品种肉桂中游离态多酚和黄酮含量明显高于结合态多酚和黄酮含量,且不同品种肉桂中酚类物质含量存在显著差异(P<0.05),肉桂品种的不同可能是导致差异的主要原因之一。不同品种肉桂的抗氧化活性和糖消化酶抑制活性之间存在差异,其中台湾土肉桂的抗氧化活性和糖消化酶抑制活性都明显高于其他品种。相关性分析证明,肉桂多酚(黄酮)具有较强的糖消化酶抑制活性。进一步研究发现,槲皮素-3-O-葡萄糖苷和芦丁可能是台湾土肉桂较其他3个品种肉桂表现出更强的糖消化酶抑制活性的主要原因之一。希望本研究结果可为肉桂品种选育、采收、加工和应用提供理论依据。
