胸腔镜下热灌注化疗治疗恶性胸腔积液的疗效及对肿瘤炎症微环境的影响
2022-08-01徐浩然陈岳威黄文辉
曹 怡 徐浩然 陈岳威 黄文辉
成都中医药大学附属第一医院心胸外科,四川省成都市 610000
胸腔积液是指因各种原因引起的胸膜腔内液体病理性蓄积为特征的一种常见临床疾病,由肺癌胸膜转移导致的胸腔积液容易表现为反复发作的难治性胸腔积液[1]。一直是治疗难点,多数患者需长期反复住院行胸腔穿刺或胸腔闭式引流,中位生存期仅为2.8~6.8个月[2]。对于此类胸腔积液患者,治疗的首要目的是控制胸腔积液,改善患者症状,提高患者生存。传统的胸膜固定术拟通过化学药物或者物理方法造成无菌性炎症,消除胸膜腔从而达到控制积液的目的。这些手术往往是姑息性的,效果并不可靠,复发概率高[3]。胸膜腔热灌注通过高温杀灭肿瘤细胞同时在胸膜间形成胸膜粘连从而达到治疗恶性胸腔积液的效果,是提升肺癌胸膜转移患者生存期和生活质量的有力措施[4-6]。肿瘤炎症微环境对肺癌的发生发展至关重要,其中arg-1、TNF-α、iNOS均是肺癌发生发展的关键因子,这些因子与恶性胸腔积液的相关性未见报道。近年来,我院通过胸腔热灌注化疗技术在治疗肺癌难治性胸腔积液上取得了良好的疗效,本研究通过对恶性胸腔积液中的炎症标志物进行检测,分析其与患者胸腔积液控制程度及热灌注疗效的相关性,探究热灌注对肺癌肿瘤微环境的影响,进而探讨治疗恶性胸腔积液的可能机制。通过对比,证实了胸腔镜下热灌注化疗较常规床旁灌注可以更好地改善患者胸腔炎症微环境。现将结果报道如下。
1 资料和方法
1.1 临床资料 选取2013—2019年于我院心胸外科进行诊治的恶性胸腔积液患者共120例,根据胸腔热灌注化疗的方式分为胸腔镜组与常规治疗组,各60例。所有患者均经过临床病理诊断。胸腔镜组患者年龄47~72岁;其中肺腺癌45例,肺鳞癌13例,小细胞肺癌2例(其中非典型类癌1例);35例接受过胸腔闭式引流或胸腔穿刺术后复发。常规治疗组患者年龄50~75岁;其中肺腺癌48例,肺鳞癌11例,小细胞肺癌1例;37例术前接受过胸腔闭式引流或胸腔穿刺术后复发。两组患者一般资料对比,差异无统计学意义(P<0.05),具有可比性。该项研究获得了成都中医药大学附属医院医学伦理委员会批准。
1.2 纳入及排除标准 纳入标准:经组织病理或细胞学确诊为恶性胸腔积液;经过胸腔穿刺抽液及胸腔闭式引流后积液复发或包裹性积液无法引流;随访生存时间>3个月;术前无绝对手术禁忌证,无肝肾功能及凝血功能障碍;可耐受全身麻醉;Karnofsky评分(KPS)>50分。近1个月内没有接受过全身性放化疗。排除标准:非肿瘤源性的胸腔积液,严重的肝肾功能异常,严重的造血系统疾病。
1.3 研究方法 手术步骤:胸腔镜组患者行全身麻醉后双腔气管插管,监测动脉血压及心电图。于第7肋间腋中线做观察孔,置入胸腔镜观察患者胸腔粘连及肿瘤浸润情况,同时于第4肋间腋前线做长约4cm的操作孔,置入器械,分离胸腔粘连,清除肺表面及胸壁纤维板,清理胸腔内包裹性积液。最后夹取胸壁组织进行术后组织学活检。完成以上步骤后取出腔镜器械,分别于操作孔和观察孔置入28F及30F胸腔引流管两根,两个端口分别用于灌注入口和出口。常规治疗组在B超定位下于患者第4肋间腋前线及第7肋间腋中线置入28F及30F胸腔闭式引流管两根,排尽患者胸腔积液后外接灌注机。治疗温度、药物均与胸腔镜组一致。完成以上步骤后使用BR-TRG-Ⅱ型体腔热灌注机进行胸腔热灌注。热灌注机由控制系统、热交换器以及专用配套一次性管道构成,通过构建两个水循环,水箱循环和灌注内循环,水箱加热,通过热交换器将热量传导灌注内循环,并通过控制系统实时监控温度。加入4 000ml灌注液,启动加热管路,直到温度达43℃,同时加入顺铂200mg/m2(按患者体表面积进行计算)。待机器准备就绪后,开始治疗。全程监护患者生命体征及体温,同时保证管道通畅灌注时间为60min,速度400~600ml/min。1h治疗结束后,尽可能排净胸腔内液体后拔出输入管道,留置灌注出口端30F管道作为引流管。
1.4 随访及疗效评价 出院第1个月每2周电话随访1次,出院后1个月行CT扫描检查,随后每3个月行CT扫描,直至术后1年。有效率参照世界卫生组织标准进行判定,完全缓解(CR):胸腔积液完全消失,持续1个月以上不复发。部分缓解(PR):胸腔积液较前减少50%及以上,持续1个月以上。未缓解(NR)定义为胸腔积液较治疗前减少不足50%。有效率=(CR+PR)/总例数×100%。于术前及术后1个月抽取患者胸腔积液,以qPCR、Western-Blot染色及ELISE实验测量胸水中arg-1、iNOS及TNF-α浓度。严格按照试剂盒要求规范进行操作。取患者外周血测定治疗前后的肿瘤标志物癌胚抗原(CEA)进行对比。不良反应发生情况参照WHONCL-CTC3.0版抗癌药物毒性判定标准记录评价治疗期间毒副反应。
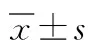
2 结果
2.1 临床疗效 胸腔镜组中CR 46例,PR 9例,NR 5例,有效率为91.67%;常规治疗组中CR 37例,PR 12例,NR 11例,有效率为86.67%;胸腔镜组有效率高于常规治疗组,差异具有统计学意义(P<0.05)。
2.2 血清学指标 治疗前两组血清CEA比较差异无统计学意义(P>0.05)。治疗后两组血清CEA均较治疗前显著下降,且胸腔镜组显著低于常规治疗组,差异具有统计学意义(P<0.05)。见表1。

表1 治疗前后两组血清CEA水平比较
2.3 肿瘤炎症因子 治疗前两组胸腔积液中的arg-1、TNF-α、iNOS无统计学差异(P>0.05)。治疗后两组arg-1、TNF-α、iNOS均较术前显著降低,且胸腔镜组显著低于常规治疗组(P<0.05)。见表2。

表2 治疗前后两组胸腔积液中炎症标志物变化比较
2.4 不良反应 两组不良反应情况比较,差异无统计学意义(P>0.05)。见表3。

表3 治疗期间两组不良反应发生情况对比
3 讨论
胸腔积液是由各种原因导致的液体于胸膜腔内病理性蓄积,恶性胸腔积液多见于恶性肿瘤胸膜转移,造成胸膜腔内广泛的炎症反应,导致胸膜腔血管通透性增加、淋巴回流受阻,局部免疫细胞相互作用形成胸腔积液。反复发作的恶性胸腔积液也是目前临床中较为常见的胸腔积液类型,目前对其的治疗相对比较复杂,通常从诊断到治疗需要经历各种程序,例如反复的穿刺活检、纤维支气管镜检查、肺泡灌洗等,尽管拥有很多的非手术诊断方法,恶性胸腔积液的诊出率仍然只有79.5%[6]。传统的胸膜固定术广泛应用于控制恶性胸腔积液,包括各种化学或者物理的胸膜固定术,但胸腔积液的复发概率相对较高,50%的患者在6个月内出现复发[3]。大量恶性胸腔积液限制了肺的通气,导致严重的呼吸及循环障碍,目前的数据显示出现肿瘤胸膜转移导致恶性胸腔积液的患者1年生存率仅为36%[7]。目前对于恶性胸腔积液的治疗主要是姑息性治疗,如胸腔闭式引流及胸腔注射硬化剂、化疗药物等,反复的手术对患者的生活质量、经济造成了极大的负面影响,同时加快了机体的衰竭,效果并不理想。近年来体腔热灌注技术(IPC)以其出色的疗效、较低的费用以及简便的操作开始广泛应用于临床胸腔积液,又由于热灌注与化疗药物的正向协同作用,热灌注联合化疗越来越多地受到人们关注,常用于恶性胸腔积液的治疗[8]。胸腔热灌注利用高温在两层胸膜之间形成无菌性炎症以达到控制胸腔积液的目的。同时肿瘤细胞在42℃的温度下可以直接灭活,不影响正常细胞。在高温下肿瘤细胞通透性增强,也增加了化疗药物的作用。但热灌注治疗后对于炎症微环境的影响研究不足。
炎症微环境在肺癌的发生发展中起着至关重要的作用,越来越多的证据证明炎症因子在非小细胞肺癌的发生发展中起着重要的作用,并与肺癌患者的预后息息相关。其中arg-1、iNOS、TNF-α在恶性胸腔积液的患者中的表达显著升高,并参与疾病的发生发展[9]。arg-1的高表达可以消耗肿瘤微环境的精氨酸,严重降低免疫系统对肿瘤的监视[10]。iNOS是介导炎症反应的重要因子,通过抑制细胞凋亡,促进肿瘤细胞增殖,加快肿瘤细胞的发生发展[11]。在肺癌患者中,TNF-α的表达显著高于正常人,该因子通过调控下游核转录因子(NF)-κb通路影响肿瘤的生长进程[12]。炎症微环境的改变和变化是胸腔积液发生发展的基本病理生理变化之一。但由于长期胸腔积液的患者往往积液呈现包裹性,肺表面因为蛋白及纤维沉积形成纤维板,热水及化疗药物很难与胸膜充分接触,因此常规的床旁的热灌注化疗对于此类患者疗效受限。胸腔镜手术清除了肺胸膜表面的纤维板,清除了无法引流的包裹性胸腔积液,使得药物与组织更好地接触,提升了疗效。本研究表明经过治疗后的恶性胸腔积液炎症因子表达低于治疗前,且胸腔镜组低于常规治疗组,提示了胸腔镜直视下清除纤维板及包裹性积液可以增加胸膜接触面积,使灌注热水及药物被胸膜充分吸收,拥有更好的疗效。同时这些改变可以更好地改善胸腔炎症微环境,达到更好的治疗效果,是胸腔镜下热灌注化疗较常规床旁化疗的优势所在。
综上所述,经胸腔镜的体腔热灌注化疗是一种微创、简便且可提高恶性胸腔积液患者生存质量的治疗方式,比常规的床旁循环灌注效果更好,其可以更好地改善患者炎症微环境可能是其发挥作用的机制。
