MicroRNA-25在喉鳞癌细胞侵袭转移中的作用探讨
2022-08-01陈立伟翟性友黄邦清刘宸箐张永侠赵建东刘明波
陈立伟,翟性友,黄邦清,刘宸箐,张永侠,赵建东,刘明波
1 解放军总医院海南医院 耳鼻咽喉头颈外科,海南三亚 572013;2 解放军总医院第六医学中心 耳鼻咽喉头颈外科医学部,北京 100048
喉癌是头颈部常见的恶性肿瘤,96% ~ 98%病理类型为鳞状细胞癌。当前,手术是治疗喉癌的主要手段,而非手术治疗,如放疗、化疗和免疫治疗,已经成为可选择的重要治疗手段[1-2]。一项癌症统计报告显示,过去40年中喉癌的5年生存率从66%下降至63%,而造成喉癌患者死亡的主要原因是局部的复发和转移[3-5]。我们试图在分子水平寻找调控喉癌发生发展的关键因子,以期推进喉癌的早期发现、早期治疗和有效生物治疗靶点的研究。我们前期在研究喉癌转移机制时成功建立喉癌淋巴结转移动物模型,应用喉鳞癌细胞系Hep-2细胞注射裸鼠舌缘黏膜下,待肿瘤形成并发生淋巴结转移后,无菌取裸鼠颈部淋巴结,培养转移到淋巴结的肿瘤细胞,经反复接种,获得高转移性Hep-2细胞亚系。进一步应用microRNA微阵列基因表达实验(LC Sciences,Houston,TX)对亲本Hep-2细胞和高转移性Hep-2细胞亚系两组细胞microRNA表达谱进行检测和分析,发现亲本喉癌细胞和高转移性喉癌细胞亚系中存在明显的microRNA差异表达现象。经过生物信息学分析及临床患者组织标本验证,我们发现microRNA-25(miR-25)和miR-100可能对喉癌侵袭转移起到重要的调控作用[6]。本研究通过增加和抑制喉鳞癌细胞系Hep-2细胞中miR-25的表达,验证miR-25对喉鳞癌细胞侵袭、迁移和增殖功能的影响。
材料与方法
1 试剂和仪器 RPMI-1640培养基、DMEM培养基、胎牛血清(美国Gibco公司),LipofectamineTM2000(Lip2000,Invitrogen公司)。
2 细胞培养和细胞转染 喉鳞癌Hep-2细胞系由解放军总医院第六医学中心耳鼻咽喉头颈外科医学部头颈外科课题组储存,细胞在含10%胎牛血清(Gibco)的DMEM培养基中于37℃、5% CO2培养箱中培养。Hep-2细胞经消化、离心后,采用完全培养基进行重悬,调整细胞密度为4×105/mL,按照6孔板中每孔2 mL细胞悬液进行接种,常规培养。待细胞生长状态良好,密度达80%左右时,更换为无血清培养基。实验设置5组:1)空白对照组,细胞不做任何处理;2)Mimic control组:细胞转染不会引起任何miRNA表达改变的mimic序列;3)Inhibitor control组:细胞转染不会引起任何基因表达改变的Inhibitor序列;4)miR-25 mimic组:细胞转染miR-25的mimic,序列可以引起miR-25的高表达;5)miR-25 inhibitor组:细胞转染miR-25的抑制序列,可以降低miR-25的表达。转染过程:取4个EP管,分别加入不含FBS的1640培养基200 µL,再各自加入转染试剂Lip2000 5 µL,轻吹混匀;取另4个EP管,均加入不含FBS的RPMI 1640培养基200 µL,再加入分别加入Mimic control、miR-25 mimic、Inhibitor control、miR-25 inhibitor 2 µL,轻吹混匀。8个管分别静置5 min;将加入Mimic control、miR-25 mimic、Inhibitor control、miR-25 inhibitor管中液体分别吸入装有Lip2000的管内,共400 µL的Mix,静置20 min;将Mix滴入6孔板内,前后左右摇晃10 ~ 15次;置培养箱内,孵育6 h后更换为含FBS的RPMI 1640培养基;转染24 h后收集各组细胞,进行后续检测。
3 RT-qPCR验证miR-25的表达 采用 Invitrogen公司的Trizol试剂盒及操作方法提取细胞总RNA,紫外分光光度法定量后,采用GoScriptTM公司逆转录试剂盒,取2.5 µg总RNA进行逆转录反应,逆转录产物采用SYBR Green方法进行PCR扩增。反应条件:预变性,95℃,2 min;变性,95℃,20 s;退火,60℃,20 s;延伸,72℃,30 s;40个循环;熔解曲线分析:95℃,1 min;60℃,1 min;95℃,30 s。反应完成后,采用2-△△Ct法作为相对定量差异表达的度量。所有反应都以U6小核RNA用作内参对照,以确定相对microRNA表达水平。
4 Transwell细胞侵袭实验 各组细胞经转染处理后制备成细胞悬液,调整细胞浓度为2×105/mL。用Matrigel(1 mg/mL,美国BD公司)胶包被Transwell小室(孔径8 µm,美国Corning公司)。取细胞悬液200 µL加入Transwell上室,下室中加入500 µL的DMEM完全培养基,尽量排除两室之间的气泡。培养12 h后取出Transwell小室,用蘸有PBS的棉签擦去小室上层的细胞,取下Transwell膜,甲醇固定20 min后,PBS清洗3次,Giemsa染液,染色30 min,PBS清洗3次,弃去PBS后晾干,于显微镜下随机选取5个视野拍照计数,取平均值为最终结果。
5 细胞划痕实验 将转染后24 h的各组Hep-2细胞以1×105/孔接种于24孔板中,待细胞密度达到80%以上融合时,弃去上清,保证Tip头垂直进行划痕,各孔划痕宽度保持基本一致。采用PBS洗涤3次后向各孔中加入无血清培养基,置于37℃、5% CO2培养箱中继续培养,间隔48 h后观察细胞分布并进行拍照。细胞划痕愈合率=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。
6 MTT细胞增殖实验 收集各组细胞,以1×103/孔接种细胞于96孔板中,在含10%胎牛血清的DMEM培养基中培养,分别于第1、2、3、4天加入20 µL MTT(5 mg/mL,美国Sigma-Aldrich公司),培养4 h后,加入150 µL DMSO,振荡10 min ,使结晶物充分溶解。490 nm酶联免疫检测仪检测各孔光吸收值。以时间为横轴,光吸收值为纵轴,绘制细胞增殖曲线。
7 统计学分析 采用Stata软件进行统计分析。计量资料以x±s表示,两组间比较用t检验,三组间比较用单因素方差分析+多重比较LSD-t检验。P<0.05为差异有统计学意义。
结 果
1 Hep-2细胞中miR-25表达的变化 转染miR-25 mimic 24 h后,RT-qPCR检测发现Hep-2细胞中miR-25的表达量是正常对照组的2.48倍(P<0.01),而转染miR-25 inhibitor 24 h后,RT-qPCR检测发现Hep-2细胞中miR-25的表达量较正常对照组下降了35%(P<0.05)。见图1。
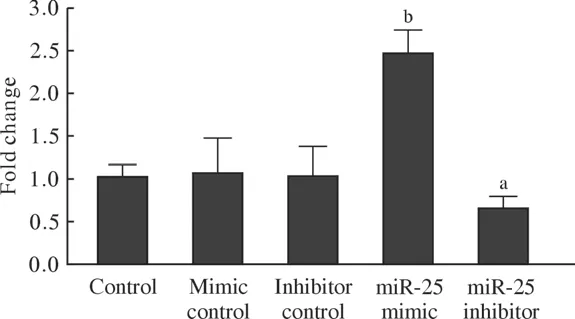
图1 RT-qPCR检测Hep-2细胞转染miR-25 mimic和miR-25 inhibitor后miR-25表达变化(aP<0.05,bP<0.01,vs Control)Fig.1 RT-qPCR detection of miR-25 expression after transfection of miR-25 mimic and miR-25 inhibitor (aP<0.05, bP<0.01, vs control)
2 细胞侵袭能力观察 Transwell细胞侵袭实验显示,miR-25 mimic转染Hep-2细胞24 h后,Hep-2细胞穿过Transwell小室的肿瘤细胞数量显著低于对照组(P<0.01),证明miR-25的高表达显著抑制了喉癌Hep-2细胞的体外侵袭能力。抑制miR-25表达后,得到了与过表达miR-25表达相反的实验结果,即Hep-2细胞的侵袭能力出现显著增加(P<0.01)。见图2。
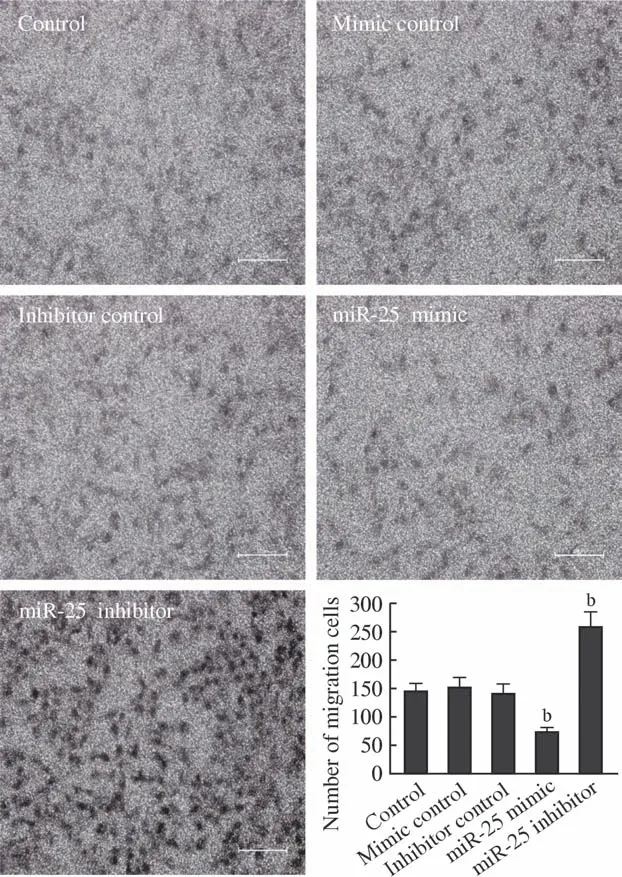
图2 Hep-2细胞Transwell侵袭实验(bP<0.01,vs Control)Fig.2 Transwell cell migration test of Hep-2 cells (bP<0.01, vs control)
3 细胞迁移能力观察 Hep-2细胞中miR-25过表达后,Hep-2细胞划痕愈合率(32.4%±3.05%)显著低于正常对照组(47.2%±4.324%);而抑制miR-25的表达后Hep-2细胞划痕愈合率(87.2%±5.45%)显著高于正常对照组。见图3。
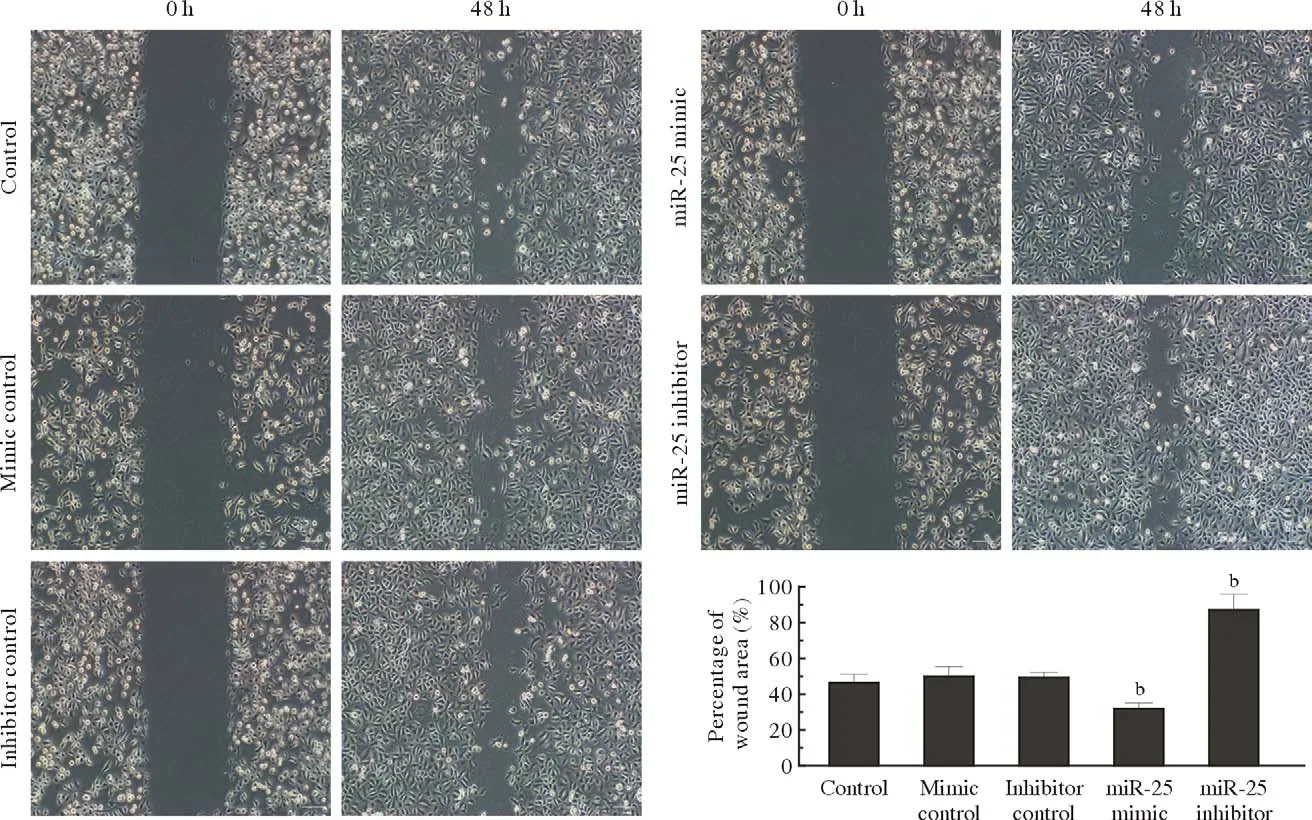
图3 Hep-2细胞划痕实验(bP<0.01,vs Control)Fig.3 Cell scratch test of Hep-2 cells (bP<0.01, vs control)
4 细胞增殖能力观察 MTT细胞增殖实验结果显示,喉鳞癌Hep-2细胞转染miR-25 inhibitor、miR-25 mimic后,与正常对照组比,miR-25低表达组在第3天时肿瘤活细胞数量显著增加,第4天时由于96孔板内细胞覆盖度达到100%,导致差异消失。miR-25过表达组肿瘤活细胞数量显著减少,Hep-2细胞增殖能力在第3、4天均表现为显著降低。见图4。
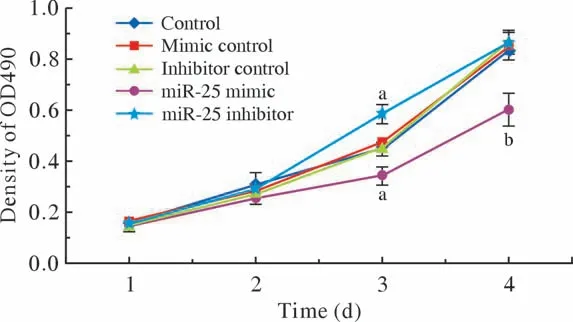
图4 Hep-2细胞MTT增殖实验 (aP<0.05, bP<0.01,vs Control)Fig.4 MTT cell proliferation test of Hep-2 cells (aP<0.05, bP<0.01,vs control)
讨 论
MicroRNA是单链小型非编码RNA,含有大约22个核苷酸。MicroRNA通过与mRNA3'端的非翻译区结合,抑制mRNA的翻译或降解mRNA。大量研究表明,microRNA可以通过调节癌细胞增殖、分化、侵袭、迁移和细胞凋亡在癌症中起着关键作用[7-9]。
在所有 microRNA 中,miR-25 是在人类不同癌症中研究最多、描述最充分的microRNA之一。miR-25在不同癌症中的作用报道不一,在前列腺癌和结肠癌中,miR-25表达降低起到肿瘤抑制剂作用[10]。而在乳腺癌、卵巢癌、胃癌、肝细胞癌及肺癌中miR-25表达显著增加,起到促进肿瘤细胞生长和增殖的致癌作用[11-17]。一项结肠癌的研究报道,人类结肠癌组织中的miR-25与匹配的非肿瘤黏膜组织相比,处于低调节。有研究表明,miR-25可抑制肿瘤细胞增殖和迁移,而且是通过调节Smad7起作用[18]。miR-25在喉癌中的作用目前仍未明确。我们前期研究发现,在高转移性喉癌细胞中miR-25的表达显著降低,且在喉癌患者肿瘤标本中得到验证[6]。
本研究中,通过转染miR-25 mimic和miR-25 inhibitor分别过表达和抑制喉鳞癌Hep-2细胞中的miR-25,发现miR-25表达量的下降显著增加了Hep-2细胞的体外侵袭迁移能力,并且Hep-2细胞的体外增殖能力也显著增加。而miR-25的表达上调后,喉癌细胞的恶性能力显著下降。提示miR-25在喉鳞癌中起到抑癌作用,与我们前期研究发现在转移性喉癌组织中miR-25表达量下降的结果一致。研究结果高度提示miR-25作为抑癌因子在喉鳞癌的恶性进展中起到至关重要的作用,进一步研究其作用机制具有较大的临床价值,可帮助我们寻找喉癌治疗的靶点基因。
