钛表面芬母多肽涂层的构建及其抗菌性能探究
2022-08-01吴奇蓉周和阳汤春波
吴奇蓉,雷 晨,吴 迪,周和阳,汤春波
钛及其合金具有稳定的化学性质和良好的生物相容性,是牙科植入物的主要材料。随着临床上的广泛运用,也暴露出了一些不足。种植体周围炎是影响种植体长期成功率的重要原因[1]。细菌定植在种植手术后几分钟内发生,并贯穿种植体的整个生命周期[2],理想的表面材料能够在初次接触时清除或杀灭病原体来防止生物膜的形成,这对种植体的存活至关重要[3]。
一些金属离子、非金属化合物和生物分子已被用作抗菌涂层的制备。含有Zn[4]、Ag[5]、Mg[6]、碘[7]、氯己定[8]等的涂层已被证实具有良好的抗菌效果,然而随着时间的推移,抗菌物质释放逐渐减少,其抗菌性能也会降低。抗菌肽(antimicrobial peptide,AMP)是天然免疫系统的一部分,具有广谱的抗菌活性,近年来被广泛研究,可以为改性材料提供长期的抗菌效果[9-10]。Wang等[11]通过多巴胺自聚合将阳离子抗菌肽DJK-5共价锚定到预活化的多孔钛合金表面,制备了一种新型的多功能涂层,对革兰氏阳性菌和革兰氏阴性菌的抗菌效率均在90%以上。Boix-Lemonche等[12]将一种α-螺旋抗菌肽BMAP-27共价结合到钛表面,能有效预防细菌定植。
芬母多肽(funme peptide,FP)是一种来源于BMAP-27的重组抗菌肽,分子质量为2 474.580 6 u,与亲本AMP相比,FP具有分子质量小、抗菌活性高、溶血活性低等特点[13]。同时具有热稳定性和较好的水溶性;作用于细菌细胞膜,导致膜的通透性增大,对革兰氏阳性菌、真菌、寄生虫以及病毒等具有较强的杀菌和有效抑制作用,对高等动物正常细胞几乎无毒害作用;且不易产生耐药性[14-15]。硅烷化是一种通过材料表面的羟基将有机官能化的烷氧基硅烷分子固定,然后与多肽反应、结合的过程。形成的结合是共价结合,稳定且处理简便[16-17]。
为了探讨将FP负载在钛表面以减少感染的可能性,我们采用硅烷化处理将FP共价结合到大颗粒喷砂酸蚀(sandblast and acid-etching,SLA)钛表面,通过检测MC3T3-E1细胞的黏附和增殖、金黄色葡萄球菌(Staphylococcusaureus,S.aureus)的活性对其生物相容性及抗菌性能进行了探究。
1 材料与方法
1.1 材料与仪器
医用四级纯钛片(TA4,高洁丽康,中国),浓硫酸、浓盐酸、氢氧化钠、无水戊烷、3(氯丙基)-三乙氧基硅烷(3-chloropropyltriethoxysilane,CPTES)、N,N-二异丙基乙胺(N,N-diisopropylethylamine,DIEA)(国药,中国),磷酸盐缓冲液(PBS,Gibco,美国),BCA蛋白试剂盒(碧云天,中国),罗丹明-鬼笔环肽(翊圣生物科技,中国),DAPI(碧云天生物科技,中国),CCK-8 试剂盒(同仁,日本),LB固体培养基、LB液体培养基(阿拉丁,中国),芬母多肽(FP,吉锐生物,中国),小鼠颅骨前成骨细胞系MC3T3-E1(中乔新舟,中国),S.aureus(ATCC 25923,无锡赛维,中国),Quantera Ⅱ X射线光电子能谱仪(PHI,美国),SL200B静态水接触角检测仪(梭伦,中国),DMI3000B倒置荧光显微镜(Leica,德国),SpectraMaxMe多功能酶标仪(Molecular Devices,德国),SCAN 1200全自动菌落分析仪(Interscience,法国)。
1.2 样品制备
1.2.1 SLA表面制备 用SiC砂纸(400、800、1 200、1 800目)将钛片逐级打磨抛光直至表面光滑,超声清洗后烘干。在30 kPa的压强下用80目的氧化铝颗粒对纯钛表面垂直喷砂处理,超声清洗后烘干。经浓硫酸/浓盐酸混合溶液(36.0% H2SO4、5.8% HCl)在60 ℃水浴条件下酸蚀6 h,超声清洗烘干,获得SLA钛表面作为对照。
1.2.2 FP涂层的构建 实验组在SLA的基础上用5 mol/L NaOH溶液60 ℃水浴处理30 min,超声清洗烘干。然后顺序加入无水戊烷、CPTES和DIEA(体积比11.7∶2∶1)使钛片浸没,室温浸泡1 h,用异丙醇、无水乙醇、双蒸水依次超声清洗后烘干。最后将FP冻干粉末用PBS配制成0.2、1.0、5.0 mg/mL三个质量浓度,钛片浸泡过夜,获得SLA-0.2、SLA-1、SLA-5三个实验组,紫外线消毒备用。
1.3 表面元素分析
用X射线光电子能谱仪分析样品表面的化学成分。工作功率为150 W,在7.5×10-7Pa的压强、0.1 eV阶跃下,通过能量为25 eV的高分辨率光谱进行记录。使用Casa XPS 2.3.16软件分析数据。
1.4 水接触角
将2 μL的超纯水滴在样品表面,用静态水接触角检测仪在24 ℃下记录10 s内的接触角。
1.5 蛋白吸附
消毒后的SLA、SLA-0.2、SLA-1和SLA-5样品(n=3)分别放置于24孔板中,每孔加入1 mg/mL牛血清白蛋白(BSA)溶液1 mL,37 ℃孵育1 h。PBS轻洗3次后,加入10% SDS裂解液处理1 h,洗脱收集样品表面吸附的蛋白,与BCA工作液混匀,37 ℃孵育30 min,在562 nm的波长下测得光密度D,根据标准蛋白曲线计算蛋白浓度。
1.6 生物相容性检测
1.6.1 细胞黏附 消毒后的各组样品(n=3)分别放置于24孔板中,将MC3T3-E1细胞以3×104个/孔的密度接种到材料表面。培养4 h后,用PBS轻洗3次,4%多聚甲醛固定30 min,0.1% Triton X-100通透细胞5 min。避光条件下,先用罗丹明-鬼笔环肽对细胞骨架染色30 min,再用DAPI对细胞核染色1 min。用倒置荧光显微镜观察并记录材料表面细胞黏附与铺展情况。
1.6.2 细胞增殖 消毒后的各组样品(n=3)分别放置于24孔板中,将MC3T3-E1细胞以3×104个/孔的密度接种到材料表面。培养1、3、5 d后,分别加入含10% CCK-8的完全培养基避光孵育2 h,用多功能酶标仪测定450 nm处的光密度D。
1.7 抗菌性检测
1.7.1 细菌培养S.aureus用LB固体培养基在37 ℃,5% CO2的培养箱中培养,每1~2 d进行传代。
1.7.2 菌落计数和抑菌率检测 以LB液体培养基为溶剂,1×106CFU/mL为浓度,制备S.aureus悬浊液。消毒后的各组样品(n=3)分别放置于24孔板中,每孔加入1 mL菌液,37 ℃培养24 h。弃菌液,PBS清洗2次洗去浮菌。每孔加入1 mL PBS,用超声将样品表面S.aureus洗脱,梯度稀释菌液,各取100 μL接种于LB固体培养基上,用L形棒均匀涂抹。37 ℃培养24 h后,用全自动菌落分析仪计数细菌菌落(CFU),按以下公式计算抑菌率:抑菌率=(对照组菌落-实验组菌落)/对照组菌落×100%。
1.8 统计学方法
每项实验重复3次,采用SPSS 22.0软件进行统计学分析,采用GraphPad Prism 5软件绘制图表,采用单因素方差分析和t检验统计分析数据,当P<0.05时,认为差异具有统计学意义。
2 结 果
2.1 表面元素
材料表面的化学成分如图1所示,相对于SLA组,实验组样品中有硅(Si 2p)存在,同时碳(C 1s)和氮(N 1s)的含量增加,氧(O 1s)和钛(Ti 2p)的含量降低。
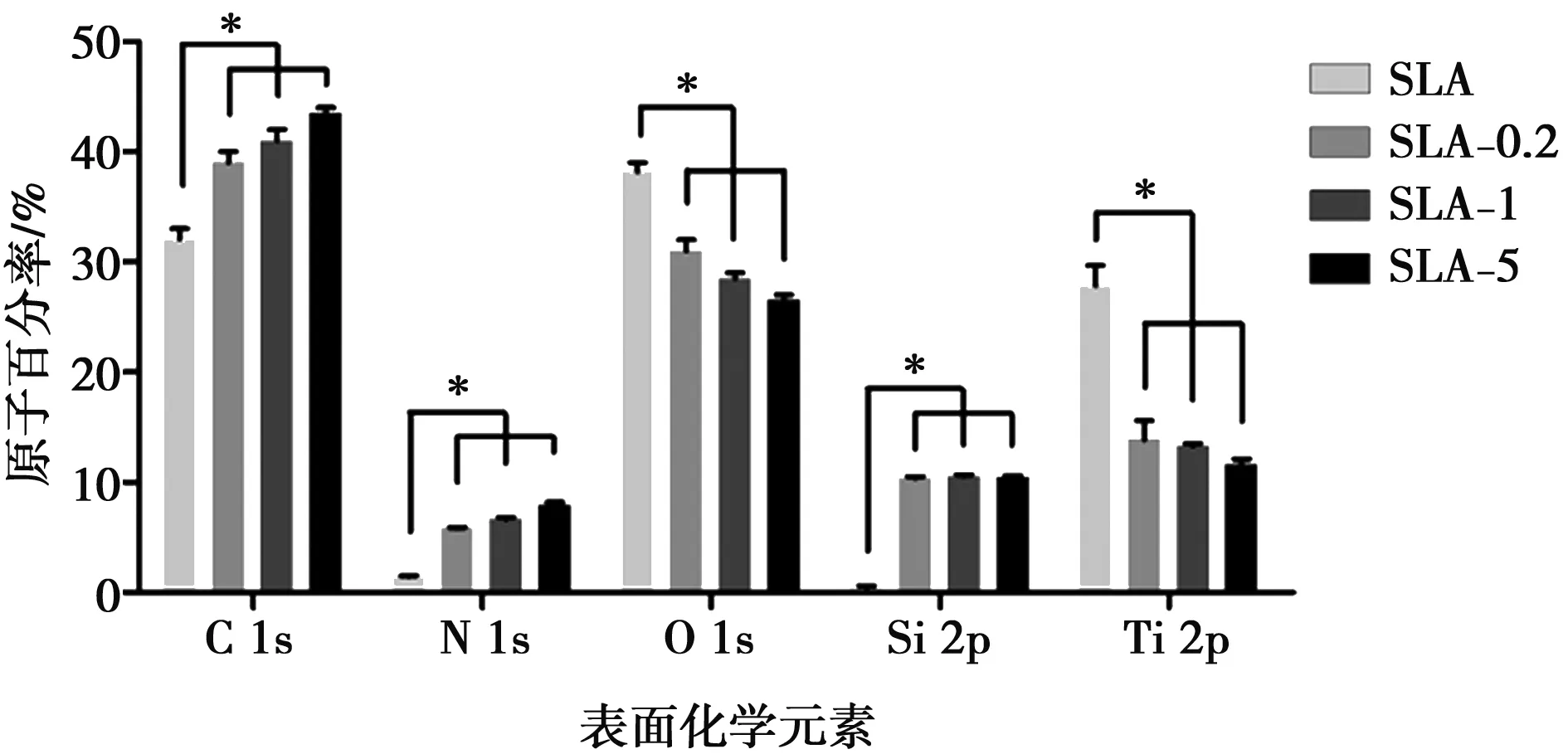
*:P<0.05
2.2 水接触角
材料表面的水接触角如图2所示,与SLA对照组相比,SLA-0.2、SLA-1和SLA-5组表面的水接触角明显降低,差异具有统计学意义。说明载FP钛表面亲水性更强,且SLA-5组水接触角<10°,为超亲水表面,这可能是由于硅烷化处理后表面形成大量的羟基。
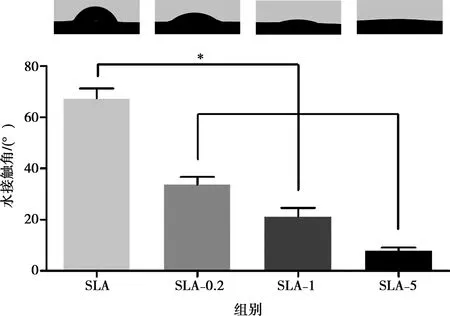
*:P<0.05
2.3 蛋白吸附
SLA、SLA-0.2、SLA-1和SLA-5组表面蛋白吸附量分别为(0.052 4±0.003 8)、(0.076 5±0.003 9)、(0.089 5±0.003 7)、(0.085 1±0.002 4)mg。SLA-0.2、SLA-1和SLA-5组对蛋白质的吸附能力显著高于SLA组(P<0.05)。
2.4 细胞黏附形态
图3为MC3T3-E1细胞在材料表面培养4 h后的黏附与铺展情况。SLA组黏附细胞较少,细胞较为皱缩,SLA-0.2、SLA-1和SLA-5组表面均观察到黏附了更多的细胞,细胞形态也更为铺展,面积更大、伪足更多,其中SLA-1和SLA-5两组与对照组的差异更为明显。
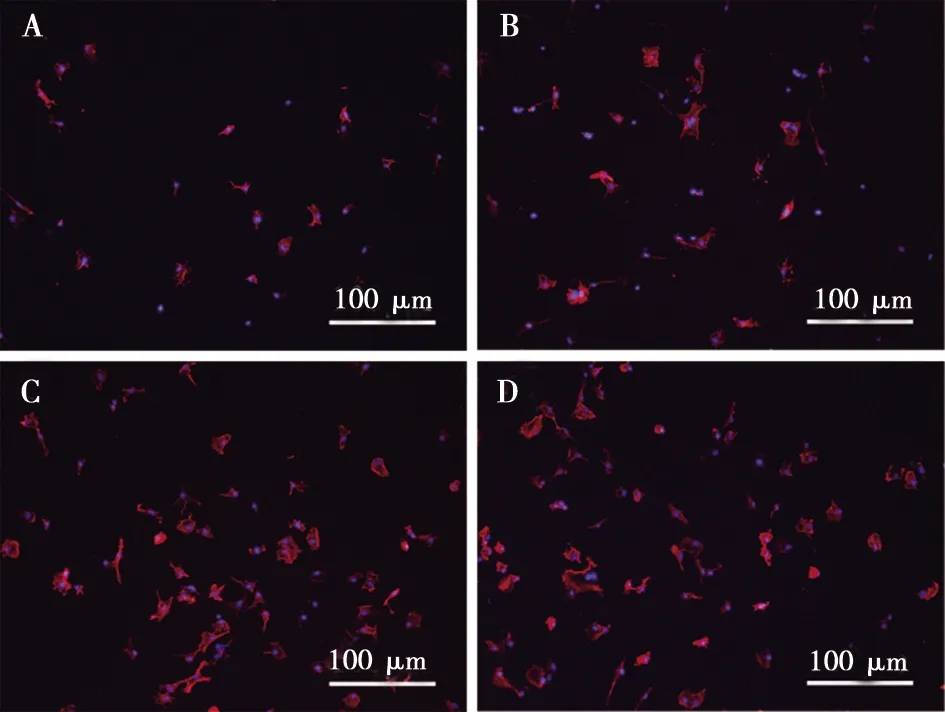
A:SLA组;B:SLA-0.2组;C:SLA-1组;D:SLA-5组
2.5 细胞增殖活性
图4为CCK-8检测材料表面MC3T3-E1细胞的增殖情况。第1天,4组结果相近,差异无统计学意义。第3、5天,SLA-1和SLA-5组细胞增殖明显高于SLA组(P<0.05),SLA-0.2组仅在第5天高于SLA组。
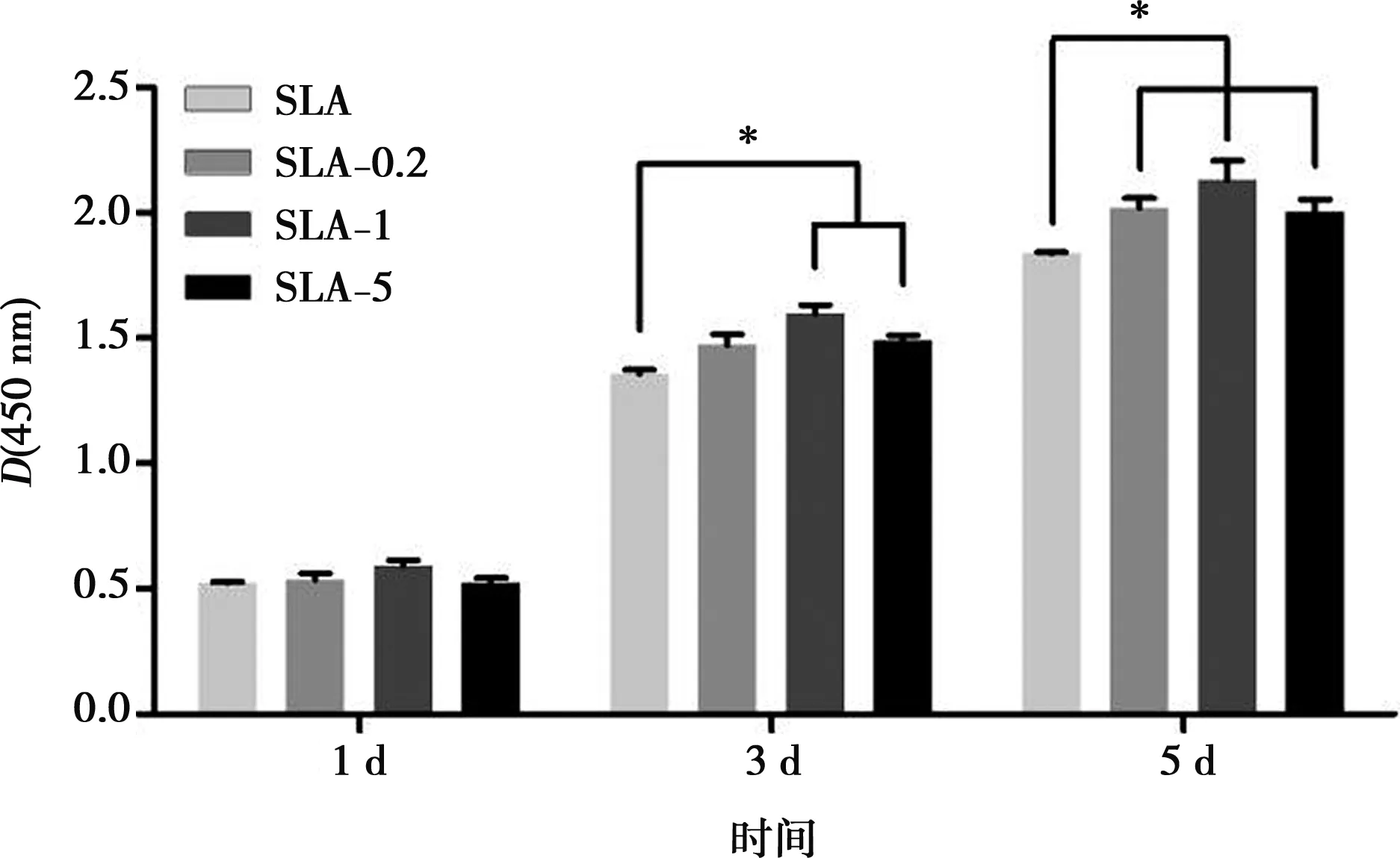
*:P<0.05
2.6 菌落形成单位和抑菌率
图5A为各组材料平板菌落计数的结果,按表面活菌菌落数量多少排列为SLA组>SLA-0.2组>SLA-1组>SLA-5组。以SLA组作为对照,计算SLA-0.2组、SLA-1组和SLA-5组的抑菌率,分别为74.33%±3.92%、93.75%±1.48%和100.00%。如图5B所示,SLA-1和SLA-5组的抑菌率显著高于SLA-0.2组(P<0.05)。
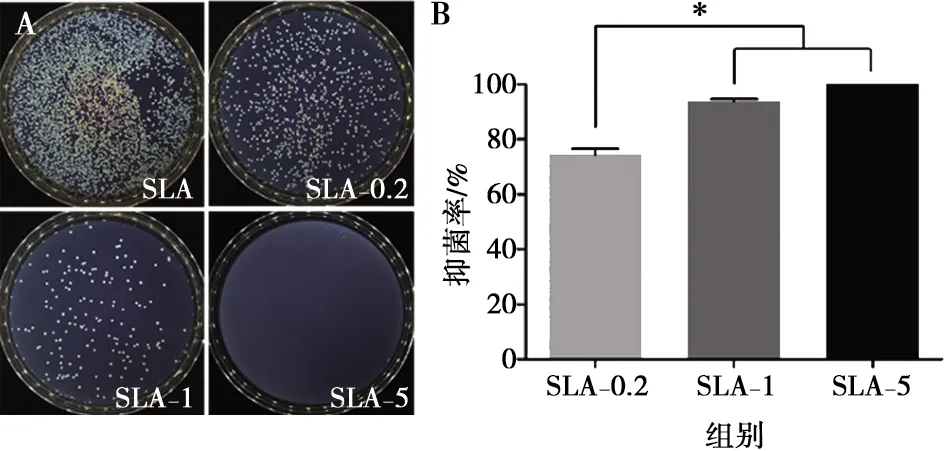
A:4组样品表面的活菌菌落数;B:4组材料表面的抑菌率;*:组间差异统计学意义,P<0.05
3 讨 论
抗菌肽BMAP-27、LF1-11等被证明固定在固体载体上也具有强大的灭菌活性[18-19],通过共价结合连接到钛片上,这种连接对其抗菌性能没有显著影响[20-21]。在本研究中,对处理步骤进行了改进,SLA钛片先用氢氧化钠碱热处理,获得Ti—OH表面,然后用CPTES对钛表面进行硅烷化处理,随后与肽N-端上的氨基反应,获得共价结合。为了验证功能化过程是否成功,通过XPS对钛样品进行了表征。正如预期的那样,实验组样品中硅的存在以及碳和氮含量的增加支持样品被成功硅烷化。相对于SLA组,实验组样品中碳和氮的含量增加,氧和钛的百分含量降低,表明多肽分子在硅烷化的金属表面上附着稳定,从而证实了FP链接到钛表面的步骤是合理可靠的。
种植体植入体内后,水和无机盐率先到达种植体表面,然后蛋白质介导细胞与种植体之间的黏附[22]。因此,细胞在材料表面的附着和增殖与材料的亲水性和蛋白质吸附能力密切相关。结果表明,实验组的亲水性显著提高,对蛋白质的吸附能力也明显增强,同时MC3T3-E1细胞在实验组表面的增殖活性更高,细胞也更为铺展,表明载FP钛表面具有良好的生物相容性,对MC3T3-E1细胞无细胞毒性作用,其中1 mg/mL组的结果最好。
种植体的早期感染通常由手术部位的S.aureus等病原体引起[23-24],故本实验选用S.aureus作为实验菌来检测材料的抗菌性。阻止细菌在种植体表面的初始黏附是防止生物膜形成的关键。有研究表明,生物膜中细菌对抗生素的耐药性是浮游细菌的10~1 000倍[25]。实验结果表明,载FP钛表面对细菌有良好的杀灭效果,抑制其生长和繁殖,与负载的FP浓度成正相关,5 mg/mL组表现出最佳的抗菌效果,高达100.00%。
在本研究中,我们通过硅烷化制备载FP的多孔钛表面,研究了其生物相容性和抗菌活性。然而,AMPs是由天然免疫系统产生的多肽,除了具有抗菌作用外,还具有广泛的免疫调节特性[26-27],有待进一步研究载FP钛表面对炎症反应和破骨细胞生成的影响,并探讨可能的作用机制。
