唑来膦酸对大鼠颌面骨和外周骨创伤后骨改建的影响
2022-08-01钱文昊苏俭生
龚 雪,钱文昊,苏俭生
双膦酸盐(bisphosphonates,BPs)具有较强的抑制骨吸收作用,是目前临床上应用最广泛的一线抗骨质疏松药物。它可通过延缓骨破坏,提高骨矿物质密度,增强骨骼强度以及降低骨折发生率,极大地提高患者的生活质量。然而近年来临床发现,长期应用BPs类药物可引起双膦酸盐相关性颌骨坏死(bisphosphonate-related osteonecrosis of the jaw,BRONJ)等严重不良反应[1-4],引发国内外学者广泛关注。有流行病学资料显示[5-7]:接受静脉BPs类药物治疗的肿瘤患者,BRONJ的累计发病率为0.8%~12%;口服BPs类药物治疗的患者,BRONJ发病率较低,为0.01%~0.04%,但当加入拔牙等口腔侵入性治疗这一危险因素后,发病率呈现数量级的提升。BRONJ多发生于拔牙等口腔外科治疗后。60%~70%的BRONJ患者具有拔牙等创伤史,拔牙被认为是BRONJ发生的最重要的危险因素[8-9],而伴有口腔炎性疾病在一定程度上又增加了罹患BRONJ的风险[10-12]。因此,口腔科医师在给服用BPs类药物的患者实施拔牙、牙周手术、牙植入、根尖手术等操作前需要仔细评估[13-14]。目前BRONJ无确切有效的临床治疗方法,仅限于保守治疗,且传统的治疗方法如大剂量抗生素、死骨清创术以及高压氧舱治疗等对其疗效并不理想[15-16]。上述治疗方法的问题和局限性使我们必须重新考虑治疗策略。因此,研究BPs导致的拔牙后颌骨坏死的致病机制和治疗方法,显得非常紧迫和必要。
BRONJ的致病机制迄今不明,多数学者认为拔牙等手术造成颌骨创伤后,BPs对破骨细胞产生的强大抑制作用导致颌骨骨改建受到过度抑制[17]。在正常骨组织中,成骨细胞和破骨细胞维持着一定的动态平衡,使得骨组织具有吸收重建功能。日常咀嚼等活动会对颌骨造成微创伤,但这种微创伤可通过骨内代谢完成自我修复。但BPs严重抑制了骨改建,从而导致拔牙窝周围骨组织重建失败,引发颌骨坏死。但这不能解释一个关键问题,为什么目前所报道的BRONJ多发生于颅颌面骨,未见发生于外周骨。从胚胎来源看,颅颌面骨起源于外胚间叶组织,主要为膜内成骨;外周骨起源于中胚层,骨发生形式为膜内成骨伴随软骨内成骨[18-19]。颅颌面骨和外周骨创伤重建过程中,破骨所需的细胞均来源于造血系统的单核巨噬细胞系,但成骨所需的细胞来源于各自局部组织内的骨髓间充质干细胞(bone marrow stromal cells, BMSCs)。颅颌面骨和外周骨来源的BMSCs在增殖、诱导活性等方面具有不同的特性[20]。骨的重建由骨的生成和吸收构成,成骨细胞和破骨细胞的动态平衡是维持正常骨量的关键。
目前,关于BRONJ发病机制的研究主要集中在BPs对破骨细胞的作用,BPs作用下颅颌面骨和外周骨创伤修复能力差异不甚清楚。本实验从骨组织位点特异性角度出发,采用颌骨拔牙和胫骨制备骨创伤,观察第3代BPs代表药物唑来膦酸对大鼠颌骨与外周骨创伤后骨改建的影响,为探索BRONJ发病机制提供一个新的方向。
1 材料与方法
1.1 实验动物
8~10周龄SPF级雌性Sprague-Dawley大鼠,体质量200~250 g,由上海市斯莱克实验动物中心提供。
1.2 试剂和仪器
唑来膦酸、蛋白酶抑制剂(Sigma,美国);水合氯醛、利多卡因、多聚甲醛、EDTA、二甲苯、乙醇、石蜡(上海国药,中国);苏木精-伊红染色试剂盒(南京建成,中国);Masson染色试剂盒(凯基生物,中国);大鼠RANKL ELISA试剂盒,大鼠OPG ELISA试剂盒(武汉中美,中国);BCA蛋白检测试剂盒(康为生物,中国);石蜡包埋机、石蜡切片机、石蜡展片机、石蜡烘片机、微电子计算机断层扫描(Leica,德国);倒置相差显微镜(Nikon,日本);移液器(Eppendorf,德国);离心机、洗板机(Thermo,美国);酶标仪(Tecan,瑞士)。
1.3 实验方法
1.3.1 大鼠颌骨和外周骨创伤的建立 大鼠随机分为实验组和对照组,每组36只。实验组每周尾静脉注射唑来膦酸(80 μg/kg),对照组注射等剂量磷酸盐缓冲溶液(phosphate buffered saline,PBS)。用药两周后,在腹腔注射全身麻醉以及局部浸润麻醉下,牙龈分离器分离牙龈,微创拔除一侧上颌第一磨牙(图1A),并用纱布压迫止血。同时在同侧胫骨近心端切开皮肤,钝性分离组织,暴露胫骨上端,在生理盐水冷却下于膝关节下约2~3 mm处用慢速手机制备骨缺损(图1A),然后用纱布压迫止血后复位组织,缝合创口。术后肌注青霉素(500 000 U/kg)3 d以防止感染。之后继续用药,至术后1周、4周、12周,大鼠分批处死后,分离并收集颌骨和胫骨组织。

A:大鼠颌骨拔牙创;B:大鼠胫骨骨缺损;蓝色椭圆表示骨缺损部位
1.3.2 Micro-CT检测 分离和收集的骨组织样本进行Micro-CT检测,分析各组骨缺损区新骨形成情况。扫描参数设置为电压45 kV,电流550 μA,分辨率10 μm。扫描完成后,利用Dateviewer Pro和CTvol Software分析处理骨体积(bone volume,BV)、总体积(total volume,TV)和骨体积分数(BV/TV)数据。
1.3.3 组织学检测 收集的骨组织样本PBS冲洗干净后,在4 ℃下经4%多聚甲醛固定完全后冲水过夜,然后用10% EDTA在室温下脱钙,每3 d更换脱钙液至样本变软,以注射针头轻松刺入为准。冲水过夜后,用脱水机乙醇梯度脱水、二甲苯透明、浸蜡,包埋机石蜡包埋后,以5 μm的厚度切片、展片、烘片,进行HE和Masson染色。
1.3.4 骨组织中RANKL、OPG测定 将原缺损区域的骨组织即刻放入液氮进行低温冷冻,待所有样本收集完毕后,用灭菌后的研钵对冷冻的骨组织进行充分研磨。用T-PER试剂进行组织裂解,离心后得到组织裂解液。按照ELISA试剂盒说明定量检测样本RANKL、OPG含量。考虑到不同骨组织样本中细胞数目不同对总的RANKL、OPG含量产生影响,我们检测了总蛋白含量来对其含量进行标准化处理。
1.4 统计学分析
以上所有定量数据以平均值±标准差形式呈现,使用SPSS 16.0软件包采用独立样本t检验分析组间差异,P<0.05表示具有统计学意义。
2 结 果
2.1 Micro-CT扫描分析
Micro-CT三维重建后各组样本的矢状切面图如图2。拔牙后4周,实验组拔牙创表面高低不平,中央有浅碟状凹陷,可见游离的死骨片;对照组拔牙创可见新骨生成,已观察不到明显的缺损边界,但新骨形成表面较不平整。拔牙后12周,实验组拔牙创与4周时基本相似,表面仍高低不平,中部浅凹处有大量的游离死骨片,骨坏死呈现加剧趋势;对照组新骨形成区域与周边骨质均匀连接,骨改建已基本完成。术后4周,实验组胫骨骨缺损基本愈合,只是表面较不平整,骨皮质明显较对照组增厚,新骨生成亦较对照组活跃,松质骨内充盈着大量新生骨,形态规则,排列紧密;而对照组骨松质内的新生骨则较稀疏。术后12周,实验组胫骨缺损区骨皮质完整连续,较对照组厚且致密,骨改建已基本完成,骨松质内的新生骨亦明显较对照组排列紧密。
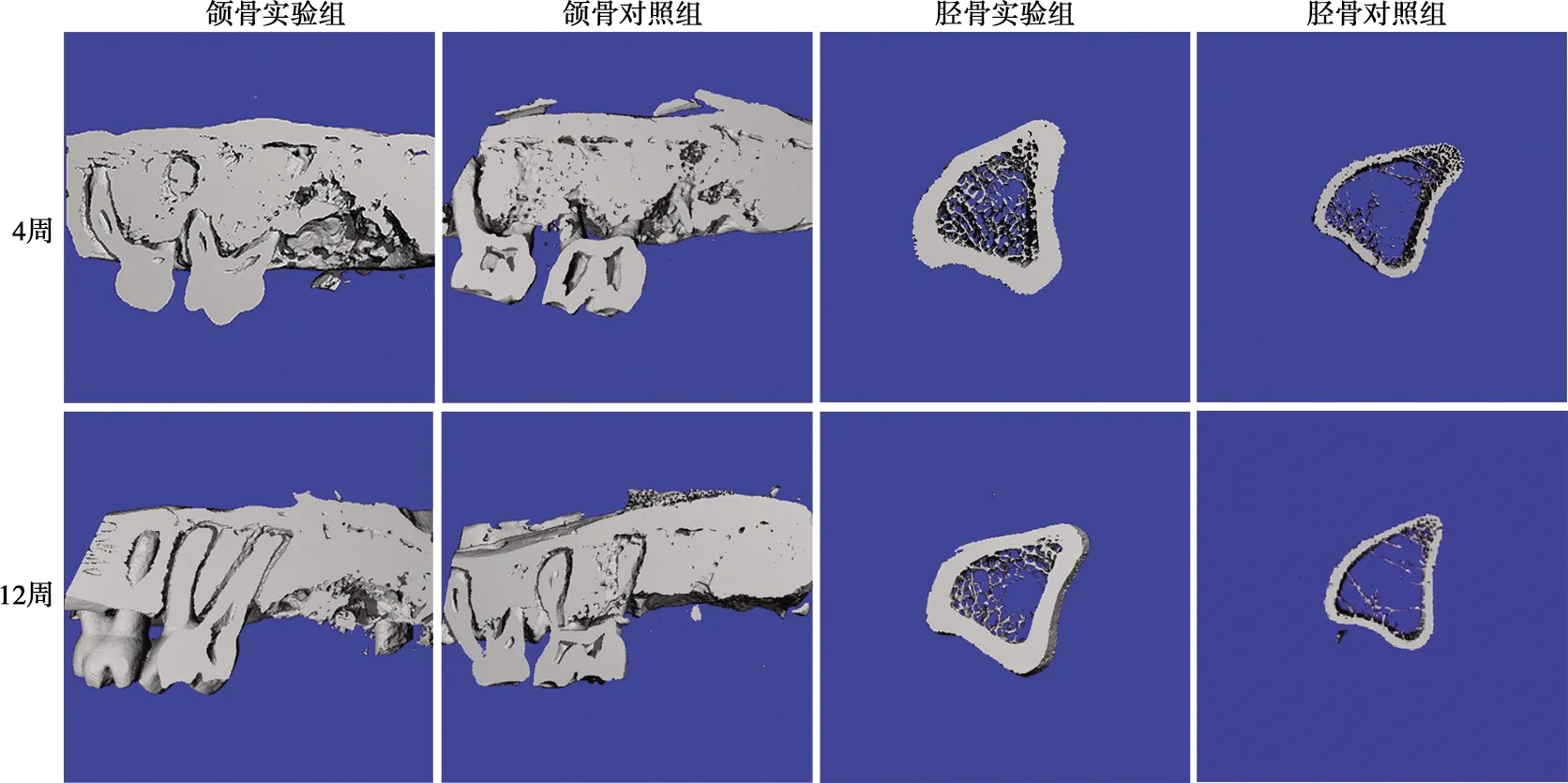
图2 术后大鼠颌骨和胫骨Micro-CT矢状切面图
各组样本术后BV/TV分析结果如表1。术后4周和12周,实验组胫骨BV/TV比值较对照组明显上升(P<0.05),实验组颌骨BV/TV比值较对照组差异无统计学意义。

表1 骨体积分数BV/TV分析
2.2 组织学结果
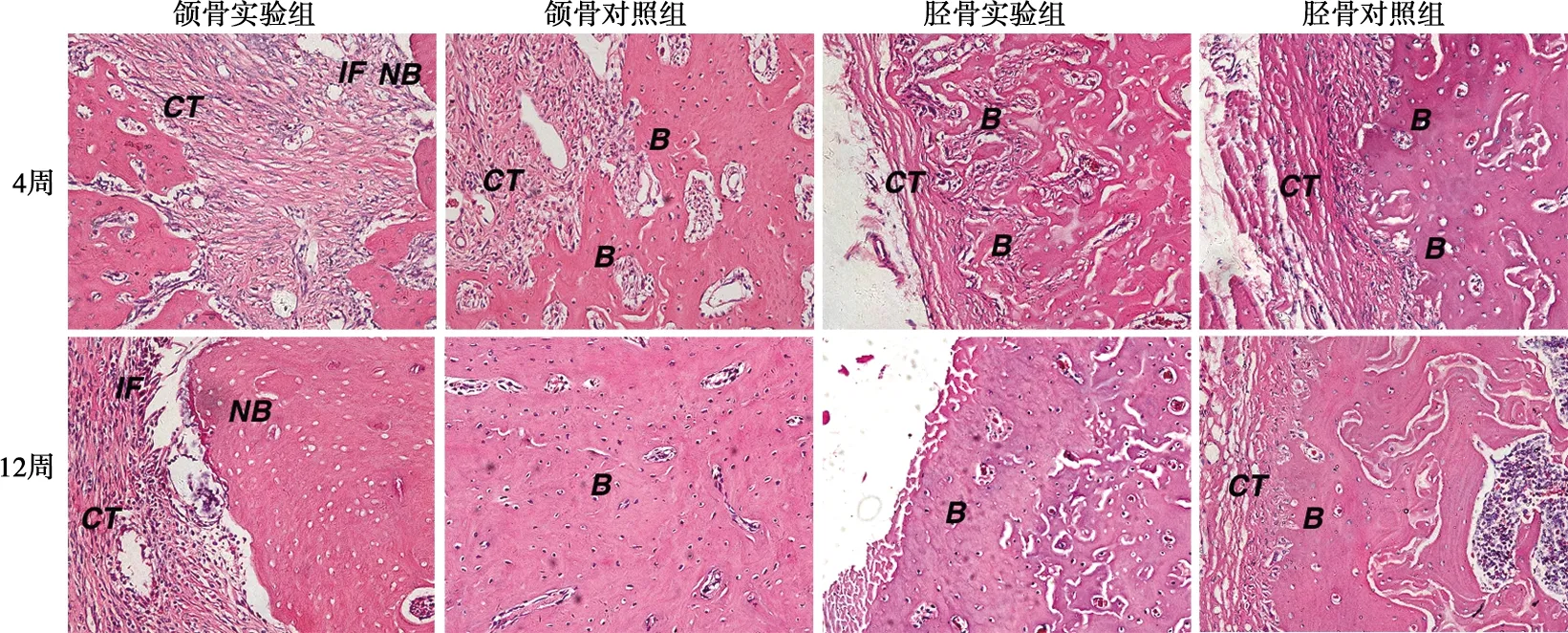
组织学染色结果如图3~5。拔牙后4周,实验组拔牙创仍未愈合,创区黏膜溃烂,可见骨面暴露,死骨形成。在高倍镜下,病变骨质中骨细胞细胞核固缩或缺失,出现许多空的骨陷窝,而骨小梁排列紧密、增生明显,骨质出现不同程度的硬化,且周围伴有大量的炎性细胞浸润,为典型的BRONJ组织病理表现。对照组拔牙创已愈合,上皮组织已经完全覆盖创面。在高倍镜下,可见大量形态规则的骨小梁结构生成,开始了正常的生理性骨改建。拔牙后12周,实验组部分样本拔牙创表层虽有上皮组织覆盖,但在高倍镜下,骨坏死却呈现加剧趋势,空骨陷窝明显增多,死骨面积增大,坏死骨周围炎症浸润亦更为严重。对照组上皮组织完全覆盖创面,上皮下骨组织均匀连续,骨改建已基本完成。
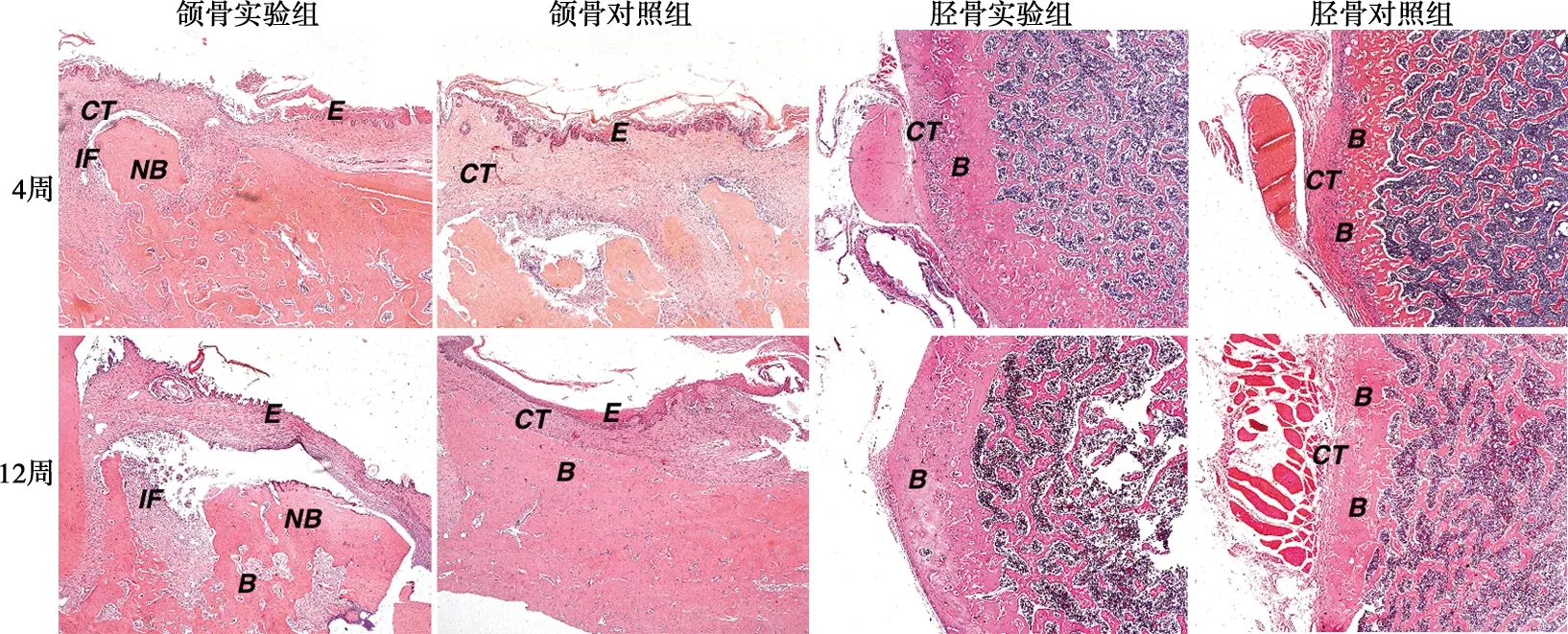
B:骨组织;NB:坏死骨;IF:炎性细胞浸润;CT:结缔组织;E:上皮
术后4周,实验组胫骨骨缺损都已愈合,骨创处骨皮质外围有增生的纤维结缔组织包绕。实验组骨皮质明显较对照组增厚,可见较多散在呈红色的新骨生成(如图5红色箭头示),新骨生成较对照组活跃。实验组松质骨内充盈着大量新生骨小梁,形态规则,排列紧密,而对照组骨松质内的骨小梁则较稀疏。术后12周,实验组胫骨缺损区骨皮质完整连续,较对照组厚且致密,骨改建已基本完成,而对照组中还可见少量红色新骨(如图5红色箭头示),骨改建速度较慢。
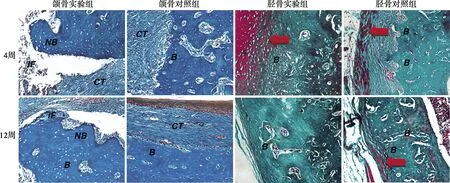
B:骨组织;NB:坏死骨;IF:炎性细胞浸润;CT:结缔组织;红色箭头所示红色区域为新生骨
2.3 细胞因子检测
RANKL和OPG表达结果如表2。术后4周和12周,实验组颌骨和胫骨OPG表达均较各对照组轻度上升,但差异无统计学意义。术后4周和12周,实验组颌骨RANKL表达较对照组轻度下降,但差异无统计学意义。实验组胫骨RANKL表达较对照组上升(P<0.05)。术后4周和12周,实验组颌骨RANKL/OPG比值较对照组明显下降(P<0.05),实验组胫骨RANKL/OPG比值较对照组明显上升(P<0.05)。
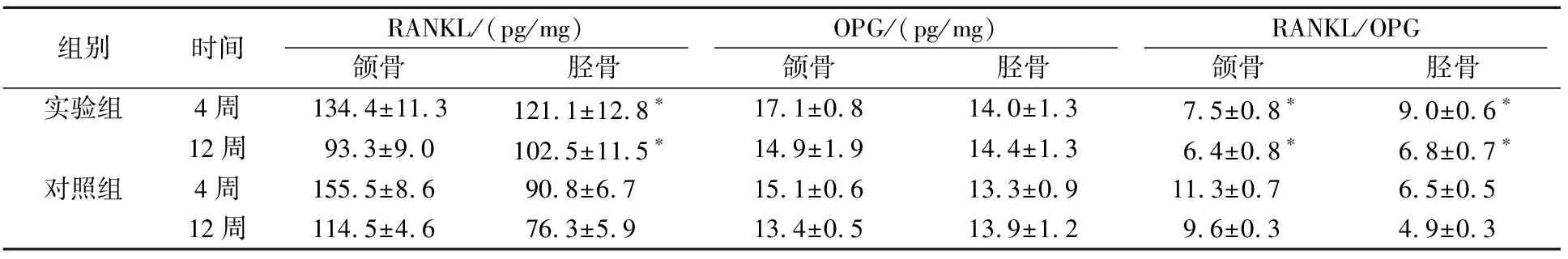
表2 RANKL、OPG表达和RANKL/OPG 含量比值
3 讨 论
唑来膦酸是第三代含氮杂环BPs,其咪唑侧链上含有2个氮原子,与骨组织中的羟基磷灰石亲和力高,可与骨组织牢固地结合,发挥抑制骨吸收作用,是目前临床上应用最为广泛、抗骨质吸收能力最强的BPs。本研究从骨组织位点特异性角度,应用第三代BPs代表药唑来膦酸对大鼠进行尾静脉注射,颌骨拔牙以及外周骨胫骨制备骨缺损,来研究唑来膦酸对大鼠颌骨和外周骨创伤后骨改建的影响。
本实验组织学染色显示,实验组拔牙创黏膜未愈合或延迟愈合,未愈合的黏膜下方可见骨面暴露、骨坏死,病变骨质中可见许多空的骨陷窝,而骨质出现不同程度的硬化,且周围伴有大量的炎性细胞浸润,为典型的BRONJ组织病理表现。对照组颌骨拔牙创4周内上皮组织已经完全覆盖创面,缺损区大量形态规则的骨小梁结构生成,进行了正常的生理性骨改建。实验组胫骨骨缺损在术后4周基本愈合,骨创处骨皮质厚且致密,松质骨内新生骨小梁密集,新骨生成活跃。而对照组骨皮质较薄,骨松质内骨小梁稀疏,新骨生成和骨改建速度较慢。可见,唑来膦酸对颌骨拔牙创伤后的骨改建起到明显的抑制作用,可以引起大鼠颌骨BRONJ样病变;而对外周骨胫骨骨创伤后的骨改建却起到一定的促进作用,可以较快地修复骨创伤,且未发生类似于颌骨骨坏死的现象。与目前文献报道的BPs引发骨组织坏死多发生于颌骨,未发生于外周骨的临床流行病学资料一致。
B:骨组织;NB:坏死骨;IF:炎性细胞浸润;CT:结缔组织
BPs引起的骨组织改变是全身性的,对骨组织影响广泛。病理结果显示,颌骨骨坏死均发生于拔牙窝附近,远端的骨质未涉及,且死骨周围多伴有大量的炎性细胞浸润,这一结果提示我们牙槽创伤是引发BRONJ的重要危险因素,而感染因素在BRONJ病程进展中亦起一定的作用。唑来膦酸对外周骨的作用,不仅对创伤处骨改建起一定促进作用,未发生类似颌骨坏死的现象,且还涉及非创伤处的远端骨质,骨皮质和骨松质都有一定程度的增生。
RANKL/RANK/OPG系统在调控骨吸收与骨生成动态平衡,保证正常的骨更新中起着重要作用[21]。RANKL主要位于成骨前体细胞表面,亦可表达于BMSCs等细胞的表面,可与破骨前体细胞和成熟破骨细胞表面表达的受体RANK结合,促进破骨前体细胞分化和成熟,并抑制破骨细胞凋亡,增强骨吸收。OPG表达于成骨前体细胞等的表面,可竞争性地与RANKL结合,阻断RANKL与破骨细胞表面RANK结合,抑制破骨前体细胞分化、成熟并诱导破骨细胞凋亡,从而抑制骨吸收。破骨细胞的数量和活性在RANKL/OPG比值上调时将增加,在比值下降时将降低。正常的骨重建和骨量的稳定依赖于RANKL和OPG的平衡。本实验中,实验组颌骨RANKL/OPG比值明显下降,而实验组胫骨RANKL/OPG比值明显上升。由此提示,唑来膦酸可通过调节成骨前体细胞表面RANKL/OPG等基因的表达来抑制破骨细胞的分化和功能,从而抑制创伤后骨表层破骨细胞的溶骨性活动。骨吸收和骨生成之间的平衡被破坏,致使拔牙窝周围骨重建过程受抑制,拔牙创经久不愈,引发颌骨坏死。而唑来膦酸对外周骨骨改建的影响恰好相反,RANKL/OPG比值上调,破骨细胞的溶骨性活动增强,在外周骨发生创伤后进行了活跃的骨改建,骨皮质较对照组厚且致密,骨松质新生骨小梁亦较对照组排列紧密。这可能是BRONJ常发生于颌骨而不是外周骨的重要原因之一。
