LncRNA HMGA1P4在肝细胞癌中的表达及其与miR-4436a调控关系的研究
2022-08-01张云石键
张云,石键
(南京医科大学附属淮安第一医院医学检验中心,江苏 淮安 223300)
肝细胞癌是最常见的恶性肿瘤之一,发病率在恶性肿瘤中排名第六,并且近年来发病率不断攀升[1],虽然治疗手段的发展使得患者的预后得到不断的改善,但是肝细胞癌被诊断时往往已经处于中晚期。肝脏具有双重血供系统,血液供应非常丰富,肿瘤极易发生侵袭和转移,患者的总体生存时间仍然处于较低的水平[2]。因此,探索和识别诱导肿瘤进展的关键分子并阐明其机制迫在眉睫。
长链非编码 RNA(long non-coding RNA,lncRNA)是一种不具有蛋白质编码能力的内源性RNA[3],最初被认为是“噪音”,但是lncRNA在细胞生物学行为中的重要功能越来越得到重视[4],最近的研究发现lncRNA有潜在翻译和生产小肽的功能。LncRNA的二级结构决定它能够通过与蛋白质结合、重组染色质或调节转录因子而发挥生物学功能[5],同时,lncRNA能够通过影响miRNA的转录、剪切和降解间接影响目的基因的表达。例如,通过在GEO和TCGA数据库中分析发现胃癌中高迁移率族蛋白A1假基因4( high mobility group A1-pseudogene 4,HMGA1P4)异常高表达[6],同时促进胃癌细胞对顺铂的耐药性[5],但是其在肝细胞癌中的表达和机制研究鲜有报道。因此,本研究通过检测HMGA1P4与miR-4436a在肝细胞癌组织中的表达并通过细胞实验分析两者的调控关系,探讨HMGA1P4对肝细胞癌发生发展的影响。
1 材料和方法
1.1 材料和试剂
收集2017年6月至2018年10月于本院行手术治疗的90例肝细胞癌患者,包括完整的临床病理参数、随访资料等,其中TNM Ⅰ期59例,TNM Ⅱ期23例,TNM Ⅲ期2例,TNM Ⅳ期6例,随访截止至2021年8月,死亡32例,患者术前均未接受任何治疗。本研究经本院医学伦理委员会批准,所有研究对象均签署知情同意书。4株肝细胞癌细胞系(HepG2、huh7、Hep3B、SMMC-7721)和1株正常肝脏上皮细胞(LO2)由上海复旦大学肝癌研究所提供;敲减HMGA1P4的3条干扰片段(si-HMGA1P4)由上海诺伦生物医药技术有限公司提供;miR-4436a模拟物/抑制物(miR-4436a mimics/inhibitor)、HMGA1P4野生型(WT)和突变型(MUT)双荧光素酶报告载体均由上海吉凯公司合成;双荧光素酶报告基因检测试剂盒购自美国Promega公司;所有引物购自上海生工生物工程有限公司。
1.2 方法
1.2.1 细胞培养 细胞在含有10%胎牛血清、1%青霉素、1%链霉素的DMEM中,置于37 ℃、5% CO2孵育箱中培养,取对数生长期的细胞用于实验。
1.2.2 实时荧光定量PCR检测HMGA1P4和miR-4436a的表达水平 使用RNeasy mini试剂盒提取细胞株中的总RNA并逆转录为cDNA,另外cDNA芯片同样也是将组织抽提后的总RNA逆转录为cDNA后铺于点阵上(由芯超公司完成)。使用qRT-PCR试剂在罗氏LightCycler 96仪器上检测细胞株和芯片中HMGA1P4和miR-4436a的表达水平。以GAPDH作为HMGA1P4的内参,U6作为miR-4436a的内参。所用引物:HMGA1P4上游5′-ATCTGCGGGGGTGCTTATTC-3′,下游5′-TTCCTGTACCCCAAAGGGGA-3′;GAPDH 上游5′-CGGAGTCAACGGATTTGGTCGTAT-3′,下游5′-AGCCTTCTCCATGGTGGTGAAGAC-3′;miR-4436a 上游5′-ACAG-UAGUCUGCACAUUGGUUA-3′,下游5′-GAATCTGCGAGAGACACCATC-3′;U6上游5′-CCATGCAGGTGAGCTTCGT-3′,下游5′-TTCACGAATTTGCGTGTCATC-3′。每个样本测得的HMGA1P4和miR-4436a经过标准化后,以2-△△Ct的形式表示相对表达量,以上测量重复3次,计算结果取平均数。
1.2.3 HepG2细胞迁移及侵袭实验 HepG2细胞使用si-HMGA1P4和miR-4436a 抑制物处理后,使用无血清的DMEM调整细胞密度约4×105~5×105个/mL,吸取300 μL悬液加入上层小室中(侵袭实验在迁移实验基础上多铺一层基质胶),将含有10% 胎牛血清的600 μL培养液加入下层小室;孵育24~48 h,将未通过筛孔的细胞拭去,将通过筛孔的细胞使用4%多聚甲醛固定后进行清洗,结晶紫染色后在普通光学显微镜下拍照并进行统计分析。
1.2.4 细胞转染和双荧光素酶报告实验 取对数生长期HepG2细胞并用含10%胎牛血清的DMEM制备成单细胞悬液,均匀地接种于6孔板中,放置于37 ℃、5% CO2的孵育箱中孵育24 h,待细胞密度达到80%左右,按照说明书进行转染操作。敲减HMGA1P4所用寡核苷酸序列:si-HMGA1P4-1#为5′-TTGGAGACAGACGGAAGTGTTTGGA-3′,si-HMGA1P4-2#为5′-GAGCTTGGAGACAGACGGAAGTGTT-3′,si-HMGA1P4-3#为5′-GACAGACGGAAGTGTTTGGATTGTG-3′,阴性对照为5′-TTCTCCGAACGTGTCACGTAA-3′。配置A液:将5 μL 干扰片段或5 μL 阴性对照加入250 μL的基础培养基中,混匀静置5 min;B液:将5 μL Lipofectamine 2000加入250 μL的基础培养基中,混匀静置5 min,将A液和B液混合后静置20 min,缓慢加入6孔板中,继续放置37 ℃、5% CO2的培养箱中培养。使用Starbase 2.0(http://starbase.sysu.edu.cn/)以及生物信息学数据库验证HMGA1P4与miR-4436a的潜在结合位点。使用Lipofectamine 2000将HMGA1P4双荧光素酶报告载体或阴性对照与miR-4436a mimics/inhibitor共转染至肝细胞癌HepG2细胞中,48 h后测定各组荧光素酶活性。
1.3 统计学处理
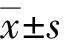
2 结果
2.1 肝细胞癌组织中HMGA1P4的相对表达水平与患者临床病理参数间的关系
肝细胞癌组织中HMGA1P4的相对表达中位数为3.67(2.79,4.70),明显高于癌旁组织的0.04(0.04,0.05),Wilcoxon秩和检验显示差异具有统计学意义(Z=9.171,P<0.001)。肝细胞癌组织中HMGA1P4相对表达水平越高,T分期越高,肿瘤包膜越不完整,肿瘤细胞越倾向于淋巴结转移、远处转移,TNM分期、血清γ-谷氨酰转肽酶(γ-GGT)水平越高,越倾向于复发,同时细胞程序性死亡配体1(PD-L1)、表皮生长因子受体(EGFR)和细胞毒T淋巴细胞抗原4(CTLA-4)表达越高(P均<0.05);而与性别、年龄、肿瘤数目、肝硬化结节个数、肝硬化状况、HBsAg状态以及血清甲胎蛋白水平无关(P均>0.05),见表1。
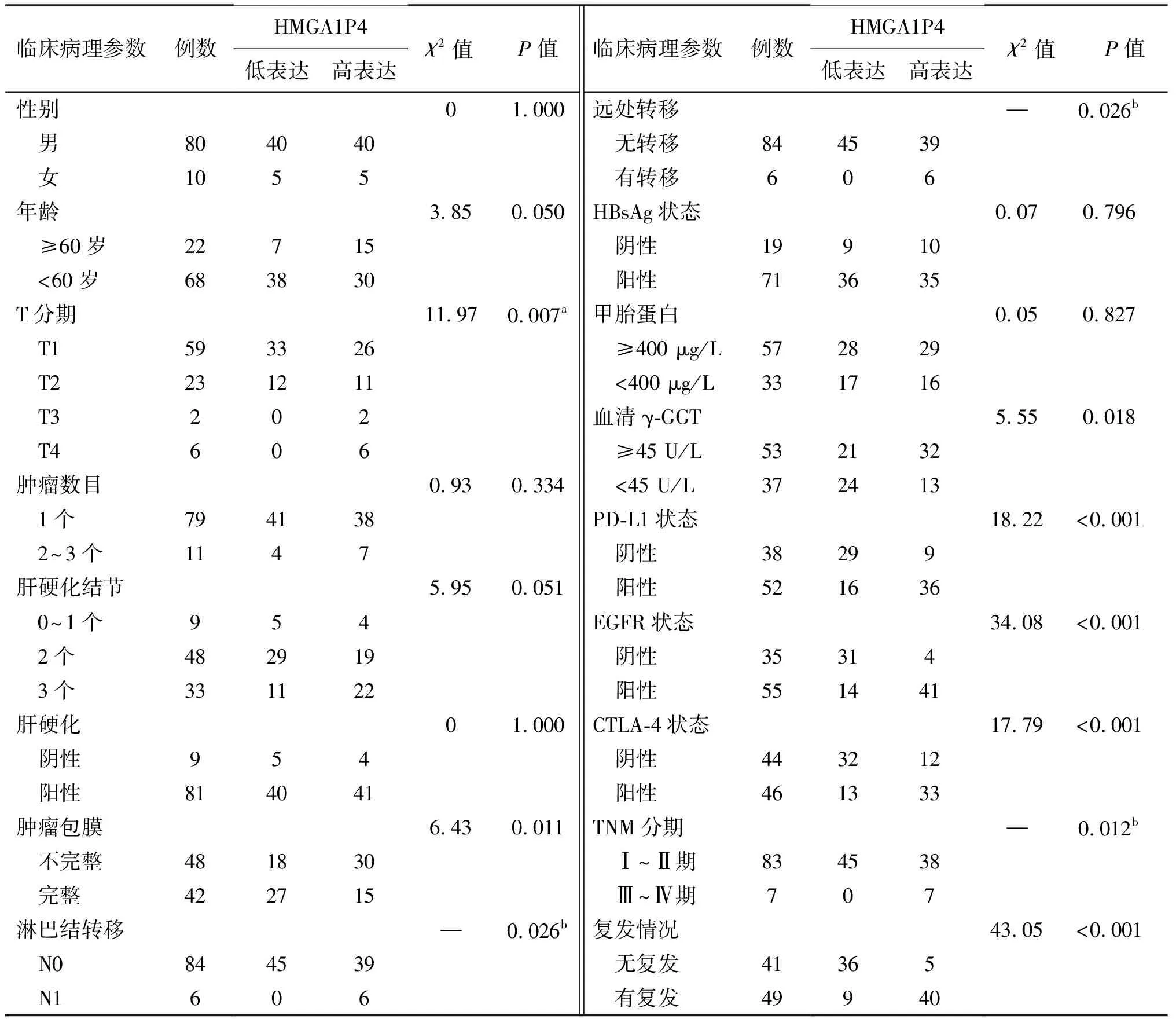
表1 肝细胞癌组织中HMGA1P4的相对表达水平与患者临床病理参数间的关系 例
2.2 HMGA1P4的相对表达水平与肝细胞癌患者预后间的关系
对TNM Ⅰ~Ⅳ期、Ⅰ期、Ⅱ期的肝细胞癌患者分别进行生存分析,HMGA1P4高表达组患者总体生存率均明显低于低表达组,差异具有统计学意义(χ2分别为36.28、16.77、14.31,P均<0.05),见图1A~1C;同时HMGA1P4高表达组患者无复发生存率均明显低于低表达组,差异具有统计学意义(χ2分别为65.95、35.53、23.58,P均<0.05),见图1D~1F。经Cox比例风险模型分析,淋巴结转移、远处转移、TNM分期、复发和HMGA1P4的高表达对肝细胞癌患者生存时间的影响均有统计学意义(HR分别为2.652、4.513、6.913、4.764、16.381,P均<0.05),见表2。
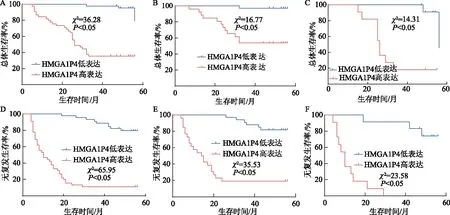
A、D:分别评估90例TNM Ⅰ~Ⅳ期肝细胞癌患者的总体生存率和无复发生存率;B、E:分别评估59例TNMⅠ期患者的总体生存率和无复发生存率;C、F:分别评估23例TNMⅡ期患者的总体生存率和无复发生存率
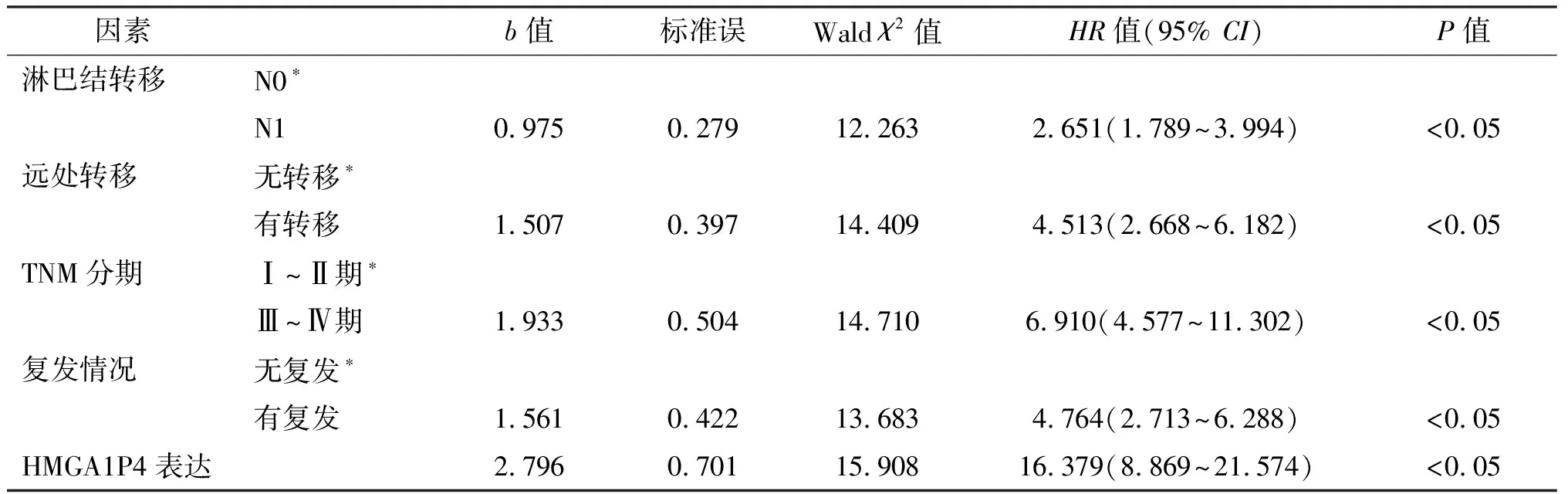
表2 影响肝细胞癌患者生存时间的Cox回归分析
2.3 HMGA1P4在肝癌细胞中的表达及敲减效率的验证
对4株肝细胞癌细胞系(HepG2、huh7、Hep3B、SMMC-7721)以及人正常肝脏细胞系LO2中HMGA1P4表达进行检测,结果发现4株肝细胞癌细胞系中HMGA1P4相对表达量分别为6.30±0.20、2.02±0.08、1.27±0.15、2.70±0.20,其中HepG2、huh7、SMMC-7721细胞高于人正常肝脏细胞系LO2(1.00±0.20),差异均有统计学意义(P均<0.01),Hep3B与LO2细胞之间无明显差异(P>0.05)。选取HepG2转染3个干扰片段用以敲减HMGA1P4,其中siRNA-2#效果最显著(P<0.001),见图2。
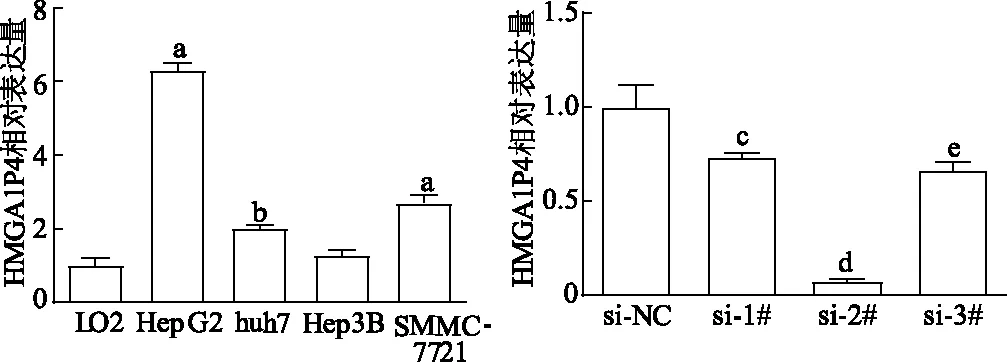
a:P<0.001,b:P<0.01,与LO2细胞比较;c:P<0.05,d:P<0.001,e:P<0.01,与si-NC比较
2.4 下调miR-4436a能够逆转HMGA1P4沉默对肝细胞癌细胞迁移和侵袭的抑制
选择siRNA-2#转染的细胞进行后续迁移、侵袭实验,Transwell实验结果显示,与阴性对照组相比,转染si-HMGA1P4能够明显抑制HepG2细胞的迁移和侵袭能力(P<0.001)。联合转染si-HMGA1P4和miR-4436a抑制物后发现,与单独转染si-HMGA1P4相比,联合转染组HepG2细胞的迁移和侵袭能力得到恢复(P<0.001)。结果表明,下调miR-4436a能够逆转敲减HMGA1P4对肝细胞癌细胞迁移和侵袭的抑制作用(图3)。
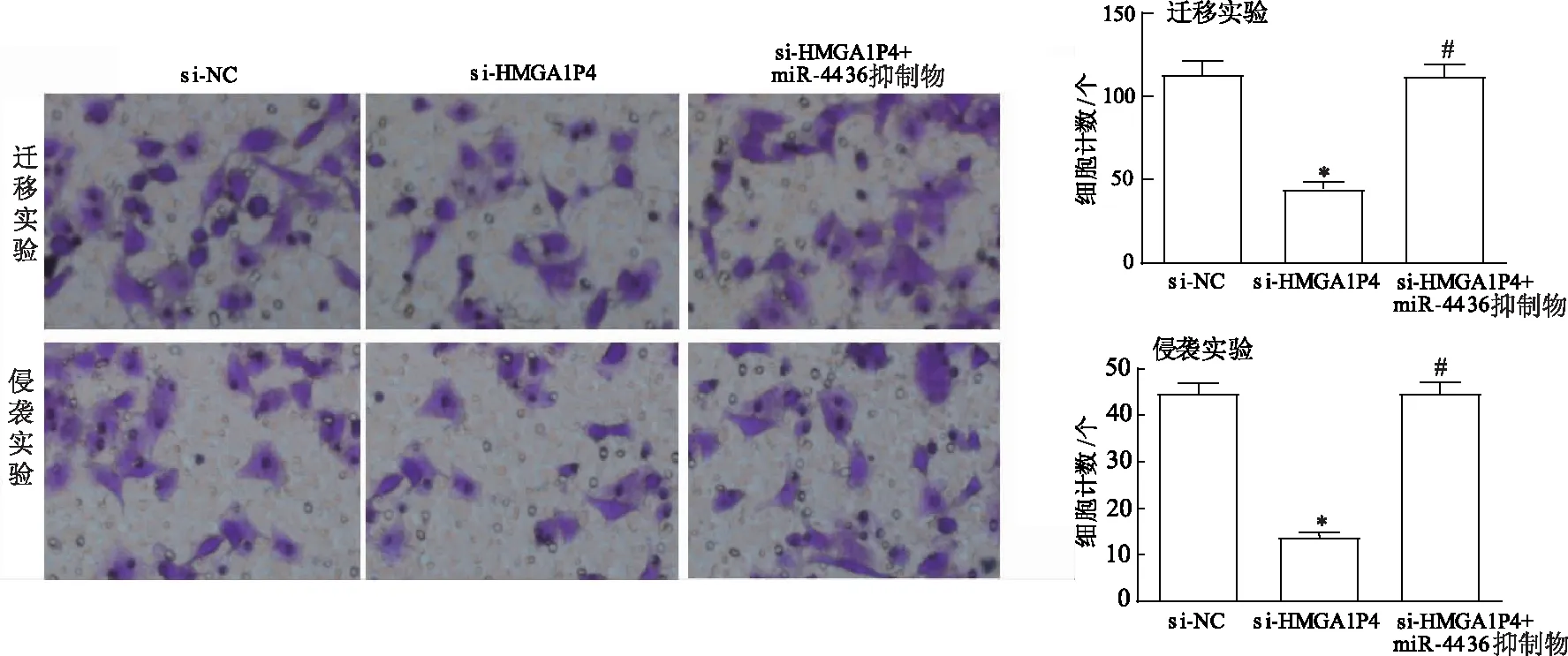
*:P<0.001,与si-NC比较;#:P<0.001,与si-HMGA1P4比较
2.5 HMGA1P4在肝细胞癌细胞中可能调控miR-4436a的表达
使用人类miRNA靶标预测工具Starbase 2.0数据库,预测HMGA1P4可能是miR-4436a的靶标,预测结合位点见图4A。qRT-PCR结果显示,肝细胞癌组织中miR-4436a的相对表达中位数为2.06(2.00,2.12),低于癌旁组织的3.04(2.98,3.07),Wilcoxon秩和检验显示差异具有统计学意义(Z=6.852,P<0.001)。转染si-HMGA1P4干扰片段后,HepG2细胞miR-4436a表达水平明显升高(图4B)。此外,使用双荧光素酶报告实验进一步验证HMGA1P4和miR-4436a之间是否存在结合位点,构建与miR-4436a具有结合位点的HMGA1P4-WT和-MUT双荧光素酶报告质粒(图4C)。“microRNA与lncRNA结合验证”结果发现,与阴性对照组相比,共转染miR-4436a模拟物能够抑制HMGA1P4-WT表达载体的荧光素酶活性,但HMGA1P4-MUT表达载体的荧光素酶活性没有变化(图4D)。
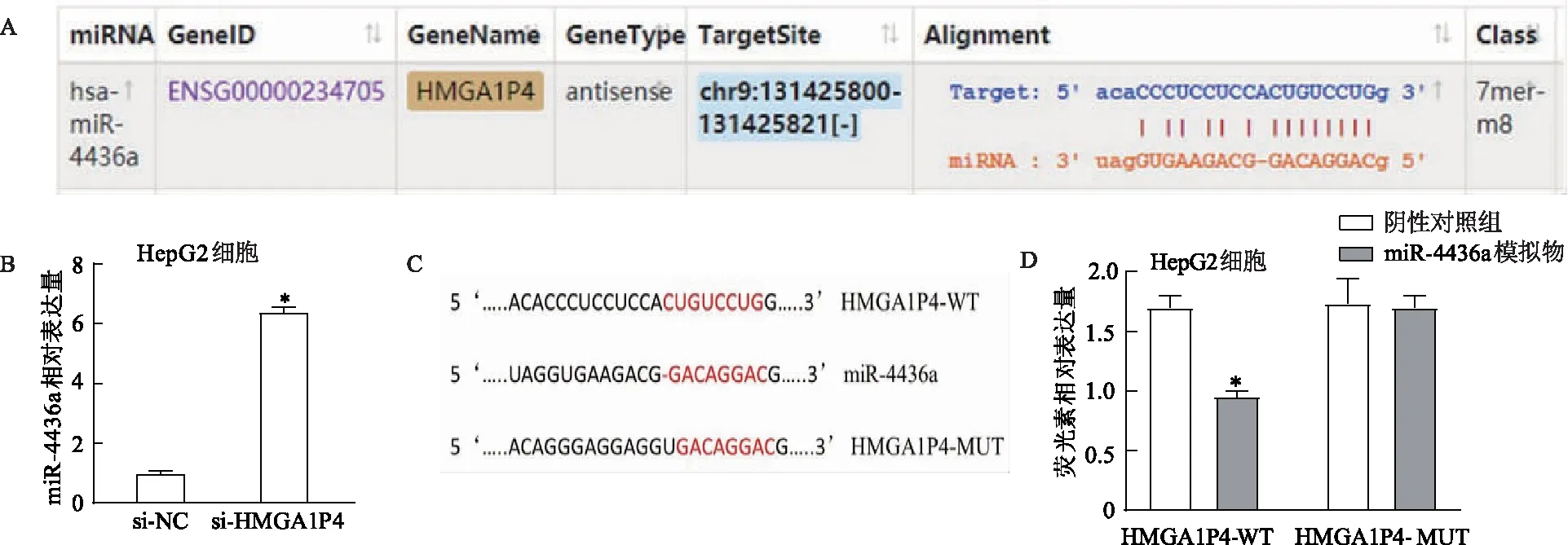
A:通过生物信息学数据库对HMGA1P4和miR-4436a的结合位点进行预测;B:下调HMGA1P4后miR-4436a的表达水平变化;C:HMGA1P4-WT和-MUT双荧光素酶报告质粒的构建;D:共转染miR-4436a模拟物和HMGA1P4-WT或-MUT双荧光素酶报告质粒后荧光素酶活性变化。*:P<0.001,与阴性对照组比较
3讨论
肝细胞癌是目前世界上最常见的恶性肿瘤之一,具有快速生长的特点,具有高度侵袭性和转移性。因此,阐明肝细胞癌发生发展的分子机制至关重要。近期许多研究报道lncRNA通过多种方式参与肿瘤的发生发展过程[7-8]。本研究结果表明,HMGA1P4在肝细胞癌组织和细胞系中的表达明显升高,表明HMGA1P4可能参与了肝细胞癌的发生,其高表达可能促进正常肝上皮细胞异常增殖,进而形成肿瘤。单因素分析也证实,与HMGA1P4低表达患者相比,HMGA1P4高表达者的肿瘤T分期越高,同时血清γ-GGT水平越高,γ-GGT升高往往因为胆汁淤积造成,与肿瘤生长压迫胆管密不可分。以上结果提示HMGA1P4可能具有促进肝细胞癌细胞增殖的能力。肝细胞癌细胞发生转移一般先突破包膜,然后侵袭基底膜,突破基底膜后侵犯淋巴系统或者血液系统,进而远处播散[9]。肿瘤细胞是否发生淋巴结转移或者血管浸润对预后的判断十分重要。因此,肝细胞癌手术治疗往往在切除原发灶之外再进行周围淋巴结清扫。本组病例中,与HMGA1P4低表达者相比,HMGA1P4高表达者包膜越不完整,肿瘤细胞越倾向于淋巴结转移和远处转移;体外迁移和侵袭实验也证实HMGA1P4能促进肝细胞癌细胞的迁移和侵袭。以上证据提示HMGA1P4可能有促进肝细胞癌发生局部侵袭及远处转移的作用,但是需要进一步的动物实验佐证。同时HMGA1P4与患者TNM分期及复发也有关,TNM分期和复发是肿瘤进展的重要指标,TNM分期越高,患者预后往往不佳,治疗后肿瘤复发往往会导致患者的生存期大幅缩短,对患者的预后产生十分不利的影响[10]。以上结果提示HMGA1P4与肝细胞癌的发展密切相关。
本研究结果提示HMGA1P4的表达与PD-L1和EGFR明显相关。PD-L1属于重要的免疫抑制分子,是肿瘤逃脱免疫监视和清除的重要分子[11],PD-L1单抗可以有效解除肿瘤细胞对免疫细胞的免疫抑制作用。EGFR是一种受体型酪氨酸激酶,在多种肿瘤中过表达和(或)发生突变,通过信号转导控制肿瘤生长,并与新生血管生成、肿瘤的侵袭和转移等有密切的关系[12]。目前医药公司研究出了EGFR 酪氨酸激酶抑制剂,在多种肿瘤中显示出了很好的抗癌效果[13-14]。我们推测HMGA1P4可能通过促进PD-L1过表达和EGFR突变促进肝细胞癌发生发展,但是该推论需要进一步的机制研究支持。
本研究针对不同TNM分期的肝细胞癌患者分析发现,HMGA1P4高表达者的总体生存率和无复发生存率均明显低于低表达者,同时多因素回归分析也佐证肝细胞癌组织中HMGA1P4的高表达是促进患者不良预后的独立危险因素。综合以上结果提示HMGA1P4可以有效预测早中期(TNM Ⅰ~Ⅱ期)肝细胞癌患者的预后,其高表达提示肝细胞癌患者预后不良,但是由于中晚期(TNM Ⅲ~Ⅳ期)肝细胞癌患者例数太少,无法单独进行统计分析,今后研究会进一步纳入TNM Ⅲ期和Ⅳ期患者,分析HMGA1P4与中晚期患者的相关性。
miRNAs是一类约22个核苷酸大小的非编码RNA,通过结合mRNA调控其表达。本实验通过数据库分析发现HMGA1P4与miR-4436a存在互补序列,且miR-4436a在肝细胞癌组织中表达水平明显下调;在HepG2细胞系中敲减HMGA1P4后引起miR-4436a的上调,表明两者之间可能存在某种调控关系。Transwell实验结果表明HMGA1P4可能通过调控miR-4436a进而促进肝细胞癌细胞的迁移和侵袭能力,此外,双荧光素酶报告实验初步预测HMGA1P4和miR-4436a可能存在结合位点,需要进一步实验验证。
综上所述,HMGA1P4与肝细胞癌转移、TNM分期、复发以及预后密切相关,参与了肝细胞癌的发生发展,并且可能通过抑制miR-4436a促进肝细胞癌的侵袭和迁移,有望成为肝细胞癌患者潜在的预后标志物以及分子治疗靶点。
