桑枝调控HIF-1α/VEGF/MMPs 信号通路改善佐剂性关节炎大鼠骨破坏的研究
2022-07-30胡清桥余黄合
邓 庆,贺 飞,胡清桥,余黄合*,黄 娟*
(1.湖南中医药大学医学院,湖南 长沙 410208;2.湖南中医药大学药学院,湖南 长沙 410208)
类风湿关节炎(rheumatoid arthritis, RA)是一种以关节滑膜组织慢性炎症为主要表现的自身免疫性疾病[1],其基本病理改变为慢性关节滑膜炎症、血管翳新生,最终导致关节软骨和骨破坏,引起关节畸形和功能丧失,使肢体残疾,严重影响患者生活质量[2]。
RA 的发病机制复杂,研究发现,HIF-1α/VEGF/MMPs 信号通路在RA 骨破坏进程中有着重要作用[3]。低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)属于核因子,其在缺氧状态下,表达量显著增多,并发生核转位,与HIF-1β 聚合后形成的聚合物,可继续与下游因子血管内皮生长因子(vascular endothelial growth factor, VEGF) 的缺氧反应元件结合,上调VEGF 表达[4]。 VEGF 是一种强有力的促血管生成因子,能促进滑膜血管新生、血管翳形成,还能影响基质金属蛋白酶(matrix metalloproteinases, MMPs)的表达[5-6]。MMPs 在软骨及骨骼发生损伤的过程中起关键作用, 它可分解软骨和骨中的胶原、蛋白多糖及降解细胞外基质,刺激血管翳侵袭软骨,造成韧带、软骨和骨质的损伤。此外,它还能调控滑膜细胞诱导血管新生[7]。因此,抑制HIF-1α/VEGF/MMPs 信号通路可抑制血管新生,减轻骨损伤,进而延缓RA 疾病进程。
目前,在临床上缺乏治疗RA 的理想方法,中医古籍中记载桑枝具有“祛风湿,利关节”的功效,现代研究中发现,桑枝具有较高的镇痛和抗炎活性及降血脂、降血糖的作用,常用于治疗RA[8],同时桑枝水提物可促进免疫器官发育,增强细胞免疫和体液免疫[9]。 本研究拟从HIF-1α/VEGF/MMPs 信号通路方面探讨桑枝对佐剂性关节炎(adjuvant-induced arthritis, AIA)大鼠骨破坏的治疗作用及机制,为研究RA 治疗药物提供新的思路。
1 材料
1.1 动物
SPF 级雄性SD 大鼠30 只,体质量240~260 g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号为SCXK(湘)2019-0004,动物合格证号为430727211101621523。 饲养于湖南中医药大学实验动物中心,湿度45%~65%,室温25 ℃,自由饮水、摄食,适宜性喂养7 d 后开始实验。
1.2 药物
桑枝饮片(批号:2101080022)、雷公藤多苷片(批号:Z43020138)均购自湖南中医药大学第一附属医院。 桑枝饮片以4 倍量水回流提取2 次,每次1 h;桑枝水提物低剂量、高剂量分别浓缩干燥至3、9 g/mL。 雷公藤多苷片取50 mg,精密称量,置于研钵中研磨粉碎,加至500 mL 温水中,充分溶解,得1 mg/mL 悬浊液。
1.3 试剂
完全弗氏佐剂(complete Freund's adjuvant, CFA,美国Chondrex 公司,批号:210309);苏木素染色液(批号:WH1144)、伊红染色液(批号:WH2144)、枸橼酸盐缓冲液(批号:WH2007)均购自上海威奥生物科技有限公司;4%多聚甲醛溶液(北京白鲨易生物科技有限公司;批号:BL539A);0.9%氯化钠溶液(湖南科伦制药有限公司,批号:2104211);兔二步法免疫组化试剂盒(批号:PV-9000)、DAB 试剂盒(批号:ZLI-9018)均购自北京中杉金桥生物技术有限公司;PBST 缓冲液(批号:AWI0130)、RIPA 裂解液(批号:AWB0136)均购自长沙艾碧维生物科技有限公司;HIF-1α 多克隆抗体(批号:ab72777)、基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)多克隆抗体(批号:ab38898)均购自英国Abcam公司;VEGF 多克隆抗体(批号:13687-1-AP)、基质金属蛋白酶-3(matrix metalloproteinase-3, MMP-3)多克隆抗体(批号:66338-1-Ig)、β-actin 多克隆抗体(批号:66009-1-Ig)均购自美国Proteintech 公司。
1.4 仪器
高分辨率小动物微型CT(美国PerkinElmer-Caliper LS 公司,型号:Quantum FX Demo);化学发光成像系统(上海勤翔科学仪器有限公司,型号:ChemiScope6100);转膜仪(型号:DYCZ-40D)、恒温箱(型号:DYY-6C)均购自北京六一生物科技有限公司;台式冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R)。
2 方法
2.1 动物分组、造模及给药
雄性SD 大鼠30 只,采用随机数表法分为正常组、模型组、阳性药组、桑枝水提物低剂量组、桑枝水提物高剂量组,每组6 只。 参照文献[10]构建AIA 大鼠模型,除正常组外,于其右后足跖底部常规皮肤消毒,取100 μL 浓度为10 g/L 的CFA 注射建立模型。注射CFA 后,大鼠右后足红肿、局部皮肤温度升高、活动障碍,提示建模成功。自建模后1 d 起,正常组、模型组灌服10 mL/kg 0.9%氯化钠溶液,阳性药组灌服10 mg/kg 雷公藤多苷片悬浊液,桑枝水提物低剂量组、桑枝水提物高剂量组分别灌服3、9 g/kg桑枝水提物,每天1 次,连续30 d。
2.2 动物体质量及足趾肿胀度测定
造模前(第0 天)以及造模后每3 天称量,并利用大鼠足跖容积测量装置[11]精准测量大鼠右后足足趾容积并进行关节炎指数计算,测量3 次取平均值,求出足趾肿胀度,足趾肿胀度=(致炎后足容积-致炎前足容积)/致炎前足容积×100%。 关节炎指数评分标准[12]:0 分为未见红肿;1 分为小趾关节见红胀;2分为小趾关节和足趾均肿胀;3 分为踝关节以下足趾肿胀;4 分为包括踝关节在内全部足趾肿胀,且负重困难。
2.3 大鼠足骨放射学观察与骨破坏评分
使用小动物CT 观察大鼠右后足并评价其骨质破坏的严重程度。 骨破坏评分标准[13]:0 分为正常;1分为轻度改变;2 分为中度程度改变;3 分为重度改变;4 分为极重度改变。
2.4 大鼠踝关节病理学检查与组织学评分
大鼠处死后,取右踝关节,用10%中性甲醛固定,5%硝酸脱钙,直至关节软化,不同浓度乙醇梯度脱水,用石蜡包埋、切片,HE 染色,中性树胶封片,在光学显微镜下检查是否有炎细胞浸润、滑膜细胞异常增殖、关节间隙变窄和骨侵蚀等现象并评分、采集图像。 组织学评分标准[14]:0 分为正常关节,无炎性细胞浸润,无血管翳形成,无骨破坏;1 分为炎性细胞浸润或轻微水肿,少量血管翳形成,骨轻度破坏;2 分为炎性细胞中等浸润,大量血管翳形成,骨中度破坏;3 分为炎性细胞严重浸润,关节腔狭窄;4分为血管翳形成,骨重度破坏。
2.5 大鼠踝关节免疫组化检查
切片置于60 ℃温箱烤片12 h,再转至二甲苯中20 min,进行3 次脱蜡,不同浓度乙醇梯度脱水后,将切片浸入枸橼酸盐缓冲液,微波炉加热至沸腾后断电,进行热修复抗原。 加入1%高碘酸以灭活内源性酶。滴加1∶200 的一抗于4 ℃冰箱中孵育过夜,继续滴加50~100 μL 二抗于37 ℃孵育30 min。 DAB染色,苏木素复染,不同浓度乙醇梯度脱水后,置于二甲苯中,中性树胶封片。 每张切片随机观察5 个视野并采集图像,再输入计算机图像分析系统进行图像分析,得出阳性细胞的平均光密度,并计算均值。
2.6 Western blot 检测大鼠关节滑膜HIF-1α、VEGF、MMP-3、MMP-9 蛋白的表达
分离取出大鼠右后肢膝关节滑膜,用预冷的PBS 洗涤1 次后,加入RIPA 裂解液,以4 ℃,离心半径7 cm,12 000 r/min 离心15 min,取上清液,制备10%分离胶、4.8%浓缩胶,取待测蛋白样本20 μL进行凝胶电泳,转膜、封闭,4 ℃过夜,次日室温放置30 min 后,加入兔抗大鼠HIF-1α 一抗(1∶500)、兔抗大鼠VEGF 一抗(1∶500)、小鼠抗大鼠MMP-3 一抗(1∶5000)、兔抗大鼠MMP-9 一抗(1∶1000)和小鼠抗大鼠β-actin 一抗(1∶5000)孵育90 min,使用PBST 洗3 次,分别加入山羊抗小鼠二抗(1∶5000)和山羊抗兔二抗(1∶6000)孵育90 min,结束后使用PBST 洗3 次,使用ECL 化学发光液与膜孵育1 min,用滤纸吸尽液体,塑封膜将膜包裹杂交膜,放入凝胶成像系统中成像。 将曝光后的底片用Quantity One专业灰度分析软件进行分析。
2.7 统计学分析
所有数据均使用SPSS 24.0 和GraphPad Prism 7.0 软件进行统计分析。计量资料采用“±s”表示,满足正态性和方差齐性后,采用单因素方差分析进行多组间比较,两组间比较采用t 检验。 以P<0.05 为差异有统计学意义。
3 结果
3.1 桑枝水提物对AIA 大鼠体质量变化的影响
从第6 天起,模型组体质量均显著低于正常组(P<0.05,P<0.01)。 从第21 天起,阳性药组、桑枝水提物低剂量组体质量均显著高于模型组(P<0.01)。从第18 天起,桑枝水提物高剂量组体质量均显著高于模型组(P<0.01)。 第30 天,桑枝水提物高剂量组体质量显著低于桑枝水提物低剂量组(P<0.05)。 详见表1。
表1 各组大鼠体质量比较(±s,n=6,g)
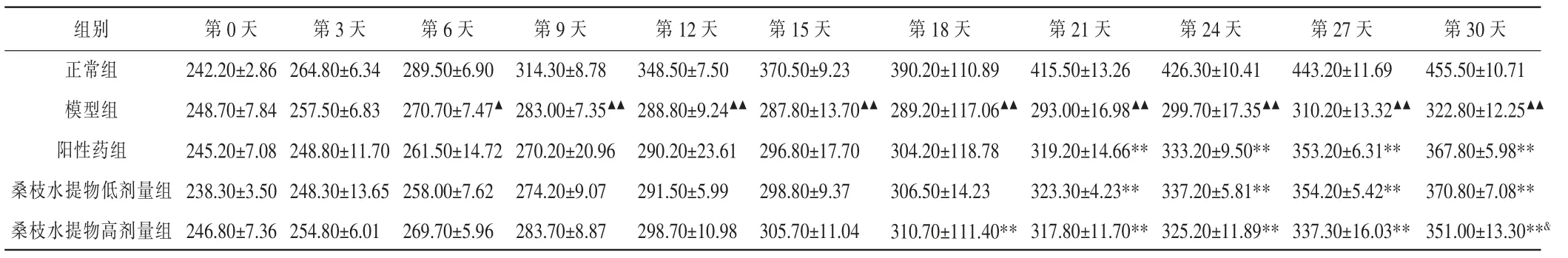
表1 各组大鼠体质量比较(±s,n=6,g)
注:与正常组比较,▲P<0.05,▲▲P<0.01;与模型组比较,**P<0.01;与桑枝水提物低剂量组比较,&P<0.05。
组别正常组模型组阳性药组桑枝水提物低剂量组桑枝水提物高剂量组第0 天242.20±2.86 248.70±7.84 245.20±7.08 238.30±3.50 246.80±7.36第3 天264.80±6.34 257.50±6.83 248.80±11.70 248.30±13.65 254.80±6.01第6 天289.50±6.90 270.70±7.47▲261.50±14.72 258.00±7.62 269.70±5.96第9 天314.30±8.78 283.00±7.35▲▲270.20±20.96 274.20±9.07 283.70±8.87第12 天348.50±7.50 288.80±9.24▲▲290.20±23.61 291.50±5.99 298.70±10.98第15 天370.50±9.23 287.80±13.70▲▲296.80±17.70 298.80±9.37 305.70±11.04第18 天390.20±110.89 289.20±117.06▲▲304.20±118.78 306.50±14.23 310.70±111.40**第21 天415.50±13.26 293.00±16.98▲▲319.20±14.66**323.30±4.23**317.80±11.70**第24 天426.30±10.41 299.70±17.35▲▲333.20±9.50**337.20±5.81**325.20±11.89**第27 天443.20±11.69 310.20±13.32▲▲353.20±6.31**354.20±5.42**337.30±16.03**第30 天455.50±10.71 322.80±12.25▲▲367.80±5.98**370.80±7.08**351.00±13.30**&
3.2 桑枝水提物对AIA 大鼠足趾肿胀度的影响
从第3 天起,模型组足趾肿胀度及关节炎指数均显著高于正常组(P<0.01)。 从第6 天起, 阳性药组、桑枝水提物低剂量组足趾肿胀度均显著低于模型组(P<0.01)。 第6 天、第15~30 天,桑枝水提物高剂量组足趾肿胀度均显著低于模型组(P<0.05,P<0.01)。从第6 天起, 桑枝水提物高剂量组足趾肿胀度均显著高于阳性药组(P<0.01)。 第6~9 天、第15~30 天,桑枝水提物高剂量组足趾肿胀度显著高于桑枝水提物低剂量组(P<0.01)。 第12~30 天的阳性药组、第15~30 天的桑枝水提物低剂量组、第21~27 天的桑枝水提物高剂量组关节炎指数均显著低于模型组(P<0.01)。第12~24 天,桑枝水提物高剂量组关节炎指数均显著高于阳性药组(P<0.01)。第15~24 天,桑枝水提物高剂量组关节炎指数均显著高于桑枝水提物低剂量组(P<0.01)。 详见表2-3。
表2 各组大鼠足趾肿胀度比较(±s,n=6)

表2 各组大鼠足趾肿胀度比较(±s,n=6)
注:与正常组比较,▲▲P<0.01;与模型组比较,*P<0.05,**P<0.01;与阳性药组比较,##P<0.01;与桑枝水提物低剂量组比较,&&P<0.01。
组别正常组模型组阳性药组桑枝水提物低剂量组桑枝水提物高剂量组第0 天0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00第3 天0.02±0.01 1.38±0.07▲▲1.45±0.04 1.42±0.06 1.46±0.06第6 天0.05±0.01 1.88±0.08▲▲1.51±0.05**1.47±0.10**1.78±0.08*##&&第9 天0.07±0.01 1.50±0.06▲▲1.34±0.04**1.38±0.11**1.50±0.07##&&第12 天0.09±0.01 1.61±0.05▲▲1.40±0.09**1.44±0.11**1.53±0.05##第15 天0.11±0.01 1.76±0.03▲▲1.45±0.09**1.45±0.09**1.61±0.05**##&&第18 天0.13±0.02 1.88±0.04▲▲1.37±0.09**1.38±0.07**1.67±0.06**##&&第21 天0.15±0.02 2.07±0.05▲▲1.30±0.07**1.32±0.06**1.59±0.06**##&&第24 天0.16±0.01 2.01±0.04▲▲1.23±0.09**1.24±0.07**1.42±0.05**##&&第27 天0.18±0.01 1.86±0.06▲▲1.14±0.08**1.14±0.07**1.35±0.08**##&&第30 天0.20±0.02 1.66±0.06▲▲1.05±0.05**1.00±0.08**1.30±0.07**##&&
3.3 桑枝水提物对AIA 大鼠足关节骨破坏的影响
模型组关节肿胀明显、关节僵硬强直、功能障碍、活动明显受限,各足趾关节及踝关节处明显有骨质侵袭、骨破坏严重、关节间隙狭窄明显、关节变形、关节结构破坏严重。 桑枝水提物低剂量组和高剂量组骨质侵袭、关节间隙狭窄均有所改善。模型组骨破坏评分显著高于正常组(P<0.01)。阳性药组、桑枝水提物低剂量组、桑枝水提物高剂量组骨破坏评分均显著低于模型组(P<0.01)。 桑枝水提物高剂量骨破坏评分均显著高于阳性药组、 桑枝水提物低剂量(P<0.05)。 详见图1-2。
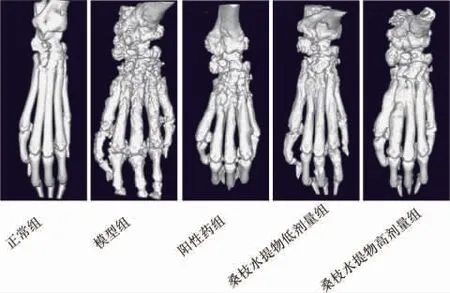
图1 各组大鼠足骨CT 图片
表3 各组大鼠足趾关节炎指数比较(±s,n=6)

表3 各组大鼠足趾关节炎指数比较(±s,n=6)
注:与正常组比较,▲▲P<0.01;与模型组比较,**P<0.01;与阳性药组比较,##P<0.01;与桑枝水提物低剂量组比较,&&P<0.01。
组别正常组模型组阳性药组桑枝水提物低剂量组桑枝水提物高剂量组第0 天0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00第3 天0.00±0.00 3.33±0.82▲▲3.33±0.52 3.33±0.52 3.33±0.52第6 天0.00±0.00 4.00±0.00▲▲3.67±0.52 3.67±0.52 3.67±0.52第9 天0.00±0.00 3.67±0.52▲▲3.17±0.75 3.17±0.75 3.33±0.52第12 天0.00±0.00 3.17±0.41▲▲2.17±0.41**2.50±0.55 3.17±0.41##第15 天0.00±0.00 3.67±0.52▲▲2.50±0.55**2.17±0.41**3.50±0.55##&&第18 天0.00±0.00 3.83±0.41▲▲2.00±0.63**1.83±0.41**3.50±0.55##&&第21 天0.00±0.00 3.83±0.41▲▲1.67±0.52**1.83±0.41**2.83±0.41**##&&第24 天0.00±0.00 3.33±0.52▲▲1.17±0.41**1.50±0.55**2.50±0.55**##&&第27 天0.00±0.00 2.67±0.52▲▲1.17±0.41**1.33±0.52**1.83±0.41**第30 天0.00±0.00 2.33±0.52▲▲1.17±0.41**1.33±0.52**1.83±0.41
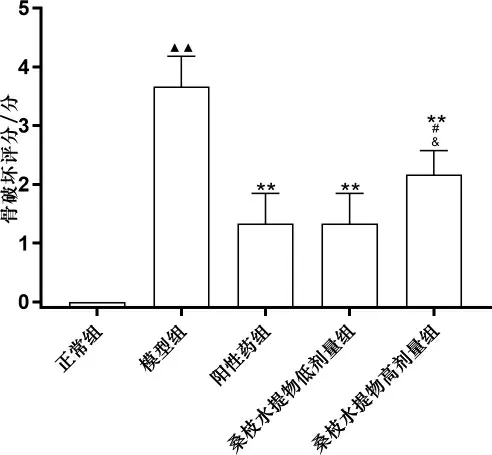
图2 各组大鼠足骨骨破坏评分比较(±s,n=6)
3.4 桑枝水提物对AIA 大鼠踝关节组织病理学改变的影响
模型组大量炎症细胞浸润,滑膜重度增生,突入关节腔内,关节间隙明显变窄,广泛的血管翳形成,骨质侵袭严重。 阳性药组与桑枝水提物低剂量组关节腔内少量炎症细胞浸润,少量滑膜增生;桑枝水提物高剂量组炎症细胞浸润中等量,滑膜中度增生,突入关节腔,关节间隙变窄。 模型组组织学评分显著高于正常组(P<0.01)。阳性药组、桑枝水提物低剂量组、桑枝水提物高剂量组组织学评分均显著低于模型组(P<0.01)。 桑枝水提物高剂量组组织学评分显著高于阳性药组、桑枝水提物低剂量组(P<0.05,P<0.01)。 详见图3-4。

图3 各组大鼠踝关节组织HE 染色结果
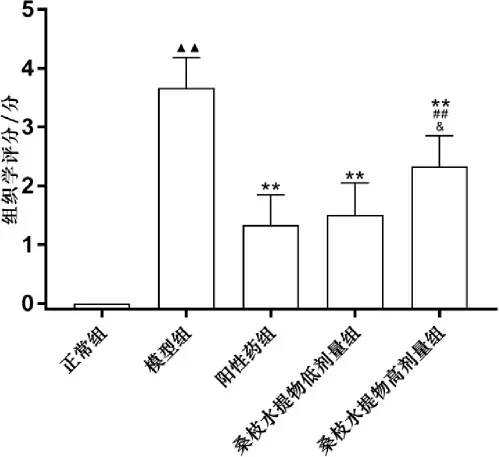
图4 各组大鼠踝关节组织学评分比较(±s,n=6)
3.5 免疫组化观察桑枝水提物对AIA 大鼠关节滑膜组织中HIF-1α、VEGF、MMP-3、MMP-9 蛋白的影响
HIF-1α 定位于滑膜细胞胞浆和胞核,VEGF、MMP-3、MMP-9 均定位于滑膜细胞胞浆。 正常组滑膜组织中可见极少量和少量棕黄色颗粒。 模型组可见大量细密的棕黄色颗粒物集聚。 阳性药组、桑枝水提物低剂量组棕黄色颗粒均显著减少,桑枝水提物高剂量组棕黄色颗粒小幅度减少。 模型组HIF-1α、VEGF、MMP-3、MMP-9 蛋白表达水平均显著高于正常组(P<0.01)。阳性药组、桑枝水提物低剂量组HIF-1α、VEGF、MMP-3、MMP-9 蛋白表达水平均显著低于模型组(P<0.01)。 桑枝水提物高剂量组MMP-3、MMP-9 蛋白表达水平均显著低于模型组(P<0.05,P<0.01)。 桑枝水提物高剂量组HIF-1α、VEGF、MMP-3、MMP-9 蛋白表达水平均显著高于阳性药组(P<0.05,P<0.01)。 桑枝水提物高剂量组HIF-1α、VEGF、MMP-9 蛋白表达水平均显著高于桑枝水提物低剂量组(P<0.05,P<0.01)。 详见图5。

图5 桑枝水提物对AIA 大鼠踝关节滑膜HIF-1α(A)、VEGF (B)、MMP-3(C)、MMP-9(D)蛋白表达的影响(免疫组化,±s,n=6)
3.6 Western blot 检测桑枝水提物对AIA 大鼠关节滑膜组织中HIF-1α、VEGF、MMP-3、MMP-9 蛋白的影响
模型组HIF-1α、VEGF、MMP-3、MMP-9 蛋白表达水平均显著高于正常组(P<0.01)。阳性药组、桑枝水提物低剂量组HIF-1α、VEGF、MMP-3、MMP-9蛋白表达水平均显著低于模型组(P<0.01)。 桑枝水提物高剂量组VEGF、MMP-3 蛋白表达水平均显著低于模型组(P<0.05,P<0.01)。 桑枝水提物高剂量组HIF-1α、VEGF、MMP-3、MMP-9 蛋白表达水平均显著高于阳性药组(P<0.01)。 桑枝水提物高剂量组VEGF、MMP-3、MMP-9 蛋白表达水平均显著高于桑枝水提物低剂量组(P<0.01)。 详见图6。
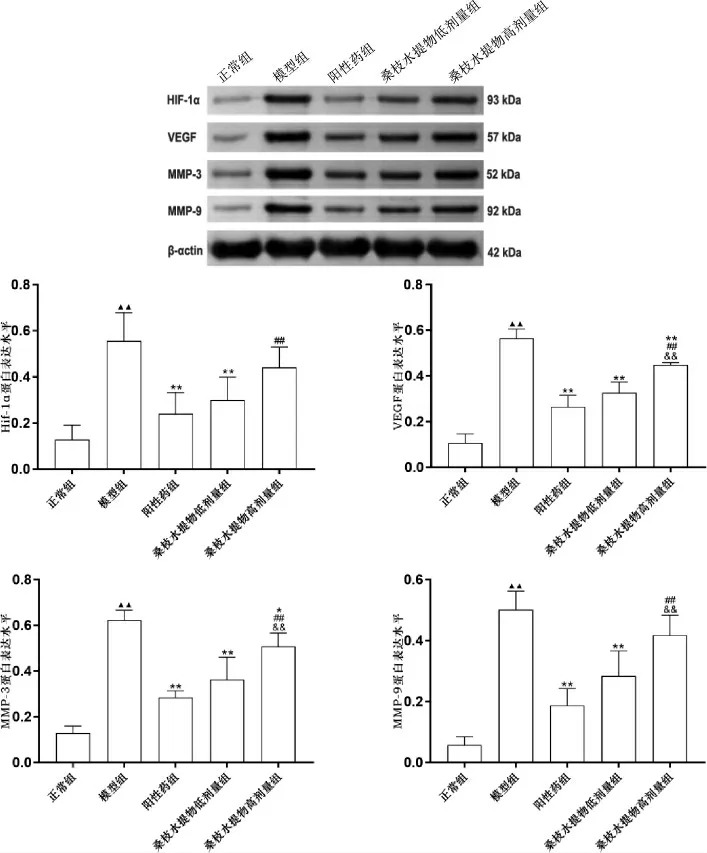
图6 桑枝水提物对AIA 大鼠膝关节滑膜HIF-1α、VEGF、MMP-3、MMP-9蛋白表达的影响(±s,n=6)
4 讨论
目前,RA 的治疗以药物治疗为主,包括以缓解症状为主的非甾体类抗炎药、以甲氨蝶呤为首的改善病情的抗风湿药、生物制剂、糖皮质激素等,RA是慢性免疫性疾病,上述药物长期使用都会导致明显的不良反应[15],寻找安全有效的治疗药物是当前亟待解决的问题。桑枝属于“舒筋活络类”中药,研究发现,桑枝作为配伍药对或配伍药组,在临床上治疗RA 出现的频率在177 味中药中排列第2,说明桑枝在RA 的治疗上起着重要作用[16]。 现代药理学研究发现,桑枝乙醇提取物具有显著的抗炎效果,能抑制诱生型一氧化氮合酶、环氧合酶-2、炎性介质白细胞介素-1β 和白细胞介素-6 等的产生[17],为其抗RA 作用提供了重要的实验依据。 基于对各RA动物模型的比较[18],佐剂诱导型AIA 模型发病等各方面表现与人RA 类似,且建模成功率高,故本研究选择建立此模型对桑枝治疗RA 的机制进行初步探讨。
RA 被称为“不死不治之癌”,其发病过程中成纤维样滑膜细胞侵略性的生长特性类似于肿瘤样增生[19]。 这种生长方式会消耗大量的能量并且需要大量的氧气供应,以满足细胞新陈代谢的需要。若关节腔内的氧气被消耗,形成慢性缺氧环境,HIF-1α 表达量增多,它会从细胞质转移至细胞核,诱导VEGF的表达,干扰HIF-1α 的表达,能显著降低VEGF 蛋白表达水平[20-21]。 目前,已知VEGF 是HIF 信号通路诱导的主要血管生成因子,可促进血管新生,参与血管翳形成,加重关节骨破坏,且VEGF 在一定程度上能反映RA 的疾病活动度[22-23]。 MMPs 可通过分解内皮细胞的细胞外基质,刺激血管内皮细胞游走、转移,促进血管新生,也能参与血管翳形成,还可直接降解骨和软骨,导致RA 骨破坏。 其中MMP-3 是导致骨破坏最重要的蛋白水解酶,可通过其表达情况预测骨破坏的严重程度,对RA 的治疗和预后具有指示作用[24]。研究表明,在RA 患者的关节液中,MMP-9的表达水平与VEGF 的表达水平密切相关,且VEGF能激活VEGF 受体2(vascular endothelial growth factor receptor 2, VEGFR2),磷酸化热休克蛋白90(heat shock proteins 90, Hsp90)亚型Y300,后者再与内皮型一氧化氮合酶结合,使血管内皮细胞释放一氧化氮增多,进而促进MMPs 表达[25-26],加重骨破坏。这表明VEGF 能对MMPs 的表达起到调控作用。网络药理学研究发现,桑枝-桂枝药对可能通过抑制HIF-1 信号通路表达来治疗RA,并且MMPs为此药对的靶点基因[8]。
本实验研究发现,桑枝水提物增加了AIA 大鼠体质量,减轻了骨破坏,并改善了四肢活动能力以提升关节炎大鼠生活质量。此外,低剂量的桑枝水提物还能显著抑制大鼠足趾炎症反应及新生血管形成。免疫组化和Western blot 显示给予桑枝水提物治疗后大鼠滑膜组织中HIF-1α 表达量明显降低,对下游靶基因VEGF 的激活效应减弱,使VEGF 表达量降低,抑制血管新生;VEGF 通过激活VEGFR2, 磷酸化Hsp90 亚型Y300,最终导致血管内皮细胞释放一氧化氮,促进MMPs 表达。 因此,降低VEGF 的表达能引起MMP-3、MMP-9 表达抑制,从而减轻关节炎大鼠的骨破坏。本实验结果显示,桑枝水提物高剂量组药效弱于桑枝水提物低剂量组,这可能是因为桑枝水提物高剂量组药物浓度偏大,含糖类物质较多,较黏稠,影响动物进食及基础代谢从而减弱了药效,因此,桑枝水提物低剂量组的治疗效果优于桑枝水提物高剂量组。
综上所述,桑枝水提物能有效减轻AIA大鼠骨破坏,其机制可能与抑制HIF-1α/VEGF/MMPs 信号通路的表达相关。
