乙酰水杨酸姜黄素酯通过TLR4/NF-κB 通路拮抗LPS 诱导的BV2 小胶质细胞炎症损伤
2022-07-30何超平李亚梅廖端芳
何超平,陈 煜,彭 莎,石 哲,李亚梅*,廖端芳*
(湖南中医药大学药学院湘产大宗药材品质评价湖南省重点实验室,湖南 长沙 410208)
神经免疫反应对于中枢神经系统(central nervous system, CNS)的发育、清除以及各项正常生理功能的维持都具有十分重要的作用。 而小胶质细胞作为一个主要的神经免疫细胞,能够迅速感知脑部免疫微环境的改变并作出响应,对于神经系统免疫环境的稳态维持具有重要作用[1]。 但另一方面,活化的小胶质细胞可以通过增加炎性细胞因子和介质的释放从而产生并加剧神经炎症,小胶质细胞所介导的神经炎症也与各种中枢神经系统疾病的发病机制有关,例如抑郁症、药物成瘾等,抑郁症的发病机制与炎症相关[2-3],因此,介导神经炎症反应的小胶质细胞已经成为抑郁症等一系列精神疾病的重要治疗靶点[4]。
乙酰水杨酸是最普通也是应用最广泛的解热镇痛药,其药理作用包括解热、镇痛、抗炎等,药效迅速且稳定。而姜黄素的抗炎效果已经在很多研究中得以证实,近年来对于姜黄素抑制核因子-κB(nuclear factor-κB, NF-κB)活性的研究也比较深入[5],但其缺点在于机体对姜黄素的吸收少、代谢快,并且生物利用度较低,这些缺点限制了姜黄素的临床应用。而本课题组将乙酰水杨酸基团与姜黄素结合,人工半合成新型药物乙酰水杨酸姜黄素酯(curcumin acetylsalicylate,CA;专利申请号201210365392.2)[6],在一定程度上克服了姜黄素吸收少的缺点,且本课题组前期研究已证实CA 可能通过抑制NF-κB p65蛋白水平,调节肝脏脂质代谢及炎症反应从而抑制高脂喂养ApoE-/-小鼠所致的动脉硬化斑块的形成[7]。因此,本研究通过分析CA 与相关炎性分子对接结果,发现CA 与NF-κB 和Toll 样受体4(Toll-like receptors 4, TLR4)对接良好,进一步采用体外LPS 诱导的BV2 小胶质细胞炎症模型,探究CA 抗神经细胞炎症的效果及其潜在机制。
1 材料
1.1 细胞与药物
小鼠BV2 小胶质细胞株来源于湖南中医药大学中西医结合学院;CA 由本课题合成并纯化,纯度为99.99%,溶于DMSO 中(DMSO 终浓度小于0.1%)。
1.2 试剂与仪器
LPS(货号:L2880-10MG,美国Sigma 公司);CCK-8(货号:E-CK-A362,美国Bio-Sharp 公司);NO 检测试剂盒(货号:S0021S,碧云天公司);IL-1β ELISA 检测试剂盒(货号:70-EK201B/3-96)、TNF-α ELISA 检测试剂盒(货号:70-EK282/3-96 均购自)联科生物公司;NF-κB p65(货号:ab16502)、p-NFκB p65(货号:ab86299)、TLR4(货号:ab13556)、MYD88(货号:ab133739)、iNOS(货号:ab178945)均购自英国Abcam 公司;IκB-α(货号:L35A5)、p-IκB-α(货号:14D4)均购自美国Cell Signaling Technology 公司。
倒置荧光显微镜(型号:IX83,美国Olympus 公司);酶标仪(型号:ELX800,美国Bio-tek 公司);细胞培养箱(型号:HERAcell 150i,美国Thermo Scientific 公司)。
2 方法
2.1 分子对接方案
本课题组基于前期研究基础,并通过查阅与炎症相关靶标的文献,筛选出NF-κB、TLR4、Toll 样受体2(Toll-like receptors 2, TLR2)、胰岛素诱导基因2(nsulin inducible gene 2, Insig2)、尼曼匹克C1 型L1(Niemann-Pick C1 like 1, NPC1-L1)、Wnt 信号蛋白(Wnt),对目标蛋白活性位点进行分析(三维结构来源于蛋白质晶体结构数据库、PDB 数据库),后应用LibDock 模块(来源于Discovery Studio 3.0)将配体CA 与受体蛋白分子对接[8]。 选取与CA 对接吻合度前2 名的蛋白分子,并在BV2 小胶质细胞中进行验证。
2.2 细胞培养
BV2 小胶质细胞在DMEM 完全培养基(含10%无菌胎牛血清和1%双抗)置于37 ℃、5% CO2细胞培养箱中培养。 细胞融合度达到80%~90%时传代,隔日更换培养基。 待细胞生长状态良好时,弃去培养基后加入少量胰蛋白酶,细胞变圆脱落后,进行离心收集(r=8.5 cm,1000 r/min,8~10 min),去除上清液,加入90% FBS+10% DMSO 吹匀后保存于冻存管中,置于-80 ℃冰箱保存。
2.3 药物干预及分组
根据细胞计数试剂盒(cell counting kit-8, CCK-8)检测结果计算细胞存活率,选取安全用药范围内浓度20、40、60 μmol/L 作用2 h 后,10 mg/L LPS 作用24 h 进行造模。 将BV2 小胶质细胞分为对照组(细胞培养液)、模型组(10 mg/L LPS 细胞培养液)、CA 干预组(20、40、60 μmol/L CA 细胞培养液作用2 h+10 mg/L LPS 细胞培养液)。
2.4 药物处理
当BV2 小胶质细胞融合度达到80%~90%时,预先用不同浓度的CA 处理细胞2 h,再加入400 ng/mL 的LPS 刺激24 h,收集细胞上清液或提取细胞蛋白作为检测样本,后续实验皆为此药物处理方案。
2.5 CCK-8 法检测细胞活力
将BV2 小胶质细胞以每孔8×103细胞密度将细胞接种于96 孔板内,次日按“2.4”项方法处理后,弃去上清液, 每孔重新加入含10% CCK-8 的DMEM培养基,孵育1 h 后,使用酶标仪在450 nm 波长下测定吸光值,计算细胞生存率。
2.6 ELISA 法检测细胞TNF-α、IL-1β 水平
将BV2 小胶质细胞以每孔8×103细胞密度将细胞接种于96 孔板内,次日按“2.4”项方法处理后收集细胞上清液,离心去除细胞碎片后将上清液作为检测样本,按照试剂盒说明书采用ELISA 法检测TNF-α 和IL-1β 水平。
2.7 Griess 法检测细胞NO 水平
将BV2 小胶质细胞以每孔8×103细胞密度将细胞接种于96 孔板内,次日按“2.4”项方法处理后收集细胞上清液,离心去除细胞碎片后将上清液作为检测样本,按照试剂盒说明书采用Griess 法测定NO 浓度。
2.8 Western blot 检测NF-κB 通路及TLR-4/MYD88通路表达
取各组实验处理后细胞,用预冷的PBS 洗3次,加入RIPA 裂解液和PMSF 的混合液100 μL(比例为100∶1)置于冰上裂解30 min,用细胞刮刮下蛋白,4 ℃离心(r=8.5 cm,1 2000 r/min,15 min),收集上清液。 BCA 蛋白定量法测定蛋白浓度。 每个样品取30 μg 并加入5×SDS 凝胶上样缓冲液,100 ℃煮沸5 min,使其变性。 配制5%浓缩胶、8%分离胶,进行电泳分离(浓缩胶80 V,分离胶120 V),0.22 μm PVDF 膜200 mA 湿转120 min,5%脱脂牛奶慢摇封闭1 h,加入一抗NF-κB p65(1∶1000)、IκB-α(1∶1000)、p-IκB-α (1∶1000)、p-NF-κB p65 (1∶2000)、TLR-4(1∶1000)、MYD88(1∶1000),4 ℃孵育过夜,TBST 洗5 次,每次5 min,按1∶5000 的比例加入稀释过的二抗室温孵育1 h,然后用TBST 洗膜5次,每次5 min,用化学发光显影法进行显影,结果用Image J 测量灰度值,以目的蛋白与β-actin 的比值进行统计学分析。
2.9 统计学分析
数据采用GraphPad Prism 8.0 以及SPSS 21.0进行统计分析,计量资料以“±s”表示,两组样本均数间比较采用t 检验进行统计分析,多组之间比较用单因素方差分析,P<0.05 为差异有统计学意义。
3 结果
3.1 CA 结构以及分子对接结果
通过CA 结构式可以看出,乙酰水杨酸与姜黄素通过酯健结合形成CA(图1)。 如表1 所示,在蛋白对接结果中,NF-κB 和TLR4 与CA 的对接吻合度值高达99.58%和92.71%,而其他几个蛋白与CA对接吻合度值相对较低,故之后的研究仅针对吻合度高的NF-κB 和TLR4 在BV2 小胶质细胞中进行验证。

表1 CA 与受体蛋白对接结果

图1 CA 与炎症通路相互作用分子对接分析
3.2 不同浓度CA 对BV2 小胶质细胞存活率的影响
经不同浓度CA 干预24 h 后,在0~80 μmol/L 浓度范围内,CA 没有显示明显的细胞毒性,当CA浓度大于80 μmol/L 时,细胞活性受到抑制(P<0.05)。详见图2。
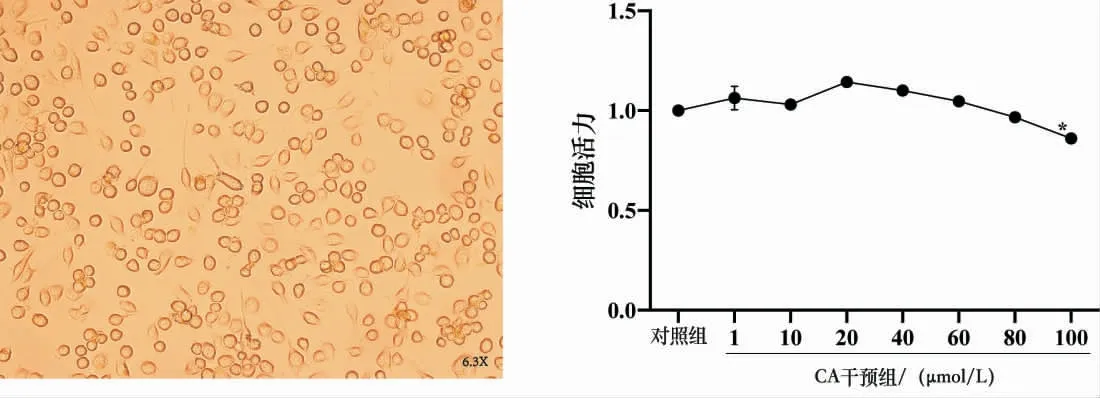
图2 CA 对BV2 小胶质细胞活力的影响(±s,n=3)
3.3 各组IL-1β、TNF-α、NO 表达水平比较
与对照组相比,LPS 刺激后的细胞炎症因子IL-1β、TNF-α 和NO 水平明显上升(P<0.05);与模型组相比,CA 干预组上清液中的TNF-α、IL-1β、NO炎症分子水平下降(P<0.05)。在CA 浓度为60 μmol/L时,CA 对IL-1β 对抑制率达74.89%、对TNF-α 抑制率达56.73%、对NO 抑制率达72.64%。 说明CA 能够抑制LPS 所引起的炎症因子的上调。 详见图3。

图3 不同浓度CA 对LPS 诱导BV2 小胶质细胞IL-1β、TNF-α、NO 水平的影响(±s,n=3)
3.4 各组NF-κB、TLR4 的蛋白表达水平比较
与对照组相比, 模型组p-NF-κB p65 与NF-κB p65 蛋白表达量比值以及p-NF-κB p65 蛋白含量明显升高(P<0.05);与模型组相比,CA 干预组p-NFκB p65 与NF-κB p65 蛋白表达量比值明显降低(P<0.05),p-IκB-α 蛋白含量明显下降(P<0.01)。 与对照组相比,模型组的TLR4 和MYD88 表达量都有明显增加(P<0.05);与模型组相比,CA 干预组TLR4蛋白表达显著降低(P<0.01)。 详见图4、图5。

图4 不同浓度CA 对LPS 诱导BV2 细胞NF-κB/IκB-α 表达及其磷酸化的影响(±s,n=3)

图5 不同浓度CA 对LPS 诱导BV2 细胞TLR-4、MYD88 的影响(±s,n=3)
4 讨论
适度的炎症反应可以帮助大脑维持稳态,保护神经元功能,而过度的炎症反应被认为是大部分中枢神经系统疾病的一个重要病理特征,例如帕金森综合征、抑郁症等[9],且主要由胶质细胞介导[10],持续的炎症反应会释放出大量的炎症因子,损伤神经元,导致一系列病理变化。 所以,针对小胶质细胞调控神经炎症达到治疗脑部疾病的治疗方案研究具有广阔的发展前景。
姜黄素是姜黄的主要成分,已被证实其药理作用包括抗炎、调脂等[11]。尽管已有文章表明姜黄素对于抑郁症患者具有一定疗效[12],但是其临床应用并不广泛的一个重要原因是其生物利用度低[13-14]。 而姜黄素的酯化物在提高生物利用度的同时,也可以达到抗炎、调脂等一系列效果[15]。乙酰水杨酸已被证实具有良好的抗炎、解热镇痛等药理作用,但是其缺点在于体内代谢速度快,因此,为了更好地提高两种物质的疗效,我们将其合成CA,也达到了比较可观的合成率[16]。
LPS 可以激活小胶质细胞并触发促炎信号传导级联反应[17],在小胶质细胞释放大量炎症介质时,这些介质也受NF-κB 的调节,NF-κB 是炎症的中央调节因子,它控制趋化因子、细胞因子、促炎酶、黏附分子和促炎转录因子的基因转录[18-19]。 而Toll 样受体是与病原体相关分子模式(pathogen-associated m olecular patterns, PAMPs) 识别有关的关键模式识别受体(pattern recognition receptors, PRRs),可以识别多种病原体,并通过激活NF-κB 和其他引起促炎分子合成的转录因子来启动促炎免疫应答[20]。 在我们前期的分子对接结果中,CA 与NF-κB 以及TLRs 皆具有比较高吻合度的对接结果,基于此结果,我们对CA 抑制LPS 诱导的BV2 小胶质细胞炎症的初步机制做了简单的探索。 实验结果表明CA对BV2 小胶质细胞毒性作用较小,可以降低细胞炎症因子水平,其机制可能与抑制NF-κB 的磷酸化、减少IκB-α 的磷酸化降解以及TLR4 通路的激活有关。 本课题组前期针对CA 调脂、抗炎的效果已发表相关论文[7],本文首次提出将CA 运用到体外神经炎症模型当中,并且在此研究中也证实其具有良好的抗炎效果,对于中枢神经系统疾病可能具有较好的疗效。
本研究应用体外LPS 诱导BV2 小胶质细胞炎症模型,观察了CA 的抗炎作用,并证实了CA 可以通过抑制NF-κB/TLR4 通路减少炎症介质的释放从而降低细胞炎症水平,CA 抗BV2 小胶质细胞炎症作用机制如图6 所示,但其更深入的机制有待进一步研究。

图6 模式示意图
