YLR358C 对酿酒酵母细胞壁完整性的调控
2022-07-30李梦妍王捍英郭艳芳马加庆王卫群
张 瑜 ,李梦妍 ,王捍英 ,郭艳芳 ,马加庆 ,王卫群
(1)昆明医科大学基础医学院;2)科技成果孵化中心,云南 昆明 650500)
酿酒酵母(Saccharomyces cerevisiae)是一种单细胞真菌,是发酵工业中常用的菌株之一[1-2]。阐明真菌细胞壁合成和组装的机理是真菌在工业上应用和发展的迫切需要,酿酒酵母被认为是研究真菌细胞壁生物学反应的理想模型。酿酒酵母的细胞壁是维持细胞形状和保护内环境所需的细胞结构[3],当酿酒酵母生长、发育或受到外界环境的干扰时,细胞壁的完整性被破坏。此时,细胞壁以高度调控和极化的方式重塑,这一过程主要受CWI 信号通路的调控[4]。YLR358C 是酿酒酵母未知的开放阅读框(open reading frame,ORF)。前期研究发现YLR358C 缺失株对细胞壁干扰剂敏感,提示YLR358 C 可能参与细胞壁完整性的调控[5]。但YLR358C 在细胞壁应激反应中的作用机制尚不清楚。本研究观察酿酒酵母YLR358C缺失对细胞壁完整性的调控作用及相关机制。
1 材料与方法
1.1 试剂
酵母基因组DNA 提取试剂盒、YPD 培养基组分蛋白胨、酵母提取物、葡萄糖、琼脂购自上海生工生物技术有限公司;细胞壁干扰剂Calcofluor White (CFW)、刚果红(CR)和十二烷基硫酸钠(SDS)分别从BioFroxx 公司和生工生物技术有限公司获得。
1.2 菌株和培养条件
野生型酿酒酵母(WT)保存于本实验室;敲除酵母库购于Horizon Discovery 有限公司。WT 酵母在YPD 固体和液体培养基中稳定繁殖,为了保持遗传稳定性,敲除酵母需要在YPD 培养基中加入200µg/mL G418 进行培养。
1.3 YLR358C 基因敲除株的验证
将YLR358C 敲除酵母以200 r/min 的转速培养过夜,离心1 min 收集酵母,用上述试剂盒提取基因组DNA。以获得的基因组为模板,以A、KanB、KanC 和D 为引物,对YLR358C 敲除酵母进行PCR 验证,成功敲除的酵母命名为YLR358CΔ。为了探讨YLR358C 是否参与酿酒酵母细胞壁完整性的调节,用不同浓度的细胞壁干扰剂处理YMR253CΔ 和WT 酵母,以检测两种酵母菌株的细胞生长状态。
1.4 点板实验
挑取WT 和YLR358CΔ 酵母单克隆,分别接种于10 mL 的YPD 液体培养基和含有200 µg/mL G418 的YPD 液体培养基中,在恒温摇瓶中培养过夜。酵母液离心后,在新鲜的YPD 培养基中重悬细胞至OD600=1.0。然后分别稀释至10-1、10-2、10-3、10-4、10-5,取2.5 µL 的稀释液斑点于含有不同浓度CFW、SDS、CR 的YPD 板上,在28 ℃恒温培养箱中孵育2 d,观察生长情况。
1.5 CFW 染色
WT 和YLR358CΔ酵母单克隆在28 ℃、200 r/min 的恒温摇床上培养至对数期。离心后,将细胞重悬于10 mL 含有30 µg/mL CFW 的YPD培养基中。酵母CFW 染色后,将细胞重悬于适量PBS 中,转移至孔板上,静置10~15 min 后倒置荧光显微镜下观察荧光。
1.6 显微形态观察
WT 和YLR358C 敲除酵母在28 ℃和200 r/min恒温摇瓶下培养过夜。通过透射电子显微镜(美国Titan 公司)观察酵母的显微形态。
1.7 转录组测序与分析
将酵母离心后,提取总RNA,以mRNA 为模板合成并纯化cDNA,最后通过PCR 富集获得最终的cDNA 文库。对cDNA 文库进行测序,并将其与指定的参考基因组进行比较,获得的图谱数据进行文库质量评估及生物信息学分析。
1.8 酵母总RNA 提取及实时定量PCR
离心收集酵母后,用Trizol 提取总RNA,逆转录合成cDNA 并进行实时定量PCR。获取的结果使用公式2-ΔΔCt进行计算。
1.9 统计学处理
用SPSS 13.0 软件进行分析,计量资料用均数±标准差(±s)表示,2 组间比较用t检验,P< 0.05 表示差异有统计学意义。
2 结果
2.1 敲除YLR358C 干扰酿酒酵母细胞壁
结果发现,敲除YLR358C 后酿酒酵母的生长在含CFW、CR 和SDS 的培养基上受到明显抑制,提示敲除YLR358C 影响酿酒酵母细胞壁完整性(图1)。

图1 敲除YLR358C 提高了酿酒酵母对细胞壁干扰剂的敏感性Fig.1 The YLR358C knockout increases the sensitivity of S.cerevisiae to cell wall interference reagents
2.2 YLR358CΔ 酵母细胞壁几丁质的异常分布
经细胞壁干扰剂CFW 和SDS 处理后发现,与WT 酵母相比,YLR358CΔ 敲除酵母的几丁质在细胞壁周围积累更多(图2A)。
对WT 菌株和YLR358CΔ 菌株进行了透射电镜观察,发现酵母细胞壁呈双层结构。与WT 酵母相比,电子密度较低的YLR358CΔ 酵母突变体的细胞壁内部结构变薄(图2B)。上述结果提示,YLR358CΔ 突变体对细胞壁干扰更敏感。
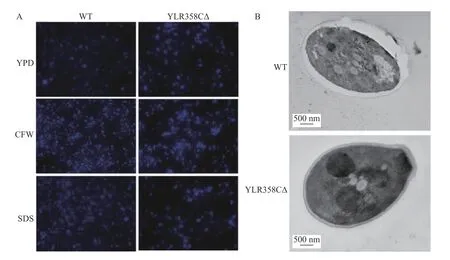
图2 酵母细胞壁中的几丁质受YLR358C 调控Fig.2 The chitin in the yeast cell wall is regulated by YLR358C
2.3 YLR358C 调控多种信号通路
用于转录组分析的组内样本间相关系数R2的最小值为0.947,组间样本间R2的最大值为0.848(图3A)。因此,本研究的样本选取是合理的。利用DESeq2 软件,以P< 0.05,变化倍数≥2.0 倍为差异表达的阈值,筛选出的差异表达基因共1 659 个,其中下调基因931 个,上调基因728 个 (图3B,3C),YLR358C 敲除后的酿酒酵母差异基因的气泡图显示了KEGG 富集分析结果(图3D)。

图3 R358C 基因敲除和转录组分析Fig.3 YLR358C knockout and transcriptome analysis
2.4 细胞壁完整性途径可能受到YLR358C 的调控
转录组分析结果提示CWI 信号通路中的WSC3、SWI4 和HSP12 等几个关键因子异常表达。SWI4 和WSC3 mRNA 在YLR358CΔ 酵母中的表达量上调,其中WSC3 的上调更为明显。与WT酵母相比,HSP12 的表达降低(图4)。

图4 R358C 调控细胞壁应激反应通路中WSC3、SWI4 和HSP12 的表达水平Fig.4 YLR358C regulates the expression levels of WSC3,SWI4,and HSP12 in the cell wall stress response pathway
3 讨论
酿酒酵母是一种存在细胞壁的单细胞真核生物。当酵母细胞面临各种环境压力时,细胞壁不断地重构[6-8]。酵母甘露蛋白在改善葡萄酒品质方面具有防止浑浊、降低涩味、保留香气成分、刺激乳酸菌生长等优点[9]。因此,明确酿酒酵母细胞壁相关基因的作用,可以改变酵母特性,优化发酵工艺,对食品、医药和发酵行业具有重要意义[10-11]。本研究发现,YLR358C 基因缺失的酿酒酵母在含有细胞壁干扰剂的培养基上生长受到抑制。YLR358C 基因敲除株对细胞壁干扰剂敏感。CFW 染色显示细胞壁几丁质合成增加,细胞侧壁积累过多。转录组测序和生物信息学分析表明,YLR358C 基因可能参与了酿酒酵母CWI 信号通路的调控。转录组分析发现CWI 信号通路中的WSC3、SWI4和HSP12 基因在YLR358CΔ 酵母中异常表达。PCR 结果显示,WSC3 和SWI4 在YLR358CΔ酵母中表达上调,而HSP12 在YLR358CΔ 酵母中表达下调,这与转录组结果一致。
总之,本研究发现YLR358C 参与细胞壁完整性的调节,其作用可能是通过调节CWI 信号通路介导的。对YLR358C 进行更深入的功能和机理研究,希望为食品、医药、发酵等行业的发展提论理论依据。
