小肠缺血时间与GRP78 表达的相关性研究及意义
2022-07-30臧成昊杨金伟马微梁宇刘矿嫔刘伟刘洁王国栋张丝嘉吴红杰朱科威郭建辉李力燕
臧成昊,杨金伟,马微,梁宇,刘矿嫔,刘伟,刘洁王国栋,张丝嘉,吴红杰,朱科威,郭建辉*,李力燕*
1.昆明理工大学附属医院,云南省第一人民医院,云南 昆明 650032;2.昆明医科大学神经科学研究所,云南 昆明 650500
肠缺血再灌注损伤(intestine ischemia reperfusion injury,IIRI)是指组织、器官低灌流缺血后再获得正常的血液供应后,组织、器官所受到的缺血性损害非但没有减轻或恢复,反而更加严重。在外科手术中,由于出血、创伤、感染性休克、严重烧伤,及某些外科处理过程(如小肠移植、腹主动脉手术或心脏旁路手术等)等情况都会导致小肠缺血再灌注损伤(IIRI)[1]。小肠的肠粘膜毛细血管比较丰富,一旦出现损伤,将会介导炎症反应,加重肠道损伤,并且IIRI 不仅会造成小肠损伤,更会破坏小肠的黏膜屏障造成多种器官的功能失调。二胺氧化酶(diamine oxidase;DAO)活性的强弱是反映肠黏膜损伤的重要指标之一,肠粘膜一旦受损就会导致肠道中的DAO 活性降低,而血液中的DAO 活性显著增加[2]。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)是位于内质网上的一种重要分子伴侣[3]。研究发现,GRP78 可通过维持内质网稳定,修复心、脑等重要器官的缺血再灌注损伤[4,5],但GRP78 与小肠缺血再灌注损伤的相关性研究较少。本文用SD 大鼠制作小肠缺血再灌注损伤模型,来探讨不同小肠缺血时间下GRP78 的表达水平与小肠缺血再灌注损伤程度之间的关系及意义。
1 材料与方法
1.1 材料与试剂
HE 染色试剂盒(碧云天生物技术有限公司),ELISA 试剂盒(北京四正柏生物科技有限公司,CRE0003),TUNEL 试剂盒(碧云天生物技术有限公司,C1098),PCR 试剂盒(TaKaRa,RR047A),GRP78抗体(GeneTEX),BCA 蛋白浓度测定试剂盒(碧云天生物技术有限公司)
1.2 实验动物分组及模型的制备
SPF 级SD 雌性大鼠84 只,体重为200~230 g,随机分组,对照组14 只,损伤组每个时间点14 只,手术前禁食12 h,自由饮水。对照组和损伤组每个时间点取7 只SD 雌性大鼠,手术前用4%水合氯醛腹腔注射麻醉,在腹腔正中偏左开口,翻出小肠,显露肠系膜上动脉(superior mesenteric artery,SMA)。损伤组用微创动脉夹夹住SMA 20、40、60、80 和100 min,然后开放SMA,于开放SMA 6h 后处死;对照组只暴露SMA,不做夹壁处理,其他处理相同。对照组和损伤组每个时间点其余7 只SD 雌性大鼠,在进行缺血手术后缝合伤口正常饲养,观察存活情况。
1.3 标本的采集
各组用于取材的SD 雌性大鼠于血液复灌6 h 后,迅速取出距回肠末端3~5 cm 处的小肠组织,取4 段,每段2~3 cm,用生理盐水冲洗干净,再用滤纸吸干小肠组织表面水分,2 段固定在4%多聚甲醛溶液中,其余2 段-80 ℃冰箱保存。
1.4 观察指标及方法
1.4.1 小肠损伤程度测定 标本在4%多聚甲醛溶液固定12 h 后,滤纸吸去小肠组织表面多聚甲醛溶液,进行冷冻切片,HE 染色,100×光镜下进行组织病理学观察。采用Chiu 氏法评分来评价肠黏膜损伤程度。
1.4.2 小肠组织细胞凋亡的TUNEL 法检测 检测步骤按TUNEL 试剂盒(碧云天生物技术有限公司,C1098)上的步骤进行,细胞核呈棕黄色者为阳性。400 倍显微镜下,在肠粘膜上任意选取5 个非重叠视野,计数凋亡细胞的数目,然后取其平均数值,计算TUNEL 染色细胞的阳性率,以用于统计学分析。
1.4.3 ELISA 法检测血清中DAO 表达水平 按照ELISA 试剂盒(北京四正柏生物科技有限公司,CRE0003)说明书步骤进行操作,首先将血清进行1:2的稀释,随后向96 孔板中加入样品和标准品37 ℃孵育90 min,加入生物素化抗体工作液37 ℃孵育60 min,加入酶结合工作液37 ℃孵育30 min,加入显色剂避光37 ℃孵育15 min,最后加入终止液在OD450下测量吸光度。本实验采用双抗体夹心ELISA 法,检测各组大鼠DAO 表达水平。
1.4.4 RT-PCR 法检测小肠中GRP78mRNA 的表达水平 取0.2 g 小肠组织,加入1 mL Trizol,充分混匀、裂解至液体均一粘稠;加入200 μL 的氯仿,剧烈震荡15 s,室温静置10 min;13 000 rpm×15 min,4 °C 离心;将上层水相转入一个新的EP 管内,加入400 μL 的异丙醇,室温静置20 min;离心,13 000 rpm×10 min,4 ℃;弃上清,1 mL 75%乙醇颠倒摇晃洗涤。13 000 rpm×10 min,4 ℃;打开管盖,晾干5~10 min。倒扣吸净残液;用20 μL DEPC 处理水溶解RNA,之后进行总RNA 的浓度和纯度测定。随后用TaKaRa 试剂盒的方法去除基因组DNA 反应,再用TB Green qPCR 法进行逆转录反应。应用Applied Biosystems 7300/7500 Real Time PCR System 的操作方法,配制20 μL 反应体系,采用3 步法进行PCR 扩增。引物序列:上游5’GAACCAACTCACGTCCAACC3’,下游:5’CTTTCC CAAATACGCCTCGG3’。内参采用GAPDH,上游:5’GAAGCTGGTCATCAACGGGA3’,下 游:5’TCG TGGTTCACACCCATCAC3’。随后采用2-△△Ct法检测GRP78mRNA 的相对水平。
1.4.5 WB 法检测小肠中GRP78 蛋白的表达水平取0.2 g 小肠组织,提取小肠组织蛋白,用BCA 蛋白浓度测定试剂盒进行蛋白定量,随后用Loading Buffer进行蛋白变性。取20 μL 样品上样,10% SDS-PAGE,180 V,100 mA,电泳50 min,电泳后200 mA,1 h 转移至PVDF 膜上,随后用10% 封膜奶室温封膜2 h,TBST 洗3 次,每次5 min,一抗孵育4 ℃过夜,TBST洗3 次,每次5 min,室温孵育二抗2 h,TBST 洗4 次,每次5 min,显影。
1.4.6 术后各组大鼠两周的存活率 各组用于观察存活情况的SD 雌性大鼠,在进行小肠缺血手术之后,正常饲养,观察各组存活情况。
1.5 统计分析
采用SPSS 进行统计分析,数据以均数±标准差() 表示,组间比较采用ANOVA 分析方法,P<0.05。
2 结果
2.1 小肠组织病理变化
对照组回肠粘膜正常,显示规则的绒毛,绒毛顶端轻微破裂;缺血20 min 组部分肠粘膜绒毛断裂,绒毛上皮层与固有层中度分离,绒毛毛细血管充血明显;缺血40 min 组肠粘膜绒毛成块脱落,固有层破坏、出血、溃疡;缺血60 min 组隐窝基底层损伤;缺血80 min 组肠粘膜完全溃散;缺血100 min 组肠粘膜大规模的出血溃散。损伤组与对照组相比,随着缺血时间的延长,肠粘膜细胞结构破坏越来越严重,出现绒毛脱落,固有层破坏、出血、溃疡,肠壁变薄。图1 结果显示,随着小肠缺血时间的延长Chiu 氏评分逐渐升高,说明损伤程度逐渐加重;图2 结果显示,肠黏膜损伤程度与缺血时间有关,随着缺血时间的延长,黏膜损伤程度逐步加重。
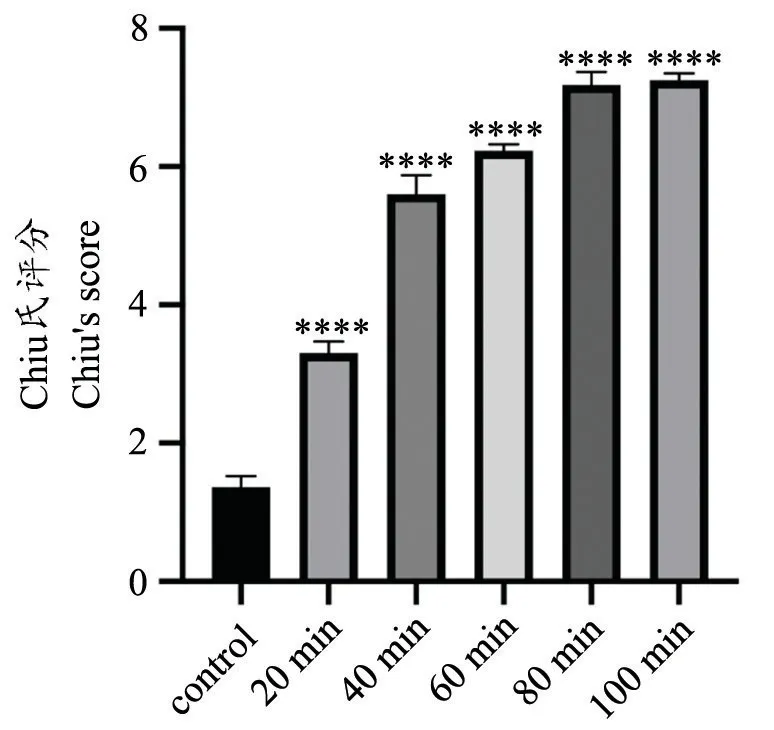
图1 各组小肠损伤Chiu 氏评分与对照组相比较,****P<0.0001Fig.1 Chiu's score of small intestine injury in each group****P<0.0001,compared with control group
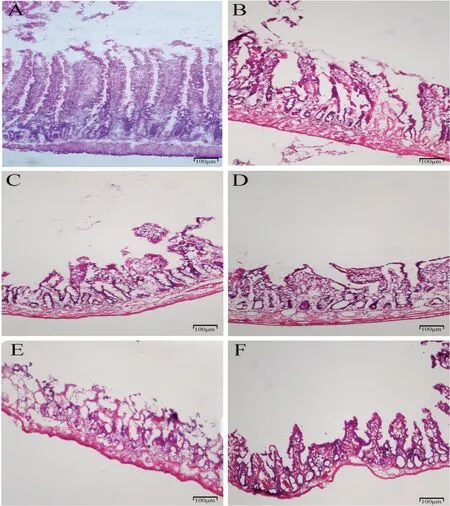
图2 各组小肠组织HE 染色A:对照组小肠组织HE 染色 B:缺血20 min 组小肠组织HE 染色 C:缺血40 min 组小肠组织HE 染色D:缺血60 min 组小肠组织HE 染色E:缺血80 min 组小肠组织HE 染色 F:缺血100 min 组小肠组织HE染色Fig.2 HE staining of small intestine tissue in each groupA: small intestine tissue in the control group; B: small intestine tissue in the ischemia 20 min group; C: small intestine tissue in the ischemia 40 min group; D:small intestine tissue in the ischemia 60 min group; E:small intestine tissue in the ischemia 80 min group; F: small intestine tissue in the ischemia 100 min group
2.2 小肠组织细胞凋亡检测
由图3、4 可得,对照组小肠绒毛处可见少数细胞凋亡;缺血20、40、60、80、100 min 组小肠绒毛及黏膜层细胞凋亡程度逐渐增加。与对照组相比损伤组随着缺血时间的延长小肠粘膜细胞TUNEL 实验结果阳性率逐渐增加,小肠绒毛及黏膜层细胞凋亡程度逐渐增加。
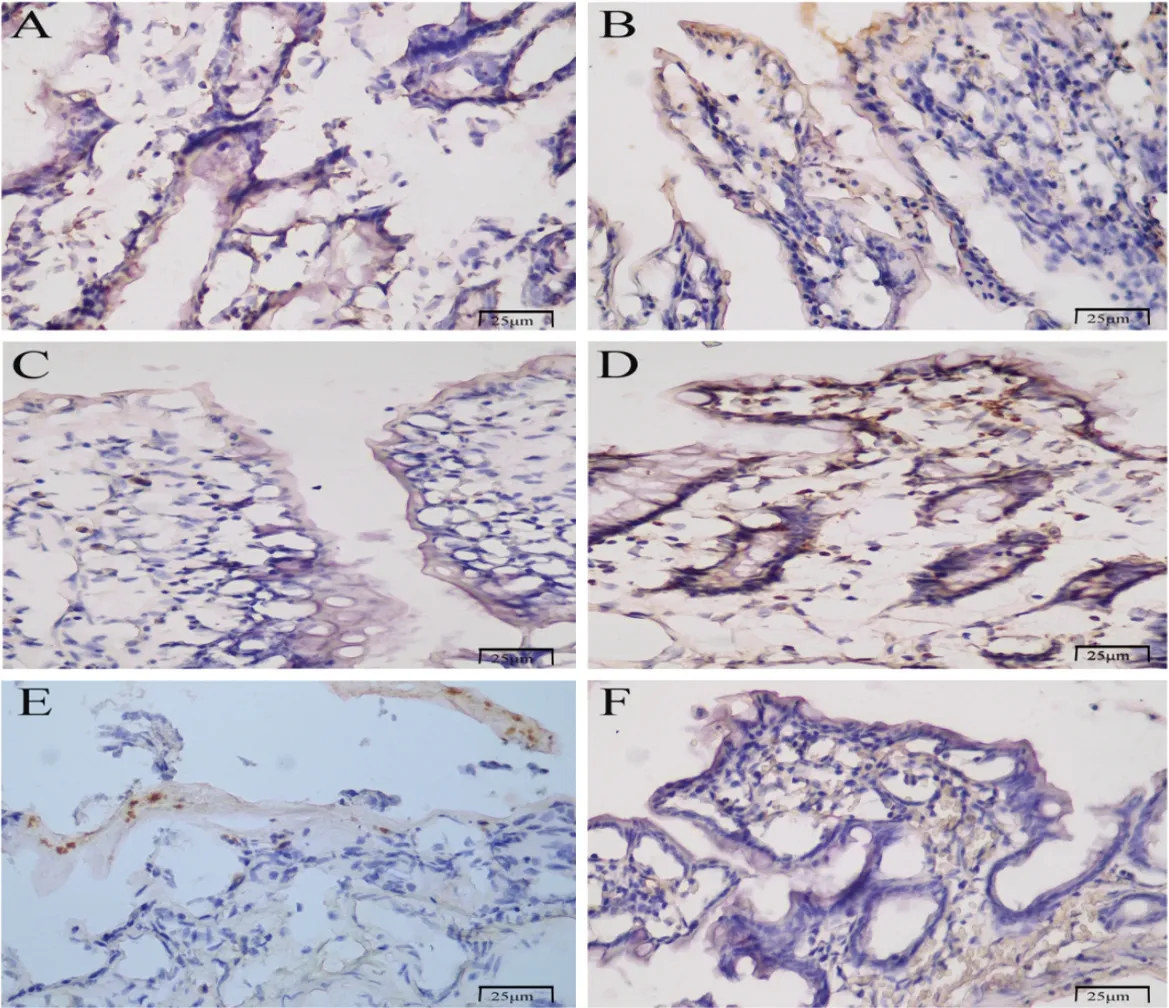
图3 各组小肠组织TUNEL检测A:对照组小肠组织TUNEL 检测B:缺血20 min 组小肠组织TUNEL 检测 C:缺血40 min 组小肠组织TUNEL 检测 D:缺血60 min 组小肠组织TUNEL 检测 E:缺血80 min 组小肠组织TUNEL 检测 F:缺血100 min 组小肠组织TUNEL 检测Fig.3 TUNEL detection of small intestine tissue in each groupA: small intestine tissue in the control group; B: small intestine tissue in the ischemia 20 min group;C: small intestine tissue in the ischemia 40 min group; D: small intestine in the ischemia 60min group; E: small intestine tissue in the ischemia 80min group; F: small intestine tissue in the ischemic 100 min group
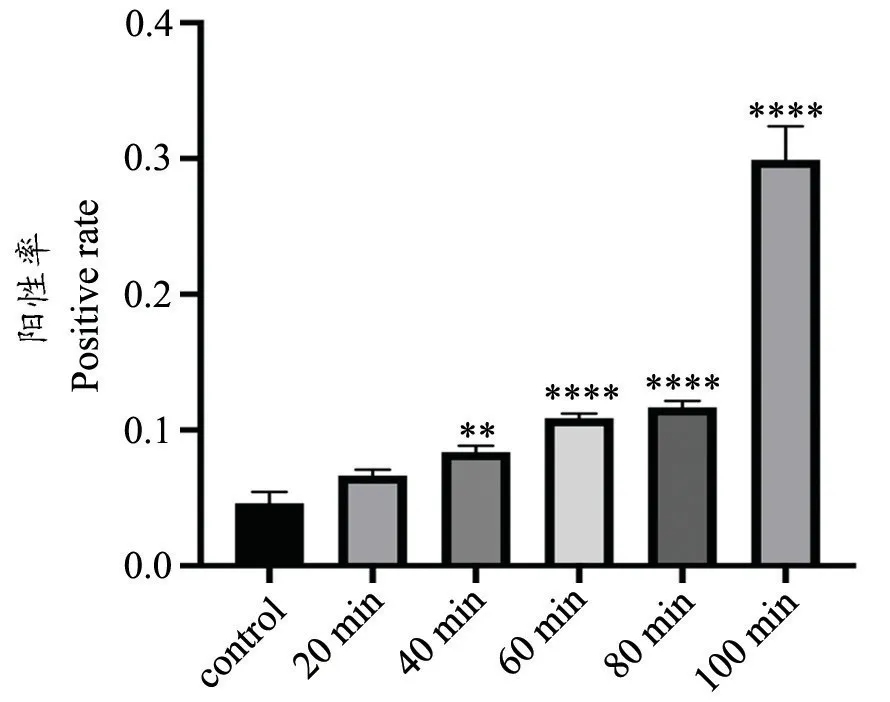
图4 各组小肠组织TUNEL 检测细胞凋亡评分与对照组相比较,**P<0.01,****P<0.0001Fig.4 Apoptosis scores of small intestine tissues detected by TUNEL in each group**P<0.01,****P<0.0001,compared with the control group
2.3 各组SD 大鼠DAO 的表达水平
由图5 可得,随着缺血时间的延长,DAO 的表达水平逐渐升高,与对照组相比缺血20 min、40 min 时,DAO 的表达水平并未显著升高;与对照组相比缺血60 min 时SD 大鼠DAO 的表达水平第一次出现明显升高的现象(P=0.0118);与对照组相比80 min、100 min 时间点时SD 大鼠DAO 的表达水平显著升高(P<0.0001)。
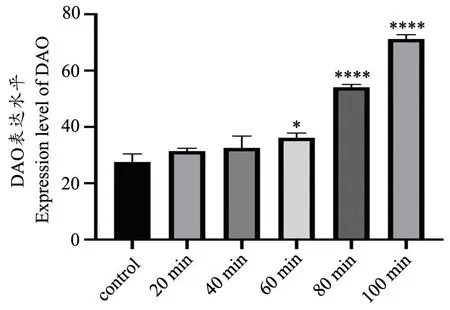
图5 各组SD 大鼠DAO 的表达水平与对照组相比较,*P=0.0118,****P<0.0001Fig.5 The expression level of DAO in each group*P=0.0118,****P<0.0001,compared with the control group
2.4 GRP78 mRNA 表达水平
由图6 可得,与对照组相比损伤组缺血40 min 时GRP78 mRNA 的表达水平明显升高(与对照组相比P=0.0009),并且在缺血80 min 时达到峰值(与对照组相比P<0.0001);与损伤组缺血80 min 时间点GRP78 mRNA 的表达水平相比,在100 min 时GRP78 mRNA的表达水平显著下降(与损伤组缺血80 min 时间点相比P<0.0001)。
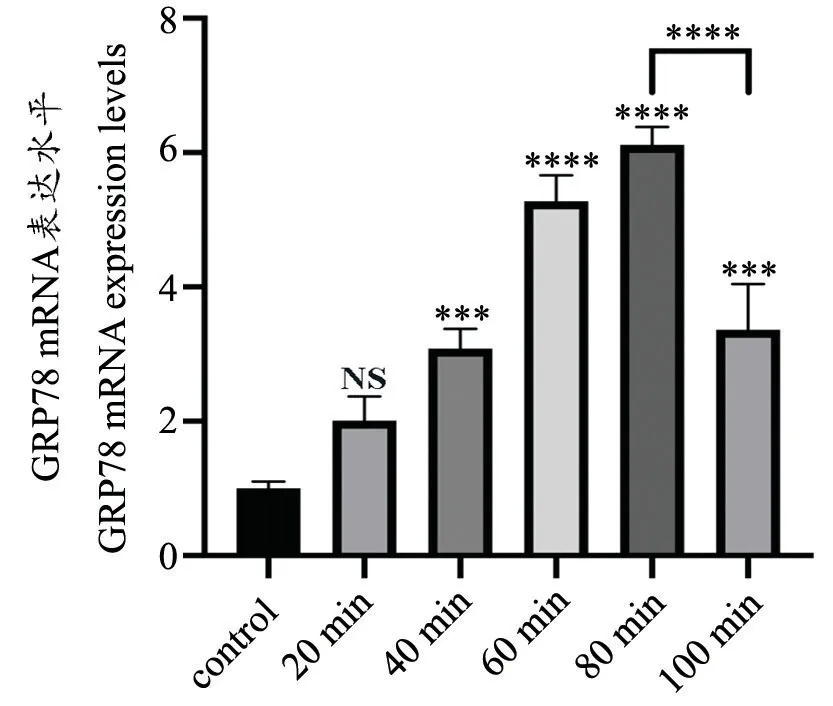
图6 各组SD 大鼠GRP78 mRNA 表达水平与对照组相比较,***P<0.001,****P<0.0001 与缺血80 min 组相比,****P<0.0001Fig.6 GRP78 mRNA expression levels in each group***P<0.001,****P<0.0001,compared with the control group,****P<0.0001,compared with the 80 min group
2.5 GRP78 蛋白表达水平
由图7 可得,与对照组相比损伤组缺血20 min 时GRP78 蛋白表达量明显升高(与对照组相比P=0.0027),在缺血80 min 时GRP78 蛋白表达量达到峰值(与对照组相比P<0.0001);与损伤组缺血80 min 时GRP78 蛋白表达量相比,在缺血100 min 时GRP78 蛋白表达量略有下降(与损伤组缺血80 min 时间点相比P>0.05),与PCR 结果基本一致。
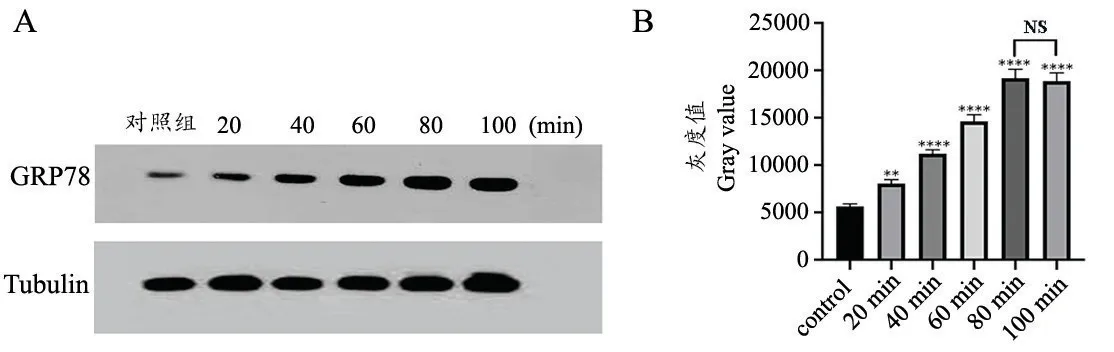
图7 各组SD 大鼠GRP78 蛋白表达水平 A: GRP78 蛋白表达条带; B: GRP78 蛋白表达灰度值与对照组相比较,***P<0.001,****P<0.0001 与缺血80 min 组相比,P>0.05Fig.7 GRP78 protein expression level in each groupA: GRP78 protein expression band; B: protein expression gray value**P<0.01,****P<0.0001,compared with the control group,P>0.05,compared with the 80 min group
2.6 术后各组大鼠两周的存活率
由表1 可得,对照组和缺血时间在20 min,40 min组的大鼠全部存活,存活率为100%;缺血时间为60 min 的大鼠,存活了5 只,存活率为71.4%;缺血时间为80 min 的大鼠存活了2 只,存活率为28.6%;缺血时间为100 min 的大鼠存活了1 只,存活率为14.3%。随着缺血时间的延长,大鼠存活率逐渐降低。
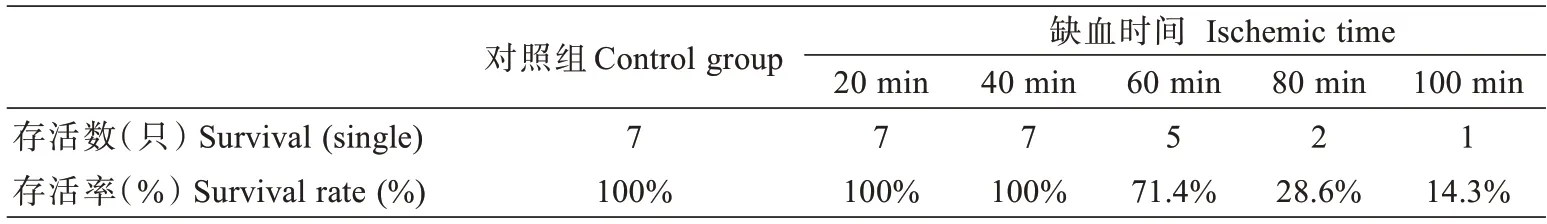
表1 术后各组大鼠两周的存活率Tab.1 Two-week survival rate of rats in each group after operation
2.7 不同缺血时间小肠损伤程度与GRP78 蛋白表达水平的相关性分析
由图8 可得,在80 min 之前,随着缺血时间的延长,小肠损伤程度逐渐加重,GRP78 蛋白表达水平也逐渐增加,小肠损伤程度与GRP78 蛋白表达水平呈正相关(R2=0.9655),在100 min 时,随着缺血时间的延长,小肠损伤程度加重,GRP78 蛋白表达水平较80 min 时降低,故100 min 的时间点为离散点。因此,小肠缺血时间在80 min 之内时,小肠损伤程度与GRP78蛋白表达水平呈正相关(R2=0.9655),100 min 时为离散点。
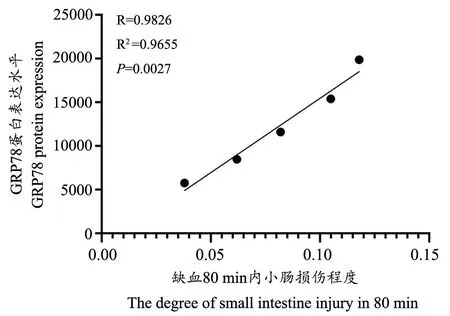
图8 不同缺血时间小肠损伤程度与GRP78 蛋白表达水平的相关性分析Fig.8 Correlation analysis between the degree of small intestine injury and GRP78 protein expression at different ischemic times
3 讨论
GRP78 是热休克蛋白70(HSP70)家族的成员,它在所有真核生物的内质网上都有发现[6],具有纠正错误折叠和装配,防止错误折叠的蛋白质或蛋白亚基运输的功能。GRP78 具有非伴侣功能,它是内质网中Ca2+的主要结合蛋白,维持内质网管腔中的Ca2+平衡[7]。GRP78 的表达与内质网的活动直接相关,当某种原因导致内质网出现应激反应时,GRP78 的表达量便会升高,以维持内质网功能的稳定[8]。Wang 等发现,敲除纯合小鼠的GRP78 基因,小鼠会出现大量的细胞凋亡,直至死亡[9]。随着更深入的研究,发现GRP78 基因具有抗凋亡的作用,对细胞活力至关重要[10]。研究发现,当内质网应激反应持续发生时,过度表达的GRP78 会导致Ca2+平衡紊乱,从而影响细胞活力[11]。过度表达的GRP78 会激活内质网应激反应介导的GRP78/PERK/CHOP 凋亡信号通路,引起细胞凋亡[12]。在外科手术中,严重的创伤、机械损伤、小肠移植手术等均会导致缺血再灌注损伤,因此研究不同缺血时间与GRP78 的表达规律,对小肠缺血再灌注损伤的临床诊断提供了进一步的理论依据。
小肠缺血再灌注损伤后,由于小肠细胞缺血缺氧导致Ca2+超载、自由基增多、炎症反应以及内质网应激反应,促使GRP78 的表达量显著升高[13]。Senol Ardic 等研究发现,GRP78 是小肠缺血再灌注损伤后内质网应激反应的标志物,GRP78 表达量与小肠缺血再灌注损伤的程度密切相关[14]。
本实验中,HE 结果显示,与对照组相比损伤组随着缺血时间的延长小肠绒毛及粘膜损伤程度逐渐增加;TUNEL 结果显示,与对照组相比损伤组随着缺血时间的延长小肠绒毛及粘膜细胞凋亡水平逐渐增加;ELISA 结果显示,与对照组相比损伤组随着缺血时间的延长DAO 的表达水平逐渐升高,在缺血60 min 时SD 大鼠DAO 的表达水平第一次出现明显升高的现象,而DAO 是肠粘膜损伤的标志物之一,这说明随着缺血时间的延长肠粘膜损伤程度逐步加重,在60 min时间点肠粘膜第一次出现明显的损伤;PCR 结果显示,与对照组相比损伤组缺血40 min 时GRP78 mRNA 的表达水平明显升高,并且在缺血80min 时达到峰值,与损伤组缺血80 min 时间点GRP78 mRNA的表达水平相比,在100 min 时GRP78 mRNA 的表达水平显著下降;WB 结果显示,与对照组相比损伤组随着缺血时间的增加,GRP78 蛋白表达量表达量逐渐升高,在80 min 时间点达到峰值,与损伤组缺血80 min 时GRP78 蛋白表达量相比,在缺血100 min 时GRP78 蛋白表达量略有下降。观察术后大鼠的存活情况可知,对照组、20 min 组、40 min 组大鼠的存活率为100%,说明这三组的损伤并不明显,依靠大鼠的自愈能力可以自愈,60 min 组、80 min 组、100 min 组的大鼠存活率显著降低,说明这三组的损伤明显,大鼠不能自愈。由图8 不同缺血时间小肠损伤程度与GRP78 蛋白表达水平的相关性分析可知,小肠缺血时间在80 min 之内时,小肠损伤程度与GRP78 蛋白表达水平呈正相关,100 min 时为离散点。
结合以上实验结果表明,大鼠小肠缺血时间小于80 min 时,随着缺血时间的增加,大鼠小肠损伤程度逐渐加重,小肠绒毛及粘膜层细胞凋亡水平逐渐增加,GRP78 的表达水平也逐渐增加;当缺血时间大于80 min 时,大鼠小肠绒毛及粘膜层细胞凋亡增加,而GRP78 的表达水平减弱。有研究表明,内质网应激反应会使GRP78 的表达水平升高,抑制CHOP 的表达,达到保护小肠细胞的作用[14]。但是GRP78 的保护作用有限,随着缺血时间的延长,损伤程度逐渐加重,内质网应激反应长时间得不到调节,GRP78 便会激活内质网应激反应介导的GRP78/PERK/CHOP 凋亡信号通路,从抗凋亡因子转变为促凋亡因子,促进CHOP、Caspase-12、PERK 等凋亡因子的表达,此时细胞发生不可逆的凋亡,水解酶等促进细胞凋亡的酶活性升高,基因活性降低,GRP78 表达量降低[12,15~17]。本次实验结果与该研究结论基本一致。
综上所述,本研究检测了缺血时间与小肠损伤程度和GRP78 表达量之间的关系,本研究初步证实了随着小肠缺血时间的延长,GRP78 表达量并非一直增加,当缺血损伤过于严重时,GRP78 的表达量会降低,在缺血80 min 之前grp78 表达量与小肠损伤程度呈正相关,在100 min 时间点,小肠损伤程度较80min 时增加,grp78 表达量较80 min 时减少。本研究为小肠缺血再灌注损伤的临床诊断提供了进一步的理论依据。
