英国《肾上腺皮质功能减退患者围手术期糖皮质激素管理指南》解读
2022-07-29田鹤陈康安平
田鹤,陈康,安平
1解放军总医院第一医学中心内分泌科,北京 100853;2鸡西鸡矿医院内分泌科,黑龙江鸡西 158100
肾上腺皮质功能减退(adrenal insufficiency,AI)按照病因分为原发性和继发性。原发性肾上腺皮质功能减退(primary adrenal insufficiency,PAI)又称为Addison病,是由于自身免疫、结核、肿瘤等原因破坏了90%以上的肾上腺所致[1];继发性肾上腺皮质功能减退(secondary adrenal insufficiency,SAI)是由于垂体分泌促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)不足,或下丘脑分泌促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)不足所致,常见于下丘脑及垂体病变。此外,过量应用外源性糖皮质激素也可抑制下丘脑-垂体-肾上腺(hypothalamus-pituitary-adrenal,HPA)轴的功能,进而导致AI,也称为三发性AI。SAI常因ACTH降低所致,但对肾素-血管紧张素-醛固酮系统无影响,需与PAI区分。
手术作为一种应激反应,可使血清皮质醇分泌明显增加,为平时的5~10倍(即75~150 mg/d)[2]。PAI及SAI患者在围手术期给予常规剂量的糖皮质激素可诱发肾上腺危象。长期应用糖皮质激素可抑制HPA轴功能,使肾上腺萎缩,导致皮质醇产生减少,如在围手术期未识别此类患者或未给予应激剂量的糖皮质激素,可发生肾上腺危象,使病死率增高,这是麻醉医师及临床医师经常遇见的情况。但以往关于AI的指南大多未对围手术期患者如何应用糖皮质激素进行详细阐述。基于此,英国麻醉医师协会联合英国皇家医师学会、英国内分泌学会于2020年2月共同发布了《肾上腺皮质功能减退患者围手术期糖皮质激素管理指南》[3],旨在帮助临床医师甄别围手术期需要进行糖皮质激素替代治疗的患者,使其得到合理而充分的替代治疗,避免肾上腺危象的发生。该指南针对糖皮质激素的生理及药理学、AI的流行病学、AI与肾上腺危象、围手术期糖皮质激素的补充等5个方面形成了8项推荐意见,本文就其重点内容进行解读,以期更好地为临床服务。
1 糖皮质激素的生理学特征
皮质醇是人体自身分泌的最主要的糖皮质激素,分泌量约20 mg/d,由肾上腺皮质束状带产生,其分泌受ACTH的直接调控及CRH的间接调控,呈脉冲式分泌,并具有一定昼夜节律,因而血浆皮质醇在清晨的参考范围为140~700 mmol/L,在午夜仅为80~350 mmol/L。皮质醇具有脂溶性,在体内有60%~80%的皮质醇与皮质醇结合球蛋白结合,另有15%~35%的皮质醇与白蛋白结合,而游离皮质醇的比例仅占5%左右。在无并发症的择期大手术后,皮质醇的分泌可增加至日常基线的5倍左右,24 h分泌量高达100 mg,通常在术后24~48 h恢复至基线水平[4]。然而,在长期危重症患者中,由于机体代谢率以及血浆清除率降低,其血浆皮质醇浓度较基线有所升高[5]。
2 糖皮质激素的药理学特征
推荐意见1 因地塞米松缺乏盐皮质激素活性,不建议用于PAI患者的糖皮质激素替代治疗。
常用于临床的糖皮质激素类药物包括氢化可的松、泼尼松和地塞米松等。因不同的糖皮质激素类药物分子结构不同,故药效、活性及代谢方式不同,如在甾体上增加C1=C2双键,则抗炎作用增强,盐皮质激素活性降低。地塞米松因在甾体C-9α上氟化,其抗炎活性提高,对HPA轴的抑制作用明显。由于PAI既有盐皮质激素缺乏又有糖皮质激素缺乏,故不建议将地塞米松用于PAI患者围手术期的激素替代治疗。各类常用糖皮质激素类药物的药理特性见表1。
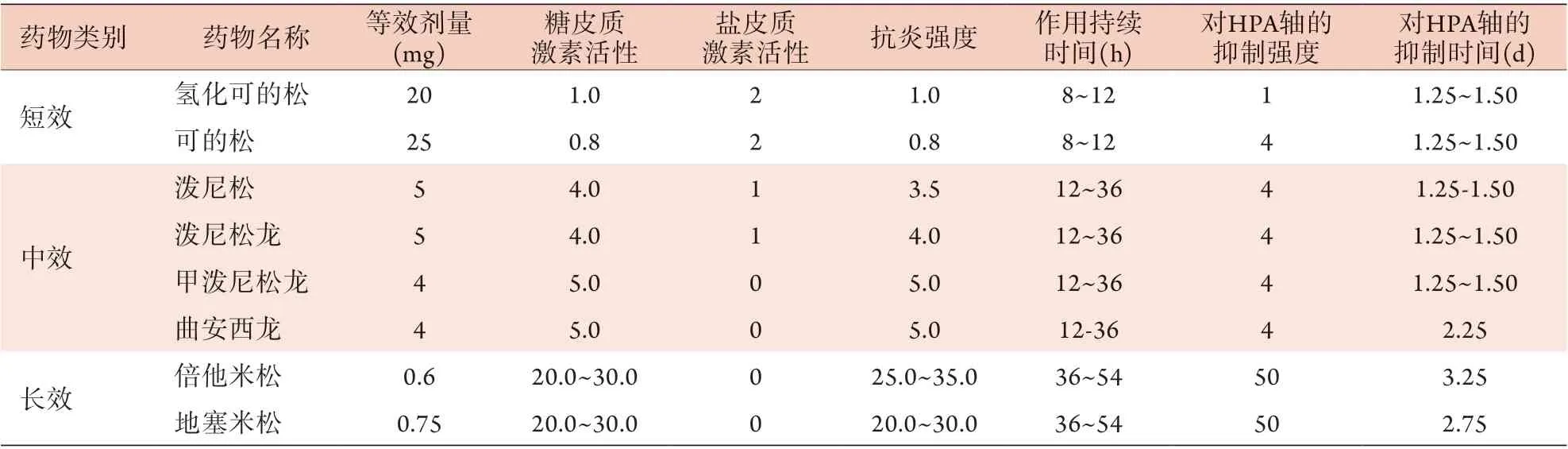
表1 常用糖皮质激素类药物的药理特性比较Tab.1 Comparison of the pharmacological properties of commonly used glucocorticoids
氢化可的松的血浆清除半衰期约为90 min,但在服用肝酶CYP3A4诱导剂[6]或患有甲状腺功能亢进的患者中其半衰期变短,而在危重症患者中半衰期较长。在围手术期,氢化可的松可通过肌肉或静脉注射给药,但近来有研究表明,静脉注射更有利于在应激时维持血浆皮质醇浓度,故推荐在术后采用静脉注射的方式进行替代治疗,而无法通过静脉注射给药时可行肌内注射。
基于AI患者在围手术期发生肾上腺危象的个案报道,有学者提出,对于应用CYP3A4诱导剂或成年肥胖的AI患者,糖皮质激素替代治疗所需剂量较通常更高[7]。临床医师应更多关注此类患者,及时增加替代治疗剂量以避免发生肾上腺危象,给药方式以连续静脉输注氢化可的松为宜。
依托咪酯是一种常用的麻醉诱导剂,可抑制皮质醇生物合成的催化酶11β-羟化酶,进而抑制皮质醇的产生。然而,大手术或高危手术前曾接受依托咪酯麻醉诱导的患者是否需补充糖皮质激素,目前相关研究证据不足,且各方意见不尽相同。一项前瞻性随机对照研究提示未发现依托咪酯对HPA轴的抑制作用[8],但有少数个案报道了长期使用依托咪酯的ICU患者的不良结局[9]。
3 AI的流行病学
外源性应用糖皮质激素可抑制HPA轴,包括口服、吸入、鼻腔或关节内注射等各种给药途径[10-11]。有研究表明,每1000例中即有7例需要长期应用糖皮质激素治疗的相关疾病,因此,存在AI潜在风险的患者或许并不少见[12]。
据报道,儿童PAI的患病率为1/(8000~10 000),其中先天性肾上腺皮质增生是最常见的病因,每15 000名活产儿中即有1名先天性肾上腺皮质增生患儿。儿童SAI患病率约为1/10 000,可由下丘脑或垂体发育异常引起,也可由中枢神经系统肿瘤及其相关治疗所致。此外,糖皮质激素还广泛应用于哮喘、肾病、幼年慢性关节炎、炎症性肠病及假性肥大型肌营养不良症等儿童疾病的治疗。因此,尽管儿童AI的患病率尚无确切数据,但可以预计儿童患者亦并不少见[13]。
4 AI与肾上腺危象
迄今为止,唯一的一项关于AI的前瞻性队列研究共纳入423例患者,该研究结果显示,AI患者的高病死率主要归因于心血管疾病、恶性肿瘤和传染病,但肾上腺危象亦可导致患者死亡,每100例患者年均发生8.3次肾上腺危象,而在2年的随访期间内仅2例患者死于肾上腺危象[14]。
一项回顾性研究发现,既往发生肾上腺危象的AI患者中,8.6%是由于糖皮质激素替代不足所致[15]。另有研究发现,约50%的AI患者曾发生肾上腺危象,多数诱因为胃肠道感染、发热,也可由手术、妊娠、情绪波动及其他应激事件所引起[16]。此外,合并有基础疾病的患者更易发生肾上腺危象,尤其是哮喘及糖尿病患者。
肾上腺危象又称急性AI,常发生在肾上腺无法产生足够的皮质醇以应对需求增加时,是AI最严重的表现,由于其可危及生命,故早期识别至关重要。肾上腺危象最主要的临床特点为低血压(收缩压<100 mmHg或收缩压下降>20 mmHg)和低血容量,常伴有非特异性的临床症状如厌食、恶心、呕吐、腹痛、疲劳、体位性眩晕、发热及意识改变,实验室检查通常表现为低钠血症、高钾血症(PAI患者)、低血糖(儿童多见)。这些非特异性症状及实验室检查与轻度AI相似,因此,既往已经诊断为PAI,但无血流动力学改变或低血压证据,如出现明显急性临床症状,通常认为是肾上腺危象前期,可给予氢化可的松以避免发生肾上腺危象[17]。术中或术后肾上腺危象的特点为无法解释的低血压或休克,常规纠正低血容量和电解质紊乱的措施无效。
5 围手术期糖皮质激素替代治疗
5.1 接受糖皮质激素治疗者
推荐意见2 当成人使用泼尼松5 mg/d以上(或其他等效剂量激素),或儿童应用氢化可的松10~15 mg/(m2.d)以上(或其他等效剂量激素)时,无论是哪种给药途径(口服、吸入、鼻内、关节内等),均需警惕出现HPA轴抑制。
目前尚未明确外源性糖皮质激素抑制成人肾上腺皮质功能的最小剂量,有研究提出应用5 mg以上泼尼松龙超过1个月时可对肾上腺皮质功能产生抑制作用[16-17],另一项针对每日接受5~20 mg泼尼松龙治疗患者的研究显示,部分患者在静脉注射250 µg ACTH(1-24)刺激后,其血浆皮质醇浓度仍低于正常值下限[18]。以上研究结果虽未能给出精确的剂量-反应关系,但相关结果均提示,应用相当于5 mg以上泼尼松龙的糖皮质激素治疗,可能与肾上腺皮质储备功能减退有关。
推荐意见3 所有糖皮质激素依赖型患者均可能因手术应激或疾病诱发肾上腺危象,识别及诊断这种医疗紧急情况至关重要。对是否需要糖皮质激素治疗存在疑问时,应给予糖皮质激素;短期给予糖皮质激素无长期不良后果。
临床实践中,部分医师由于担心糖皮质激素的不良反应,对糖皮质激素替代治疗的态度较谨慎,然而在无并发症的手术中短期应用糖皮质激素不会引起长期不良后果。因此,在对围手术期患者是否需要进行糖皮质激素替代治疗存有疑问时,可优先考虑进行替代治疗。替代治疗过程中,应根据患者具体情况制定个体化的方案,同时兼顾糖皮质激素缺乏或过量所致的不良事件风险,并充分考虑手术应激,全面制定包括剂型、剂量、治疗时间、治疗条件等因素的治疗方案。进行糖皮质激素替代治疗后,需警惕的主要不良反应包括水钠潴留、血糖升高、感染和消化道溃疡,以及伤口不愈合。此外,对于术后有并发症的AI患者应转入重症监护室以应对潜在的风险。
5.2 手术应激者
推荐意见4 严重并发症和重大疾病会激发长期的应激反应。任何糖皮质激素补充均应反映应激反应模式。
外科手术是重大的应激源,当AI患者处于围手术期时,皮质醇相对缺乏可导致广泛分布于血管内皮的α肾上腺素能受体反应受损,造成血管舒缩功能进行性丧失,临床上首先表现为直立性低血压,进而表现为卧位低血压,若皮质醇相对缺乏状态持续不被纠正,严重者甚至可出现休克。
手术引起的应激反应同样具有较高的个体差异,应激水平与患者特异性、手术类型、术前准备及术后护理有关。最近一项系统评价结果显示,围手术期皮质醇水平急剧升高在开放性手术和全身麻醉的手术中最为突出,但由于各研究间测定皮质醇的方法具有较高的异质性,纳入的7项研究中仅有2项采用质谱法测定皮质醇水平,因此该证据质量不高[5]。此外,该项研究结果提示,严重并发症和重大疾病可延长应激持续时间,在制定糖皮质激素替代方案时应予以考虑。
根据Johns Hopkins标准,外科手术分为:(1)小手术(失血量<500 ml),如乳房活检、宫腔镜检查、膀胱镜检查、包皮环切术、纤维支气管镜检查、诊断性腹腔镜检查、刮宫术等;(2)中手术(失血量500~1500 ml),如甲状腺切除术、子宫切除术、子宫肌瘤切除术、膀胱切除术、胆囊切除术、髋/膝关节置换术、肾切除术和腹腔镜手术;(3)大手术(出血量可能>1500 ml),如胃肠吻合术、各段结肠癌的根治术、全胃切除术、胃癌的扩大根治术、心胸手术和颅内手术等。表2-4总结了指南建议的各类型手术的围手术期糖皮质激素替代方案。
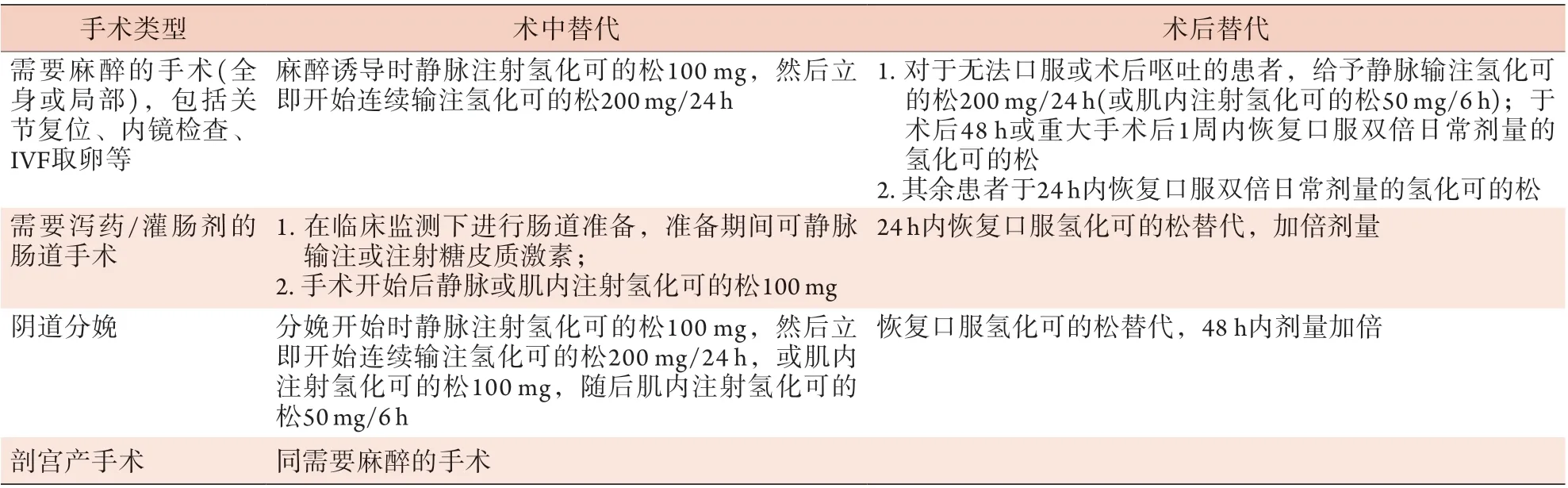
表2 PAI或SAI成人患者围手术期糖皮质激素替代方案Tab.2 Recommended doses for intra- and postoperative steroid cover in adults with primary and secondary adrenal insufficiency
5.3 肾上腺危象患者
推荐意见5 任何原因导致AI的患者,均应在麻醉诱导时静脉注射100 mg氢化可的松,随后持续静脉输注氢化可的松200 mg/24 h,直至患者可以口服双倍日常替代剂量的氢化可的松。大多数情况下应在48 h内逐步减量至适当的维持剂量,如为重大/复杂手术,应根据临床症状判断继续静脉输注氢化可的松剂量,最长不超过1周。如患者不能静脉注射则可肌内注射给药。
肾上腺危象患者围手术期的治疗原则为:在维持生理剂量替代的基础上,于应激时适当增加替代剂量。具体而言,建议在手术开始时静脉注射氢化可的松100 mg,随后静脉输注氢化可的松200 mg/24 h。若患者恢复情况良好,则改为口服双倍常规替代剂量的氢化可的松,持续48 h,并在手术后持续1周,随后恢复日常替代剂量(如平日三餐替代剂量是10 mg-5 mg-5 mg氢化可的松,若患者恢复良好,1周内加量至20 mg-10 mg-10 mg);若患者自觉不适或处于重症监护中,则继续静脉输注应激剂量的氢化可的松。需注意的是,部分处于应激的患者其血浆皮质醇水平在正常范围甚至更高时,仍可表现出肾上腺危象的症状和体征。
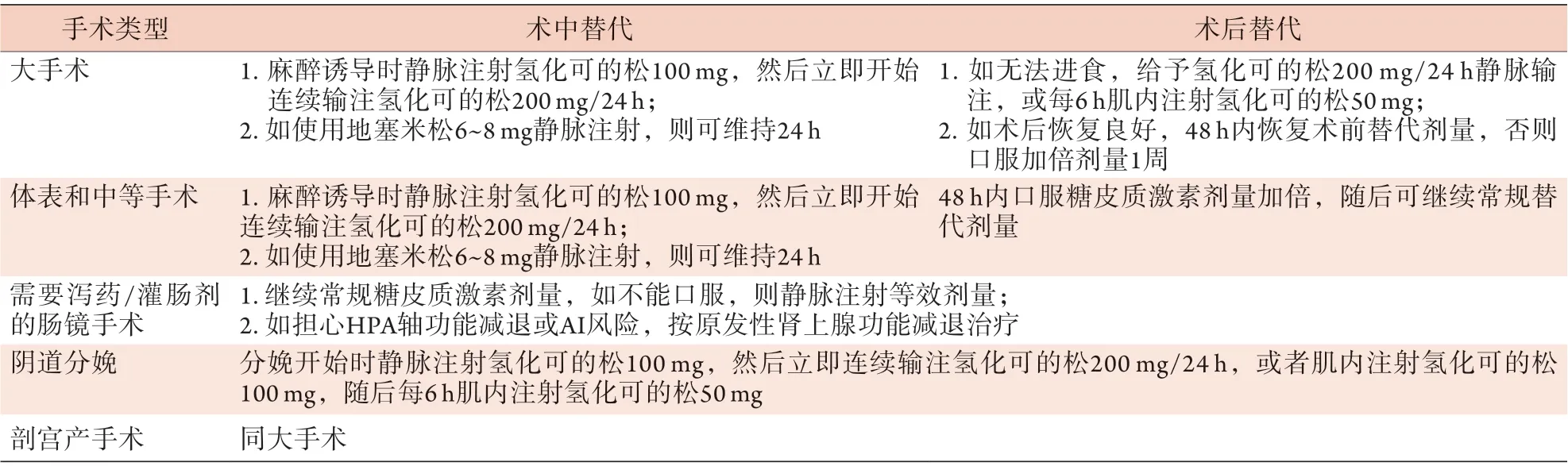
表3 成人接受肾上腺抑制剂量的糖皮质激素(相当于使用剂量≥5 mg泼尼松,且持续时间≥4周)时术中和术后糖皮质激素替代方案Tab.3 Recommended doses for intra- and postoperative steroid cover in adults receiving adrenosuppressive doses of steroids(prednisolone equivalent ≥ 5 mg for 4 weeks or longer)
5.4 日间病房手术患者 AI患者无须禁止日间病房手术,前提为患者出院时一般状况良好且并未出现恶心或呕吐症状;若出现恶心或呕吐症状时,应立即返院进行评估,如出现发热症状,可将糖皮质激素用量加倍,并维持至少7 d[6]。
5.5 妊娠患者
推荐意见6 在妊娠晚期(20周后)AI患者需给予更高替代剂量的糖皮质激素。
于妊娠期首次发现AI的情况较为少见,妊娠本身并不影响疾病的严重程度,但由于AI与妊娠的体征和症状有所重叠,可能导致妊娠期AI患者的诊断延迟。正常生理条件下,妊娠期血清总皮质醇和游离皮质醇通常可升高20%~40%,故建议对妊娠晚期(20周后)AI患者给予更高替代剂量的糖皮质激素[6,19]。在分娩开始后,即至少每5 min宫缩1次并持续1 h以上,或宫颈扩张>4 cm时,应静脉给予氢化可的松100 mg以补充应激剂量,随后持续静脉输注氢化可的松200 mg/24 h,或肌内注射氢化可的松50 mg/6 h,直至分娩结束后48 h。如在分娩后无并发症发生,1~3 d内糖皮质激素可减至常规替代剂量。
5.6 儿童患者
推荐意见7 肾上腺功能不全的儿童较成人更易出现血糖控制问题,需经常监测血糖。
包括成人和儿童在内的所有AI患者均应享有优先手术权,从而最大限度地减少禁水和禁食时间。与成人患者相比,儿童患者低血糖的风险更高,故术前禁食超过4 h后,应每小时监测血糖,而最大禁食时间不应超过6 h。在术前,儿童患者应按常规剂量口服或静脉输注氢化可的松直至手术,在术后应每小时监测血糖,直至恢复饮食。
所有PAI或SAI患儿,以及有糖皮质激素缺乏风险的儿童[外源性糖皮质激素剂量超过15 mg/(m2.d)],在术中均应静脉输注氢化可的松,具体情况及用法见表4。需特别注意的是,对于合并尿崩症的SAI患儿,需在围手术期给予额外剂量的氢化可的松,以避免水中毒导致低钠血症。

表4 AI患儿围手术期糖皮质激素替代方案Tab.4 Recommended doses for intra- and postoperative steroid cover in children with adrenal insufficiency
5.7 患者教育
推荐意见8 长期被诊断为AI的患者通常对自己的疾病比较了解,麻醉医师应询问其糖皮质激素应用史,既往是否发生过肾上腺危象,以及在应激情况下的糖皮质激素用量。对围手术期及术后恢复患者糖皮质激素的用量,最佳选择仍是与内分泌专科医师合作判定。
所有长期进行糖皮质激素替代治疗的AI患者已充分了解自身的病情,可随身携带糖皮质激素警示卡、医用警示手环等[19]。应对所有患者及其家属进行病期教育,以及时调整门诊非内分泌专科诊疗时的糖皮质激素替代方案:(1)需进行抗生素治疗或牙科治疗时,应将常规口服糖皮质激素的剂量加倍,且至少维持7 d;(2)严重创伤、持续性呕吐、肠镜检查时,需静脉或肌内注射氢化可的松100 mg,随后持续静脉给予200 mg/24 h或肌内注射50 mg/6 h[6]。另外,充分了解自身病情后,AI患者可在手术时提醒医护人员增加糖皮质激素的用量,并准确说明糖皮质激素用药史、肾上腺危象病史。然而,当AI患者处于围手术期时,最佳选择仍是与内分泌专科医师进行合作。
综上所述,合理的激素治疗和平稳的麻醉管理是保证AI患者安全度过围手术期,并预防肾上腺危象发生的关键所在。目前我国AI患者围手术期糖皮质激素应用欠规范,且存在许多误区,该指南对我国AI患者围手术期合理应用糖皮质激素具有重要指导意义。然而,该指南虽对各种AI患者围手术期糖皮质激素的替代方案进行了详细阐述,但仍存在一些局限性:循证医学证据尚不充分且无推荐等级;对大手术及小手术均使用相同剂量的糖皮质激素,这可能不适用于相对简单的手术。此外,由于应激反应存在个体差异,故内分泌专科医师仍需对指南建议的糖皮质激素替代方案进行个体化评估,最终制定适用于患者的个体化方案,以避免糖皮质激素缺乏或过多引起的不良反应,实现最佳的临床预后。
