跑台运动对成年脊髓损伤小鼠运动功能及运动皮质mTOR信号通路的影响
2022-07-29詹祖雄谭波涛王昀杭赵秦刘媛李森龙在云杨策殷樱
詹祖雄,谭波涛,王昀杭,赵秦,刘媛,李森,龙在云,杨策,殷樱*
1重庆医科大学附属第二医院康复医学科,重庆 400010;2陆军军医大学特色医学中心(大坪医院)特殊环境战伤防治研究室/创伤、烧伤与复合伤国家重点实验室,重庆 400042
脊髓损伤是一种破坏性的中枢神经系统疾病,发病率不断上升[1]。脊髓损伤后机体功能缺失严重,给患者及其家庭带来了沉重的心理和经济负担。目前康复训练仍是促进脊髓损伤后功能恢复的主要手段[2-3],因其价格低廉、安全、无创而被患者广泛接受。跑台运动是一种常见的康复训练方式,可提升机体耐力,且具有潜在的促进神经损伤修复的作用。既往研究发现,跑台运动可促进脊髓损伤后脊髓神经营养因子,如脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)等的表达[4-5],继而影响对应受体如酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)、IGF-1受体(insulin-like growth factor 1 receptor,IGF-1R)等的磷酸化,激活下游哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路[6-7],从而有利于神经元的存活。最近研究发现,mTOR信号通路激活是促进成体内源性轴突再生的重要影响因素[8-9]。因此,采用跑台运动干预神经损伤具有良好的应用前景,但其对大脑运动皮质的影响尚不清楚。有研究发现,跑台运动后,成年小鼠运动皮质中神经营养因子表达增加、mTOR信号通路激活且运动学习能力增强[10]。本团队前期研究发现,跑轮运动(以最大运动速度的50%)后,成年小鼠运动皮质中BDNF、IGF-1表达增加,且神经传导速度加快[11]。本研究探讨跑台运动对脊髓损伤小鼠运动皮质中神经营养因子表达及mTOR信号通路的影响,以期为脊髓损伤治疗提供新的理论依据。
1 材料与方法
1.1 主要试剂及仪器 BCA蛋白定量试剂盒、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(美国Thermo公司);BDNF、磷酸化酪氨酸激酶受体B(phosphorylated tyrosine kinase receptor B,p-TrkB)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)、磷酸化核糖体S6蛋白(phosphorylated ribosomal S6 protein,p-S6)、磷酸化胰岛素样生长因子1受体(phosphorylated insulinlike growth factor 1 receptor,p-IGF-1R)、蛋白激酶C-γ(protein kinase C-γ,PKC-γ)抗体(美国CST公司);IGF-1抗体(上海Absin公司);β-actin抗体(武汉Proteintech公司);神经元特异核蛋白(neuronspecific nuclei protein,NeuN)抗体(美国Millpore公司);荧光二抗(美国Jackson实验室)。小型垂直电泳仪(美国Bio-Rad公司);化学发光成像仪(上海Tanon公司);冷冻切片机(美国Thermo公司);A1+R激光共聚焦显微镜(日本Nikon公司)。
1.2 实验动物及分组 3 0 只健康成年雌性C57BL/6J小鼠(6~8周龄,体重20~25 g)购自湖南斯莱克景达实验动物有限公司,于20~25 ℃、40%~60%相对湿度、12 h/12 h昼夜节律的SPF环境下分笼饲养,自由摄入食物和水。随机分为假手术组、模型组与跑台运动组,每组10只。假手术组仅打开椎板,模型组和跑台运动组给予C5钳夹损伤。本研究经重庆医科大学附属第二医院伦理委员会审批[(2020)161],所有操作均遵守《医学实验动物管理实施细则》的要求。
1.3 C5钳夹损伤模型制备 模型组和跑台运动组小鼠进行3 d跑台运动预训练后,制备脊髓损伤模型。腹腔注射0.5%戊巴比妥钠(50 mg/kg)麻醉,备皮消毒后俯卧位固定于手术台上;使用27号手术刀切开颈部皮肤,钝性分离肌肉与筋膜,暴露椎板。定位C5棘突,用咬骨钳移除椎板,避免伤及软脊膜;使用26号针在脊髓后角灰质部分刺破软脊膜,用改良FST Dumont 5号手术钳沿针孔刺入脊髓背角灰质(约1 mm),对C5背侧皮质脊髓束(dorsal corticospinal tract,dCST)进行钳夹损伤,维持15 s,重复1次;再次将改良FST Dumont 5号手术钳的一侧尖端刺入左侧脊髓背侧(约0.8 mm),另一侧尖端置于脊髓外侧,钳夹红核脊髓束(rubro-spinal tract,RST)和皮质脊髓侧束,维持15 s,重复1次(图1A)。损伤后显微镜下可见一条明显的钳夹损伤痕迹(图1B)。术后逐层缝合颈部肌肉及皮肤,并用碘伏涂抹消毒。待小鼠苏醒,观察无异常后放回饲养笼。每日观察小鼠一般情况,有排尿困难的小鼠给予人工挤压膀胱,协助尿液排出。
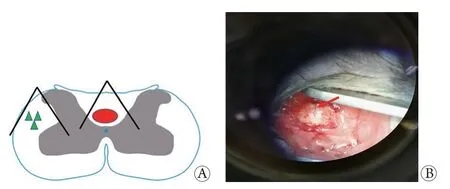
图1 C5钳夹损伤小鼠模型及伤后损伤痕迹Fig.1 Schema of C5 crush injury model and scar post-injury
1.4 跑台运动 造模1周后开始正式跑台运动。训练期间对小鼠进行最大运动速度检测,具体为以9 m/min的速度热身5 min,然后以a=1 m/min2的加速度逐渐加速,直至小鼠停留在电击区域被连续电击大于10次且不再跑动[12],则认为其力竭,定义此时的速度为最大运动速度。以最大运动速度的50%进行跑台运动,30 min/次,1次/d,5 d/周,持续4周;假手术组和模型组小鼠仅置于跑步机上,不进行运动。
1.5 C5钳夹损伤模型验证 PKC-γ可特异性标记dCST,C5钳夹损伤后,由上至下的皮质脊髓束无法下行至胸段dCST区域而使PKC-γ染色呈阴性,因此对小鼠胸段脊髓冠状切片进行免疫荧光染色可鉴定造模是否成功,对小鼠颈段脊髓矢状切片进行免疫荧光染色可确定损伤范围。
跑台运动结束后,取所有小鼠颈段和胸段脊髓,于4%多聚甲醛磷酸盐缓冲液中固定,不同浓度蔗糖溶液(18%、24%、30%)梯度脱水;经OCT包埋后使用冷冻切片机分别进行矢状位和冠状位切片;经PBS洗涤、0.3% Triton X-100通透、5%驴血清封闭后,加入GFAP(1:2000)、PKC-γ(1:200)一抗孵育;洗涤后,加入Alex Fluor-488、Alex Fluor-594偶联驴抗兔IgG(1:500)二抗孵育,封片后采集免疫荧光图像。若伤后脊髓胸段dCST区域PKC-γ染色呈阳性,则表明C5钳夹损伤模型失败,将该小鼠剔除。1.6 行为学检测 分别于伤前(0 d)及伤后3 d、1周、3周和5周进行水平楼梯和圆筒攀爬实验。实验正式开始前,将动物放入水平楼梯和圆筒内适应环境并预训练3 d(1次/d)。
1.6.1 后肢踏步运动功能检测 将小鼠放入一个固定场所,观察其后肢运动、躯干位置和稳定性、步态协调性、爪及尾的位置等变化,采用BMS(Basso Mouse Scale)评定小鼠后肢踏步运动功能[13],完全截瘫为0分,正常为9分。于伤前(0 d)及伤后1、3、5、7、14 d分别进行伤前基线水平和伤后水平检测。
1.6.2 水平楼梯实验 水平楼梯跑道由两块透明有机玻璃板(80 cm×50 cm)和若干金属横梯构成,每个横梯间距1.3 cm。将动物饲养笼置于跑道末端接取动物,使用摄像机记录小鼠跑过31个横梯的情况。每次实验前随机抽掉5根横梯使跑道间隔不规律分布(最大间隔为2个横梯)。实验结束后,逐帧分析左前、左后肢踩空和滑落横梯的情况,计算错误步数占总步数的比率[14]。
1.6.3 圆筒攀爬实验 将小鼠放置在透明有机玻璃圆筒(直径15 cm、高20 cm)内,使用摄像机记录直立状态下使用前肢攀爬圆筒壁的偏好程度,以直立状态下前肢接触筒壁,然后放回地面记为一组。实验结束后,分析前10次圆筒攀爬情况,最长观察15 min[14],计算使用左前肢进行攀爬的比率。
1.7 Western bloはing检测运动皮质中BDNF、IGF-1、p-TrkB、p-IGF-1R、p-Akt、p-S6的表达 跑台运动结束后,各组取4只小鼠灌注,取右侧大脑运动皮质,称重后放入匀浆器中,加入适量RIPA裂解液(每1 mg组织加入5 µl裂解液)进行研磨和超声破碎;置于冰上裂解20~30 min,12 000×g离心20 min,取上清;BCA法测定蛋白浓度,加入上样缓冲液煮沸10 min;取30~50 µg蛋白上样,行SDS凝胶电泳,并转至PVDF膜上,加入5%脱脂奶粉封闭1~2 h;加入BDNF(1:1000)、IGF-1(1:500)、p-TrkB(1:1000)、p-IGF-1R(1:1000)、p-Akt(1:1000)、p-S6(1:1000)一抗4 ℃孵育过夜;次日洗膜,加入HRP标记的山羊抗小鼠IgG(1:2000)和山羊抗兔IgG(1:3000)二抗室温孵育1 h;洗膜,使用ECL化学发光成像仪(Tanon)显影曝光,使用ImageJ软件分析目的条带灰度值。实验重复5次。
1.8 免疫荧光染色检测运动皮质中S6蛋白的磷酸化水平 跑台运动结束后,各组取4只小鼠灌注,取出完整大脑,于4%多聚甲醛磷酸盐缓冲液中固定24 h,蔗糖梯度(18%、24%、30%)脱水、OCT组织包埋,采用冠状位切片,厚度18 µm。
用0.01 mol/L PBS洗涤切片5 min×3次,0.3%TritonX-100室温孵育30 min,0.01 mol/L PBS洗涤5 min×3次,5%驴血清封闭45~60 min,加入NeuN(1:800)、p-S6(1:200)一抗室温孵育过夜;次日用0.01 mol/L PBS洗涤5 min×3次,加入Alex Fluor-488偶联驴抗豚鼠IgG(1:500)、Alex Fluor-594偶联驴抗兔IgG(1:500)二抗37 ℃下孵育45 min;用0.01 mol/L PBS洗涤5 min×3次,晾干,使用防淬灭封片剂封片,于共聚焦显微镜下采集图像,ImageJ软件分析p-S6染色荧光强度。
1.9 统计学处理 采用GraphPad Prism 8.0软件进行统计分析。定量数据以表示,多组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用Bonferroni检验。P<0.05为差异有统计学意义。
2 结 果
2.1 C5钳夹损伤模型验证结果 颈段脊髓免疫荧光染色结果显示,C5钳夹损伤后,小鼠颈髓损伤区域大量星形胶质细胞增生,可见明显瘢痕形成及损伤(图2A)。PKC-γ免疫荧光染色结果显示,损伤小鼠胸段dCST区域PKC-γ染色呈阴性,而正常小鼠呈阳性(图2B)。根据PKC-γ免疫荧光染色结果,跑台运动组和模型组各剔除2只小鼠,最终跑台运动组和模型组各入组8只,假手术组数量与此保持一致。
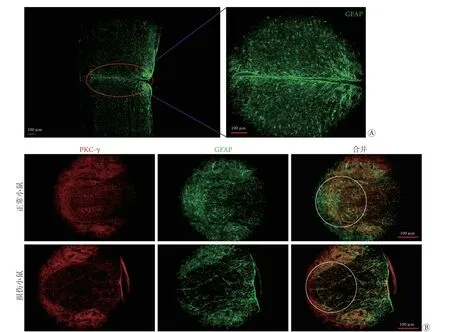
图2 C5钳夹损伤后颈段和胸段脊髓免疫荧光染色结果Fig.2 Cervical and thoracic spinal cord of mice after C5 crush injury (Immunofluorescence staining)
2.2 行为学检测结果
2.2.1 各组小鼠C5钳夹损伤前后BMS评分比较
伤前三组小鼠BMS评分比较差异无统计学意义(P>0.05)。伤后1、3 d,模型组和跑台运动组BMS评分均低于假手术组(P<0.0001),但跑台运动组与模型组比较差异无统计学意义(P>0.05)。伤后7 d,模型组和跑台运动组BMS评分均恢复至基线水平(图3)。
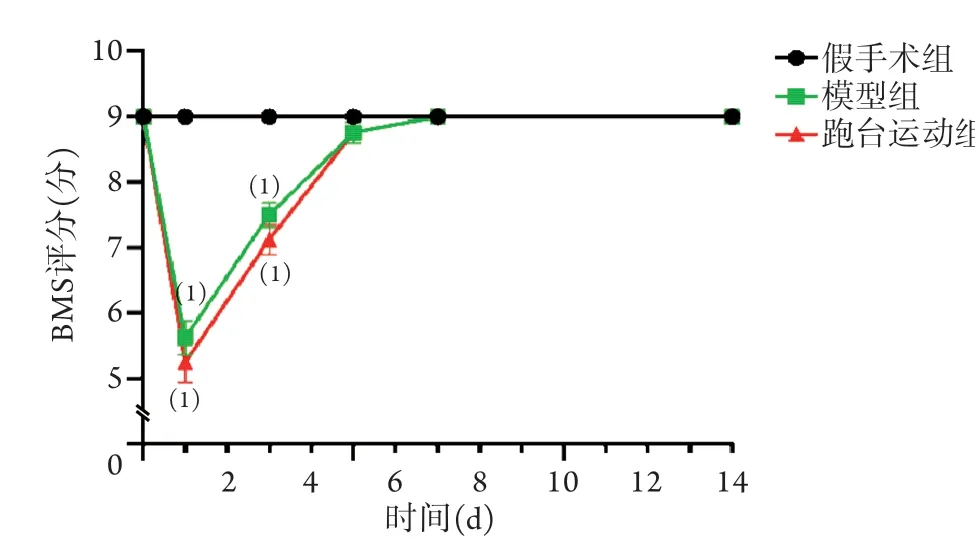
图3 C5钳夹损伤14 d内各组小鼠BMS评分(n=8)Fig.3 BMS scores of mice in each group within 14 days after C5 crush injury (n=8)
2.2.2 跑台运动对C5钳夹损伤后小鼠水平楼梯实验左侧肢体错误率的影响 伤前,假手术组、模型组与跑台运动组左前、左后肢错误率均较低,且差异无统计学意义(左前肢错误率:2.7%±1.7%vs. 1.3%±1.2%vs. 1.4%±0.9%,P>0.05;左后肢错误率:1.6%±1.4%vs. 1.1%±1.2%vs. 1.1%±0.9%,P>0.05)。伤后3 d、1周、3周和5周,模型组和跑台运动组左前、左后肢错误率均高于假手术组(P<0.001)。伤后3 d和1周,跑台运动组与模型组左前、左后肢错误率比较差异无统计学意义(P>0.05);伤后3周和5周,跑台运动组左前、左后肢错误率明显低于模型组(P<0.001) (图4A)。
2.2.3 跑台运动对C5钳夹损伤后小鼠圆筒攀爬实验左前肢使用率的影响 伤前,假手术组、模型组与跑台运动组小鼠使用左前肢攀爬圆筒壁的频率相当(25.8%±1.6%vs. 25.6%±1.7%vs. 25.4%±1.2%,P>0.05)。伤后3 d和1周,模型组与跑台运动组左前肢使用率均低于假手术组(P<0.001),但两组间差异无统计学意义(P>0.05)。伤后3周和5周,模型组左前肢使用率仍低于假手术组(P<0.001),而跑台运动组与假手术组左前肢使用率比较差异无统计学意义(P>0.05),但高于模型组(P<0.05) (图4B)。
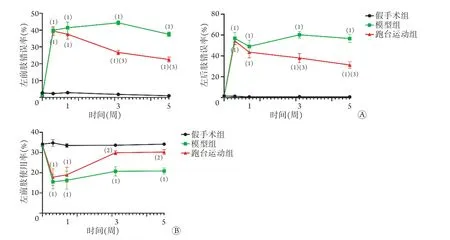
图4 C5钳夹损伤前后各组小鼠行为学检测结果(n=8)Fig.4 Behavioral test of mice in each group before and after C5 crush injury (n=8)
2.3 跑台运动对C5钳夹损伤后小鼠运动皮质BDNF、IGF-1表达及相应受体TrkB、IGF-1R磷酸化的影响 Western blotting检测结果显示,经4周跑台运动后,与假手术组比较,模型组和跑台运动组小鼠运动皮质BDNF、IGF-1蛋白相对表达水平及TrkB、IGF-1R磷酸化水平均明显降低(P<0.05);与模型组比较,跑台运动组小鼠运动皮质BDNF、IGF-1蛋白相对表达水平及TrkB、IGF-1R磷酸化水平明显升高(P<0.01) (图5)。

图5 C5钳夹损伤后各组小鼠运动皮质BDNF、IGF-1、p-TrkB、p-IGF-1R蛋白的表达(n=4)Fig.5 Expressions of BDNF, IGF-1, p-TrkB and p-IGF-1R in motor cortex of mice in each group after C5 crush injury (n=4)
2.4 跑台运动对C5钳夹损伤后小鼠运动皮质mTOR信号通路关键蛋白Akt、S6及神经元细胞S6蛋白磷酸化的影响 Western blotting检测结果显示,经4周跑台运动后,与假手术组比较,跑台运动组和模型组小鼠运动皮质Akt、S6磷酸化水平明显降低(P<0.01);与模型组比较,跑台运动组小鼠运动皮质Akt、S6磷酸化水平明显升高(P<0.01) (图6A)。
免疫荧光染色结果显示,与假手术组比较,模型组和跑台运动组小鼠运动皮质神经元细胞内p-S6染色荧光强度降低(21.21±5.38、44.62±8.39vs.61.20±7.20,P<0.01);与模型组比较,跑台运动组小鼠运动皮质神经元细胞内p-S6染色荧光强度增高(P<0.01,图6B)。

图6 C5钳夹损伤后各组小鼠运动皮质Akt、S6及神经元细胞中S6蛋白磷酸化情况(n=4)Fig.6 Phosphorylation of Akt, S6 and neuronal S6 in motor cortex of mice in each group after C5 crush injury (n=4)
3 讨 论
运动训练是促进脊髓损伤、脑损伤、脑卒中等神经损伤后运动功能恢复的有效手段,然而其促进损伤后功能恢复的分子机制尚未明确。本研究采用C5脊髓钳夹损伤模型[15],以跑台运动作为干预方式,结果显示在跑台运动后脊髓损伤小鼠运动皮质中BDNF、IGF-1表达增加,其受体TrkB、IGF-1R以及下游mTOR信号通路关键蛋白Akt、S6的磷酸化水平增高,水平楼梯实验左前、左后肢错误率降低,圆筒攀爬实验左上肢使用率增高,该结果为运动促进神经损伤的修复提供了新的证据。
C5脊髓钳夹损伤模型不同于既往常见的脊髓损伤模型如脊髓撞击挫裂伤、脊髓背侧半切等[16],这些模型存在不能特异性损伤脊髓传导束、损伤范围大、不便进行行为学评价等不足。Hilton等[14]发现,在C4和C6节段分别损伤小鼠背外侧束后,后者前肢运动功能自我恢复明显,提示C6节段背外侧束损伤可能不利于观察伤后的行为学变化;Hollis等[17]发现,控制小鼠前肢的颈髓节段为C5及以下节段。因此,本研究选择在C5节段损伤dCST和左侧RST。CST和RST对啮齿动物精细运动功能的控制十分重要,影响小鼠的随意运动[18],损伤dCST和左侧RST后主要影响左前肢的精细运动,而对小鼠右前肢及下肢步行功能影响较小,既能满足损伤小鼠进行一定强度跑台运动的要求,又便于观察干预后运动功能的恢复情况。
国内外研究发现,运动促进神经损伤修复可能与上调神经营养因子的表达有关[4,19-20]。跑台运动可增加胸段脊髓损伤大鼠脊髓内BDNF、胶质细胞源性神经营养因子(glial cell derived neurotrophic factor,GDNF)、神经营养因子3/4(neurotrophin-3/4,NT-3/4)、IGF-1等的表达,减少神经元细胞凋亡,挽救残存的脊髓运动神经元[5,21]。Li等[22]发现,阻断脊髓BDNF-TrkB信号通路可抑制运动训练对不完全性脊髓损伤大鼠运动功能恢复及脊髓可塑性的促进作用。IGF-1在中枢神经系统的生长、发育、成熟、损伤修复,以及神经可塑性等方面起着重要作用[7]。Trejo等[23]发现,IGF-1是运动诱导的海马神经发生增强的重要中介,影响神经可塑性。Glasper等[24]发现,运动诱导的树突棘密度变化可因IGF-1被阻断而消除。Liu等[25]发现,跑步运动可增加脊髓损伤大鼠骨骼肌中IGF-1的表达,有效延缓损伤后的肌肉萎缩。Marchetto等[26]发现,IGF-1可通过介导自闭症谱系疾病(autism spectrum disorders,ASD)衍生的异常神经和突触发生而实现对神经元网络缺陷的挽救。本研究发现,跑台运动可促进脊髓损伤小鼠脑运动皮质神经营养因子BDNF、IGF-1的表达,提示皮质神经营养因子上调也是脊髓损伤小鼠运动功能恢复的机制之一。
BDNF与受体TrkB结合后,可促进TrkB的磷酸化[27],进一步激活多种酶,如磷脂酰肌醇-3激酶(phosphatidylin-ositol-3 kinase,PI3K)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷脂酶C-γ(phospholipase C-γ,PLC-γ)等,导致下游PI3K-Akt-mTOR、MAPK/Ras及PLC-γ依赖性信号通路等分别被激活,这与神经元存活与凋亡、神经可塑性、神经再生与分化等密切相关[6,28-29]。类似的,IGF-1与IGF-1R结合后,下游PI3K-Akt-mTOR与MAPK/ERK信号通路被激活,可从多个方面调控细胞的存活[30]。mTOR作为TrkB和IGF-1R共同的下游作用靶点,广泛参与介导运动获益的过程[31]。mTOR可影响基因转录和蛋白质的合成,调节细胞的生长、凋亡等,对运动、神经发育等具有重要调节作用[8,32]。Chen等[10]发现,运动训练增强正常小鼠运动学习能力与运动皮质mTOR信号通路激活有关。Liu等[33]发现,耐力训练可激活各年龄段大鼠脑皮质mTOR信号通路,改善皮质突触可塑性。Jung等[5]发现,运动训练可能通过激活脊髓PI3KAkt-mTOR信号通路而抑制受伤大鼠脊髓细胞的凋亡,进而促进运动功能恢复。本课题组前期研究发现,激活皮质mTOR信号通路的联合任务导向性运动训练可明显改善脊髓损伤小鼠的上肢精细运动功能[34]。新近研究发现,可卡因成瘾的小鼠经1周跑步运动干预后,可恢复由可卡因诱导的皮质突触形成缺陷,这与皮质mTOR信号通路激活引起的体内突触传递、皮质椎体神经元自发活动及运动学习能力增强密切相关[35],提示mTOR信号通路的激活可能与运动诱导的正向效应存在联系。本研究发现,跑台运动干预后脊髓损伤小鼠运动皮质TrkB、IGF-1R及mTOR信号通路关键蛋白Akt和S6的磷酸化水平均明显升高,提示跑台运动促进脊髓损伤后功能恢复可能与运动皮质mTOR信号通路激活有关
综上所述,跑台运动可增高C5脊髓钳夹损伤小鼠运动皮质BDNF、IGF-1的表达及其受体的磷酸化水平,促进mTOR信号通路的激活,这些分子表达的变化可能介导了运动诱导的功能恢复,该结果为脊髓损伤的康复治疗提供了理论依据。但本研究仅观察现象,具体分子机制有待使用mTOR抑制剂进行验证;且脊髓损伤后小鼠持续性功能丧失及恢复困难的原因不仅包含大量轴突断裂,还存在脱髓鞘等结构改变,后续研究须综合探讨跑台运动干预对轴突再生、出芽、再髓鞘化及神经可塑性等方面的影响。
