上调miR-328-5p对乳腺癌细胞增殖、迁移及侵袭能力的影响
2022-07-29李建梅孙静宜马英桥李建柱
李建梅,孙静宜,马英桥,赵 月,李建柱
miRNAs是一类长度约为18.25个碱基的内源性非编码小分子RNA,可降解mRNA并抑制翻译,主要通过与其靶mRNA的3' 端结合从而达到调节基因表达的目的[1]。miRNAs可参与细胞增殖、凋亡、代谢等生物学过程,在肿瘤等多种疾病中表达失调[2]。miRNAs也是乳腺癌的重要调节因子,其表达改变与乳腺癌的发生密切相关[3]。有趣的是,miR-328还被发现在RB143人视网膜母细胞瘤细胞分离出的ABCG2+(干细胞样)中水平比ABCG2-(非干样)中低,而miR-328在乳腺癌干细胞中的作用依然未知[4-5]。本研究旨在分析miR-328-5p在乳腺癌细胞系中的表达及上调miR-328-5p表达对乳腺癌细胞增殖、迁移及侵袭能力的影响。
1 材料与方法
1.1细胞系 乳腺癌细胞系MCF-7和MDA-MB-231及正常乳腺上皮细胞系MCF10A均购于美国ATCC细胞库。
1.2主要试剂与仪器 胎牛血清及RPMI-1640培养基购自美国Gibco公司,细胞计数试剂盒(CCK-8)购自上海碧云天公司,LipofectamineTM2000转染试剂盒购自美国Invitrogen公司,Transwell小室(批号:845116)购自吴江康宁生命科学有限公司,Matri-gel基质胶及细胞培养基均购自美国BD公司,miR-328-5p和miR-con(批号:121547)均购自上海美轩生物科技有限公司。PCR仪(Applied Biosystems ABI7500),化学发光仪(Promega 30IOC),凝胶成像系统(Bio-rad ChemiDoc XRS),透射电镜(Thermo fisher Spectra S/TEM),荧光显微镜(Olympus BX53),光学显微镜(Olympus CX33),相差显微镜(Olympus CKX53)。
1.3实验方法
1.3.1细胞培养及制备:乳腺癌细胞系MCF-7和MDA-MB-231及正常乳腺上皮细胞系MCF10A均于含10%胎牛血清的RPMI-1640培养基中培养,培养过程中加入双抗霉素-链霉素,然后置于恒温箱中恒温培养,选择对数生长期细胞进行实验。
1.3.2细胞转染:选取生长状态良好的乳腺癌细胞,分为3组:miR-328-5p组(进行miR-328-5p转染)、转染对照组(转染miR-con)及空白对照组。按照LipofectamineTM2000说明书进行瞬时转染。转染6 h后换液,继续培养用于后续实验。
1.3.3miR-328-5p表达检测:采用qPCR[6]检测miR-328-5p RNA水平。使用miRNA提取试剂盒从细胞中提取RNA,按照逆转录试剂盒Prime Script RT Reagent Kit和SYBR Prime Script miRNA RT-PCR Kit试剂盒进行逆转录和qRT-PCR。miR-328-5p反应体系为,95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火32 s,循环50次。通过计算机系统自动分析各样本Ct值,采用2-ΔΔCt法计算miRNA的相对表达量。
1.3.4细胞增殖:采用CCK-8实验[7]及平板克隆形成实验[8]检测细胞增殖能力。以3000个细胞/孔(调整细胞浓度为100 pl含3000个细胞)将处于对数生长期的MCF-7细胞铺于96孔板中,并进行转染培养。每组重复3次,培养48 h,加入CCK-8试剂10 μl,室温孵育4 h,酶标仪测定450 nm波长处的吸光度值(OD450)。以适当细胞密度将处于对数生长期的MCF-7细胞铺于细胞培养皿中进行转染分组培养,培养完成后将平皿倒扣于带网格的胶片上,计数克隆数,将>50个细胞的克隆数拍照记录保存。最后计算克隆形成率,克隆形成率=(克隆数/接种细胞数)×100%。
1.3.5细胞迁移:采用细胞划痕实验[9]检测细胞迁移情况。同“1.2.4”项下进行细胞转染分组后,用胰酶消化细胞,离心后通过无血清基础的RPMI-1640培养基重悬计数后稀释,稀释成4×106个/ml的细胞悬液,取100 μl铺于Transwell上室,下室加入600 μl含血清完全培养基。均培养24 h后,采用4%多聚甲醛固定15 min,将上室未迁移的细菌擦拭干净,结晶紫染色,记录细胞迁移数。
1.3.6细胞侵袭:行Transwell体外细胞侵袭实验[10],拍照计算细胞侵袭数,每组实验设计6个复孔。
1.4研究方法 观察不同乳腺癌细胞系中miR-328-5p相对表达量及上调miR-328-5p表达对MCF-7细胞增殖、迁移、侵袭能力的影响。

2 结果
2.1不同细胞系中miR-328-5p相对表达量比较 正常乳腺上皮细胞系MCF10A、乳腺癌细胞系MCF-7和乳腺癌细胞系MDA-MB-231中miR-328-5p相对表达量分别为1.00±0.02、0.42±0.07、0.48±0.06,miR-328-5p相对表达量正常乳腺上皮细胞系MCF10A>乳腺癌细胞系MDA-MB-231>乳腺癌细胞系MCF-7(P<0.05)。
2.2上调miR-328-5p表达对MCF-7细胞增殖能力的影响 与转染对照组和空白对照组比较,miR-328-5p组MCF-7细胞增殖率、克隆形成率均明显降低(P<0.05),转染对照组与空白对照组MCF-7细胞增殖率、克隆形成率比较差异无统计学意义(P>0.05)。见表1。
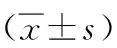
表1 上调miR-328-5p表达对MCF-7细胞增殖能力的影响
2.3上调miR-328-5p表达对MCF-7细胞迁移、侵袭能力的影响 与转染对照组、空白对照组比较,miR-328-5p组MCF-7细胞迁移、侵袭能力均明显降低(P<0.05),转染对照组与空白对照组MCF-7细胞迁移、侵袭能力比较差异无统计学意义(P>0.05)。见表2。
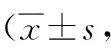
表2 上调miR-328-5p表达对MCF-7细胞迁移、侵袭能力的影响个)
3 讨论
乳腺癌是一种发生于乳腺上皮组织的恶性肿瘤,是全球女性发病率最高的恶性肿瘤[11]。目前根据相关调查资料显示:不良生活习惯、高强度工作、快节奏生活及精神压力等多种因素均与乳腺癌发病进展有着密切联系,其发病率逐渐升高[12]。手术为乳腺癌治疗的首选方案,随着对乳腺癌认知的增加、医疗技术的进步,乳腺癌的治疗取得了阶段性的进展,但关于其具体发病机制仍旧尚未明确,故探索新的分子靶点对治疗乳腺癌及改善其预后至为关键[13-14]。近年研究表明,miRNAs在乳腺癌的发生发展及恶性转化过程中起重要作用[15]。为进一步探讨miR-328-5p与乳腺癌发病、恶化之间的关系,本文以乳腺癌细胞系MCF-7和MDA-MB-231及正常乳腺上皮细胞系MCF10A为标本进行研究。
既往多项研究发现,在非小细胞肺癌、胃癌等多种恶性肿瘤进展中,长链非编码RNA或环状RNA通过调控miR-328-5p表达起关键作用,故检测miR-328-5p表达有望成为评估多种恶性肿瘤的有效手段[16-17]。MCF-7细胞与乳腺癌发生、发展密切相关。本研究结果示,乳腺癌细胞系MCF-7、MDA-MB-231中miR-328-5p相对表达量均显著低于正常乳腺上皮细胞系MCF10A,提示miR-328-5p表达与乳腺癌的发生有着密切联系。既往报道,miR-328-5p作用于乳腺癌并抑制MDA-MB-231乳腺癌细胞增殖的主要机制为靶向糖基化终产物受体[18]。本文经CCK-8、平板克隆实验得出,上调miR-328-5p的乳腺癌MCF-7细胞增殖、克隆形成能力均显著降低。另也有文献证实:circRNA-5692可通过刺激miR-328-5p增强残疾基因同源物2相互作用蛋白表达从而抑制肝癌的进展,长链非编码RNA TPTEP1竞争性抑制miR-328-5p从而抑制非小细胞肺癌细胞的增殖[19-20]。除此之外,本文通过细胞划痕实验、Transwell体外细胞侵袭实验得出,上调miR-328-5p对乳腺癌MCF-7细胞的迁移、侵袭能力有明显抑制作用,从而控制延缓乳腺癌病情的进展。推测miR-328-5p对乳腺癌细胞增殖、迁移及侵袭能力的抑制作用可能与PI3K/AKT通路的激活调节有关。
综上,miR-328-5p在乳腺癌细胞中低表达,上调miR-328-5p表达可抑制乳腺癌细胞的增殖能力和减弱迁移、侵袭能力,可能成为乳腺癌临床诊断、评估及治疗的新靶点。
