HER2 过表达结直肠癌靶向治疗的研究进展
2022-07-29陈日龙李潼张剑波朱鹏
陈日龙,李潼,张剑波,朱鹏
(重庆医科大学附属第二医院胃肠肛肠外科,重庆 400000)
0 引言
结直肠癌是最常见的消化道恶性肿瘤之一,由于其早期常无明显症状及体征,每年约有35%的患者在初诊时既已出现远处转移[1],根据目前CSCO 指南的推荐,对于终末期不可切除的结直肠癌患者,在化疗的基础上给予分子靶向治疗可显著延长患者生存时间[2];近年来随着分子病理学及基因检测方式研究的深入,结直肠癌的靶向治疗也向精准化和个体化的方向发展;有研究发现结直肠癌中亦HER2 过表达,且这类患者在西妥昔单抗抗EGFR 治疗下不能获益[3]。表面生长因子受体2 是酪氨酸激酶受体EGFR 家族成员之一,位于染色体17q21,编码185-kDa 的穿膜蛋白[4],其可通过激活RAS-RAF-ERK、PI3K-PTEN-AKT 及JAK-STAT通路在肿瘤细胞的增殖、分化、凋亡抑制和肿瘤进展方面起着至关重要的作用[5]。HER2 过表达主要出现在乳腺癌和胃癌患者中,但在肺癌、肾癌、膀胱癌及结直肠癌患者中亦有一定的表达。在结直肠癌患者中,有约5%的患者HER2 表达阳性[6]。由于针对结直肠癌患者的抗HER2 治疗近几年才逐渐应用于临床,对具体机制和治疗效果的研究还处于起步阶段,且部分结论还尚存争议,本文拟通过阐述HER2 在结直肠癌患者中的检测方式、临床意义和治疗效果等,探究抗HER2 治疗在结直肠癌患者中的治疗价值。
1 HER2 突变的检测方式
结直肠癌HER2 检测的方式与乳腺癌检测基本相同,主要为免疫组化(immunohistochemistry,IHC)和荧光原位杂交法(fluorescence in situ hybridization,FISH)[7]。其中IHC 是临床检测各类癌症蛋白的常用手段,其检测方式简单,具有高灵敏度,但因为组织定性过程中易形成偏差,因此特异性低。FISH 主要检测HER2 扩增率,具有高特异度及灵敏度,但制作过程繁琐,目前被公认为HER2 检测金标准。随着检测技术的进步,现在新型的检测方式包括二代基因测序检测(Next generation sequencing,NGS)[8]和CTDNA 技术。其中NGS 的检出率约为1.8%-22.0%,运用肿瘤组织病理分析,可以一并检测包括HER2在内的各项肠癌基因。而循环DNA 技术主要用于预后,可评估治疗疗效,分析治疗后肿瘤残留情况及疗效抵抗等[9][10]。
HER2 过表达在结直肠癌检测上尚无统一标准(具体见表1),目前主要是参照乳腺癌及胃癌的标准。确认HER2 阳性的定义主要有两种标准,一种为胃食管腺癌GEA 标准[11],其阳性定义 为(1) ≥10%的肿瘤细胞IHC3+;(2) ≥10%的肿瘤细胞IHC2+和 FISH:HER2/ 染色体着丝粒探针(CEP)17 ≥2.0。另一种为更加严格的 HERACLES 诊断标准,即将上述GEA 标准的10%更换为50%阳性,其他相关研究中也加入了NGS检测及CTDNA 技术。[12]目前国内的检测技术常停留于NGS 的检测以明确HER2 及结直肠其他基因的表达情况。
2 HER2 与结直肠肿瘤的病理关系及预后
有研究提示HER2 过表达与结直肠癌肿瘤浸润深度直接相关。一项结直肠癌组织的HER2表达的实验性研究中纳入78 例结直肠组织发现HER2 蛋白的表达与肿瘤浸润深度直接相关[13]。于姣姣等荟萃分析亦发现肠壁浸润深度浅(T1-2 期)结直肠癌患者的 HER2 扩增率低于肠壁浸润深(T3-4 期)结直肠癌[OR=0.17,95%C1(0.05,0.55),P=0.003][14]。该结论目前有大多数临床研究及meta 分析证实,HER2 过表达与局部浸润的相关性也直接影响了肿瘤转移及种植的相关情况,影响患者远期预后。
此外,HER2 基因过表达还可能促进肿瘤淋巴结转移,在一项对56 例手术切除的结直肠癌患者术后标本研究中发现,有淋巴结转移的癌组织标本中,HER2 过表达率达到93.75%,在无淋巴结转移的标本中,HER2 表达率仅为20.83%[15],于姣姣等meta 分析中也提示了淋巴结转移结直肠癌患者的 HER2 扩增率高于无淋巴结转移结直肠癌[OR=1.54,95%C1(1.12,2.13),P=0.008][14],目前多数研究证实HER2 基因与肿瘤淋巴结转移的相关性更强,其中的机制尚不能确定,但可以因此探究抗HER2 治疗与淋巴结转移控制的情况。
HER2 过表达与肿瘤远处转移相关,Ji-Lin Li 等通过对于卵巢或腹膜等转移及无转移的结直肠癌患者发现,有卵巢转移的结直肠癌原发病灶HER2 阳性率高于无卵巢转移(54.5%:36.4%,P<0.05),且有腹膜转移及双侧卵巢转移的患者,卵巢转移灶中HER2 表达率更高[16]。在胃癌和乳腺癌患者中,HER2 过表达往往提示着肿瘤的恶性程度更高,表现在肿瘤的转移可能性更大,不难想象HER2 在结直肠癌中的表现。
HER2 过表达还与肿瘤分化程度相关,张凯等研究发现高分化、中分化、低分化腺癌HER2 阳性率不同,分别31.25%、61.90%、91.67%[15]。同理,温达雄等总结176 例结直肠癌患者病例发现癌组织的分化程度越低,HER-2 表达的阳性率越高,HER-2 与组织分化程度呈负相关(相关系数 r=-0.356,P<0.05)[17]。但目前有多数大型meta 分析认为结直肠癌患者中HER2 的扩增率与肿瘤分化程度无关[14],具体情况有待增设大量临床研究明确。
HER2 在结直肠癌不同部位的表达阳性率不同。PETACC 研究发现HER2 过表达多见于脾曲以下的远段肠癌,各分期结直肠癌均有此趋势[18],HERACLE-A 研究也有此发现,在HER2 表达上,远段结肠癌占64%,直肠癌占21%,近段结肠癌只占15%[19]。此可见HER2 过表达结直肠癌的位置趋向性,这可能与HER2 表达及结直肠基因特性相关。
HER2 过表达与结直肠癌患者的预后关系存在争议,在PETACC-8 研究中发现HER2 过表达在Ⅲ期结肠癌患者中被确定为不良预后指标[20],2016 年Sun 发表的meta 分析结果显示HER2 过表达被认为是结直肠癌预后较差的潜在因素,统计数据显示HER2 过表达结直肠癌3 年无病生存率降低。但Richman 等研究显示HER2 扩增与患者PFS(HR=0.83,P=0.40)和 OS(HR=0.99,P=0.95)无关[6]。得出此不同结论的原因可能与随访病人情况差异相关,有待进一步研究明确。
3 HER2扩增与KRAS、BRAF 及MSI 的相关性
在一项纳入QUASAR、FOCUS 和PICCOLO研究的荟萃分析,共纳入3256 例转移性结直肠癌患者的分析中显示在HER2 扩增与肿瘤各阶段的RAS 野生型状态均相关,研究显示HER2阳性的Ⅳ期患者中,KRAS 或BRAF 野生型与突变型的肿瘤分别为5.2% 和1.0%(P<0.01),在Ⅱ、Ⅲ期患者中分别为2.1% 和0.2%,提示RAS/BRAF 野生型的病例中HER2 过表达率较高[6]。在PETACC-8 研究中也有此体现,在HER2 扩增患者中,KRAS 突变型仅占2.4%,野生型占5.6%(P<0.001)[21],癌症基因组图谱(TCGA) 数据库也发现HER2 扩增和KRAS、NRAS 和BRAF突变在晚期结直肠癌中相斥[22]。目前已有多项研究表明,HER2 过表达预示着抗EGFR 治疗效果不佳。Yonesaka 等的回顾性研究中提示HER2 过表达的结直肠癌患者在行西妥昔单抗治疗后PFS及OS 均比HER2 不表达患者短(PFS 89:129 天,OS307:515)。相同的案例还有Raghav[23]等纳入66 名患者的抗EGFR 治疗中,HER2 过表达的患者相比HER2 不表达患者中位无进展生存时间低(2.9 月vs8.1 月;HR 7.05;P<0.0001)。由此可见,HER2 阳性可作为III、IV 期结直肠患者抗获得抗EGFR 治疗预后不良的独立危险因素[24],在分子机制层面上,其可能是因为EGFR 主要下游通路为Ras/Raf/MEK/ERK/MAPK 和P13K/AKT/mTOR,这些通路与HER2 所激活的靶点通路有共同之处而引起耐药[25,26]HER2 阳性与结直肠癌微卫星不稳定性的关系在分子机制层面尚没有定论,但目前在基于731 名结直肠癌患者早期的临床观察性研究表明在HER2 过表达的的病例里有更高的MSI-H 表达率,但在MSI-H 的病例里却未见HER2 过表达病例,在治疗方面MSI-H 并伴有HER2 过表达的患者在行PD-1 治疗后生存率更低[27],此研究给予了HER2 结直肠癌免疫治疗的预后情况,或许在此类患者抗HER2 治疗联和免疫治疗会提高患者生存情况。
4 HER2 扩增mCRC 靶向治疗的疗效评价
Bertotti 等将85 例结直肠癌患者来源的具有遗传特征的样本在小鼠体内进行异体移植,建立人源性组织异种移植(PDX) 模型发现HER2 扩增结直肠癌对西妥昔单抗和帕托珠单抗单药耐药,但拉帕替尼联合西妥昔单抗或帕妥珠单抗联合用药可使病情能得到有效控制[28]。基于分子研究及动物实验等理论基础,一些HER2 过表达的结直肠癌临床研究也逐渐完善。HERACLES-A 研究纳入了27 例HER2 过表达RAS 野生型晚期肠癌患者接受曲妥珠单抗+拉帕替尼治疗,客观有效率达到30%,74% 的患者疾病控制,中位PFS 21 周[29]。曲妥珠单抗联合帕妥珠单抗的篮子试验Mypathway 研究,纳入57 例HER 扩增晚期结直肠癌中18 名(32%) 患者疾病缓解,其中RAS/RAF 野生型患者ORR 有效率为40%,中位PFS 5.3 月,但是HER2 扩增且RAS 突变的患者,中位PFS 为1.4 个月[30]。同样运用曲妥珠单抗联合帕妥珠单抗的TRIUMPH 研究中,分别通过组织分析组及CTDNA 组对汇总,客观缓解率为35.3%,疾病控制率约为62.3%,中位PFS 为4 个月[31]。总结HERACLES-A研究、Mypathway研究及TRIUMPH 研究的102 例患者,可见HER2 过表达RAS 野生型晚期肠癌患者接受HER2 治疗效果明显,中位PFS 明显升高,且两个试验不良反应少,但目前病例数仍少,需要更大量样本研究验证。
随着药物学研究的进步,新型抗HER2 小分子酪氨酸激酶抑制剂、抗体药物偶联物(antibodydrug conjugate,ADC) 以及双特异性抗体的不断被研发。其中抗体药物偶联物是将高特异性的单克隆抗体药物和高活性的小分子细胞毒药物相结合,从而提高抗肿瘤药物的精准度及减少不良反应,其中T-DM1 及T-DXd(DS8201) 两个药物已应用于结直肠癌的临床试验。2017 年发表于美国国家综合癌症信息网杂志(JNCCN) 的个案报道了HER2 过表达的结肠癌伴肝转移的患者行T-DM1治疗,随访7 月时间内患者症状持续好转,转移性结节得到控制[32]。HERACLES-B 研究应用曲妥珠单抗+T-DM1 治疗标准治疗失败的HER2阳性晚期结直肠癌虽然客观有效率仅9,7%,但疾病控制率(77.4%) 和中位无进展生存期(4.1个月),虽然研究结论没有达到临床终点(ORR 30%),但是其疗效基本达到了与HERACLES-A、Mypathway研究的水平[33]。T-DXd 是HER2 靶向抗体曲妥珠单抗偶联拓扑异构酶抑制剂形成的ADC 类药物,在多中心Ⅱ期研究DESTINYCRC01研究中,78 例RAS/BRAF野生型二线及以上治疗失败的晚期肠癌患者接受T-DXd 单药治疗,根据HER2 IHC 表达及ISH 扩增水平分为3个队列,队列A 为IHC 3+或IHC 2+/ISH扩增,队列B 为IHC 2+/ISH 无扩增,队列C 为IHC1 +,其中队列A 客观有效率达到45.3%,中位PFS 为6.9 月,而队列B 及队列C 均未观察到有效患者[34]。MOUNTAINEER 研究中的高选择性抗HER2 小分子酪氨酸激酶抑制剂图卡替尼也受到了众多关注。2019 年ESMO 会议上公布的MOUNTAINEER 研究是一个多中心、单臂二期临床研究,纳入23 名RAS 野生型HER2 阳性晚期结直肠癌患者,采用图卡替尼+曲妥珠单抗联合治疗方案,截至数据公布时,22 例患者客观有效率为52.2%,主要集中在原发肿瘤为左半结肠及直肠的患者中,中位无进展生存期和总生存期分别达到了8.1 个月和18.7 个月[35]。近年来研究成果如下表(表1)。总而言之,这些研究提示了双抗HER2 治疗HER2 过表达mCRC 均取得了不错的疗效。
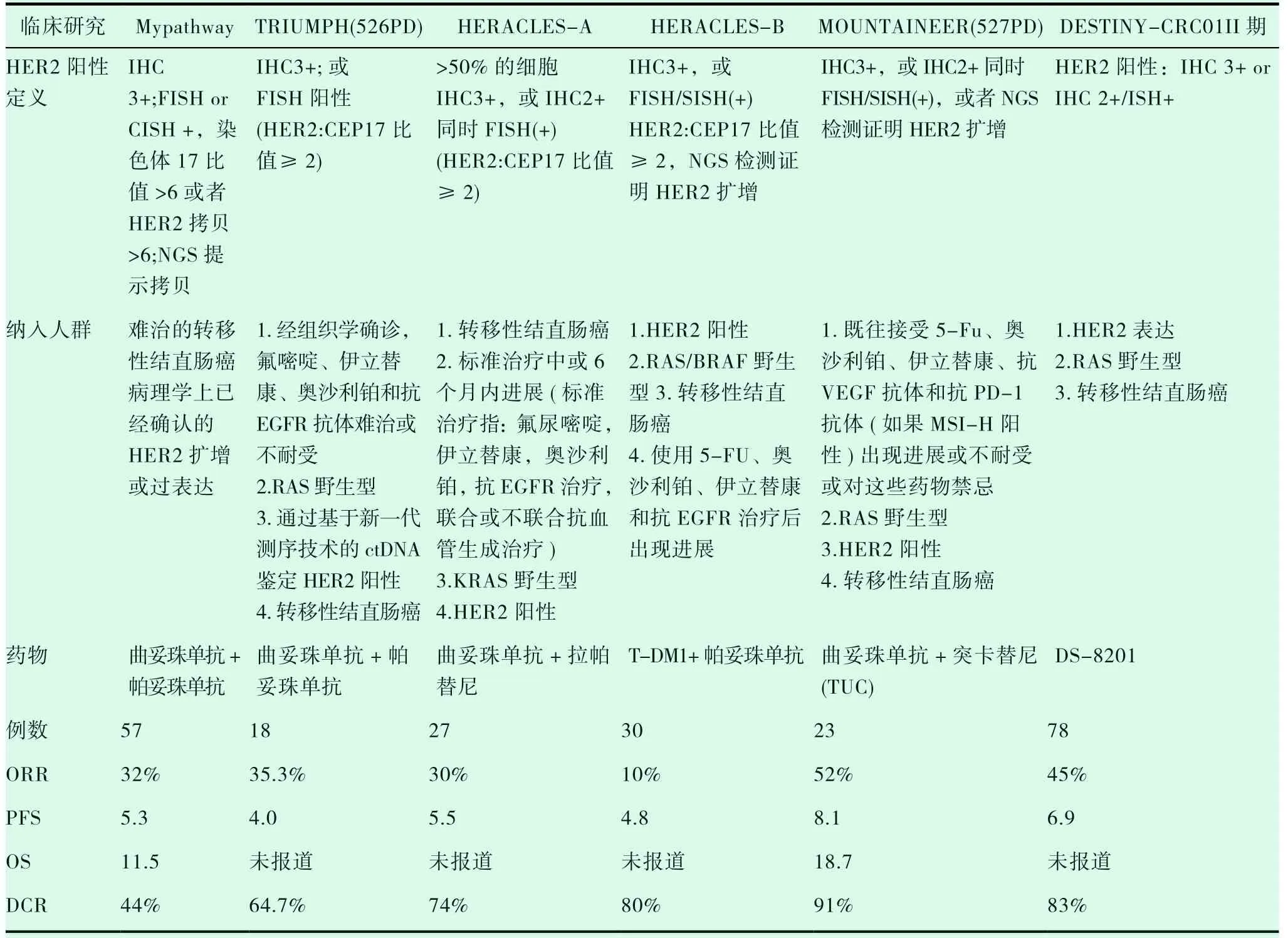
表1 HER2 阳性结直肠癌近年临床研究成果
目前国内外还有很多关于HER2 扩增或者过表达结直肠癌的临床研究正在开展,一些复合式的药物如来那替尼和吡咯替尼等正在纳入新的临床研究,其中来那替尼(neratinib) 在美国已经被批准用于HER2 阳性乳腺癌的延长辅助治疗[36],目前已有新的临床研究纳入对于携带HER2 基因点突变的,包括HER2 和HER3 突变及未知突变的不同来源肿瘤予以来那替尼(neratinib) 治疗,观察到治疗效果因肿瘤来源不同而效果不同,但遗憾的是,此次试验中对结直肠癌观察未见明显变化[37],有待进一步的研究;并且还有新型抗体偶联药物DS-8201 在HER2 表达乳腺癌试验中获得显著疗效[38],目前也在进行HER2 扩增或过表达的转移性结直肠癌的相关临床试验,其中郑大附一院总结6 例给予曲妥珠单抗联合吡咯替尼的HER2 阳性晚期结直肠癌患者,得出疗效安全及控制疾病进展等结论,虽然在研究中样本量较少,但给国内开展大规模临床研究提供了标杆[39]。抗HER2 治疗的新型复合型药物的高效性及安全性带来新的治疗希望,精准治疗医学相信会对肿瘤患者治疗及延长生存时间方面有新的突破。
抗HER2 靶向治疗联合免疫治疗也是目前探索的重要方向。SBT6050 是一种将TLR8 激动剂和抗HER2 单抗链接其他的ADC,能够有效激活HER2 阳性肿瘤的髓样细胞,“重新编程”肿瘤微环境,目前SBT6050 联合帕博丽珠单抗治疗HER2 阳性实体肿瘤的I 期临床研究也正在进行中(NCT04460456)。另外也探究HER2特异性嵌合抗原受T 细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T)在 HER2 阳性肿瘤中的作用的I-II 期临床研究(NCT02713984),在临床前研究中对于 HER2 过表达的肿瘤细胞表现出生长抑制作用,目前仍在试验中[40]。
5 HER2 阳性结直肠癌的现状与展望
早在2015 起,HER2 阳性结直肠的临床研究及临床前研究便如火如荼的开展,跟随着目前的研究进展,结直肠也逐渐进入到HER 时代,HER2 变异包括了HER2 扩增、突变及融合,总变异率约4.9%,扩增率约3%,虽然HER2 变异在结直肠中未见明显突出,比例较低,且有单药治疗效果差等特点,但其因对肠癌的转移及抗EGFR 药性存在着一定影响,因此逐渐成为肠癌的检测点之一,受到了国内外学者的关注及研究,在上述的多个研究中提示了双靶治疗,不论是帕妥珠单抗+T-DM1 的HERACLES 研究及曲妥珠单抗+帕妥珠单抗的TRIUMPH 及MyPathway 研究,还是曲妥珠单抗+突卡替尼的MOUNTAINEER 研究都证实了双靶抗HER2治疗的效果显著及较低的治疗副作用,近年来一些 抗HER2 TKI、ADC药等研发给HER2 扩增肿瘤带来了新的机遇,相信未来单药,双药及多药联合能对HER2 扩增结直肠患者带来新的希望。目前CSCO 对于HER2 过表达结直肠癌治疗尚处于临床研究阶段,但在临床工作中对于晚期结直肠患者,一线及二线治疗效果不佳时,往往对该类患者行双靶治疗,病人确实获得了较好的疗效及较低的副反应,但对于HER2 过表达的KRAS 野生型结直肠癌是否能将抗HER2 治疗提至一线以联合抗EGFR 治疗药西妥昔单抗仍未确定。相信通过未来更多研究体系的逐步探索及抗HER2 靶向药物的研发,肠癌的HER2 治疗将逐渐前移,联合化疗、抗EGFR 靶向治疗及免疫治疗给晚期肠癌患者带来新希望。
