基于线粒体Cyt b基因的雅鲁藏布江中游短尾高原鳅遗传多样性研究
2022-07-29刘艳超马聪敏李小兵
巩 政,刘艳超,马聪敏,李小兵
(1.枣庄学院生命科学学院,山东枣庄 277160;2.水利部中国科学院水工程生态研究所水利部水工程生态效应与生态修复重点实验室,武汉 430072;3.西藏自治区高原生物研究所,拉萨850000;4.西南大学水产学院,重庆 402460)
雅鲁藏布江是西藏地区最大的河流,也是世界上海拔最高的大河,它发源于喜马拉雅西段北麓的杰马央宗冰川,由西向东横贯西藏南部,随后沿喜马拉雅山东麓急转南下,在巴昔卡流出国境进入印度。雅鲁藏布江全长2 229 km,流域面积达239 228 km,源头至里孜段为其上游,派镇以下至巴昔卡为下游,从里孜至派镇全长1 340 km的河段则属于雅鲁藏布江中游。中游江段流域环境独特且复杂多样,孕育出异齿裂腹鱼(′)、巨须裂腹鱼()和黑斑原鮡()等雅鲁藏布江流域特有物种。然而,近十几年来,作为西藏人口和经济社会发展最为密集的区域,在人类活动干扰、外来鱼类入侵、水电开发和全球气候变化等因素的影响下,雅鲁藏布江中游鱼类的生活史特征、遗传多样性及群落结构等方面均发生重要变化,引发广泛关注。
高原鳅属()隶属于鲤形目(Cypriniformes)条鳅科(Nemacheilidae),现知FishBase数据库中已收录超过180个有效种或亚种,是条鳅科中最大的类群,并与鲤形目鲤科的裂腹鱼类和鲇形目鮡科的鰋鮡鱼类共同组成了适应青藏高原高寒环境的三大鱼类类群。已知分布于雅鲁藏布江流域的高原鳅属鱼类包括短尾高原鳅()、东方高原鳅()、细尾高原鳅()、异尾高原鳅()、斯氏高原鳅()和西藏高原鳅()等6种。短尾高原鳅的模式产地为青海省达布逊盐湖水系,目前被认为分布于包括雅鲁藏布江在内的青藏高原及其毗邻的各水系中,相关鱼类资源调查研究表明短尾高原鳅广泛分布于雅鲁藏布江中游流域且种群规模较大。然而,目前对于该流域短尾高原鳅包括遗传多样性在内的基础生物学研究报道十分匮乏。
脊椎动物的线粒体DNA(mtDNA)基因组分子结构简单,进化速率较核基因快且严格遵循母系遗传,在遗传多样性分析中可选取其中特定基因片段,基于碱基位点的突变分析其遗传变异的程度并推测群体的遗传结构。线粒体细胞色素b(b)基因以其进化速率较快和易于扩增测序等优点已被广泛应用于种内或种间的遗传变异分析中。本实验通过对雅鲁藏布江中游不同支流中生活的短尾高原鳅b基因序列的测定,分析其遗传多样性现状,检测群体间分化水平,追溯其种群历史动态,进而为该物种提供生物学资料,为物种保护提供理论依据。
1 材料与方法
1.1 样本采集
分别于2020年5-6月和2021年8月在雅鲁藏布江中游10条支流中采集短尾高原鳅样本,共计125尾。剪取样本背部右侧肌肉或将其整体固定于无水乙醇中,带回实验室后保存于-20 ℃冰箱中备用。采样点的样本量及分布信息见表1和图1。
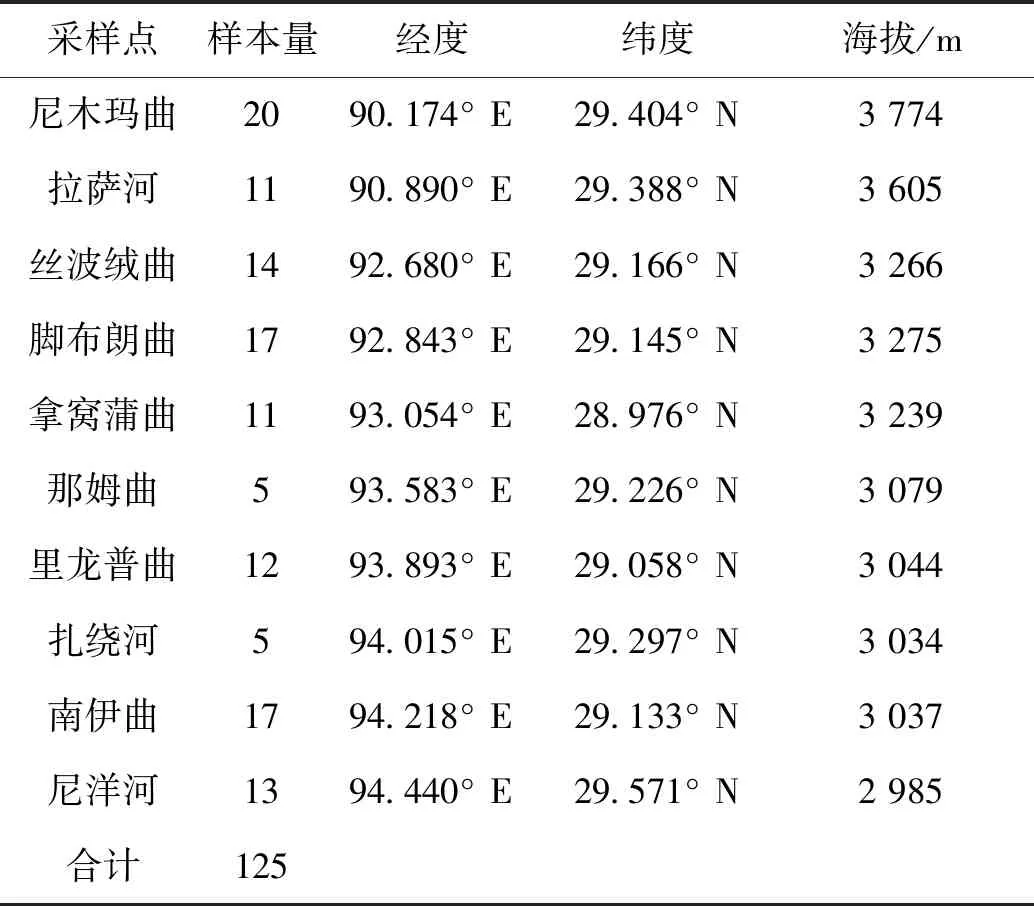
表1 雅鲁藏布江中游短尾高原鳅的样本采集信息Tab.1 Sample data of T.brevicauda collected from the middle Yarlung Tsangpo River
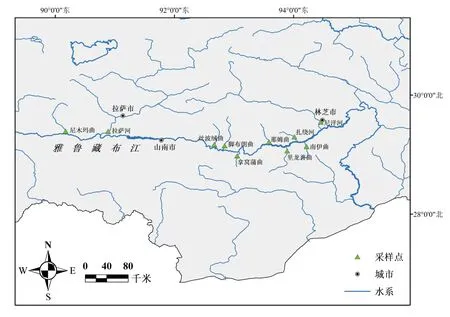
图1 雅鲁藏布江中游短尾高原鳅的采样点示意图Fig.1 Map showing the sampling sites of T.brevicauda in the middle Yarlung Tsangpo River
1.2 DNA提取和PCR扩增
DNA提取采用略微改进的高盐抽提法,分子标记b基因扩增和测序的引物为L14724和H15915。PCR反应体系为30 μL,包括3 μL的10 × Buffer,1.5 μL dNTPs,上下游扩增引物各1 μL,0.25 μL的TaqDNA聚合酶和30~50 ng DNA模板,然后加入双蒸水标定体积。PCR反应条件如下:95 ℃预变性4 min;进入反应循环:95 ℃变性45 s,54~56 ℃退火45 s,72 ℃延伸1 min,共循环35次;72 ℃延伸10 min。PCR产物使用8%的琼脂糖电泳检测目标条带,扩增成功后送至武汉擎科生物有限公司进行纯化和双向测序。
1.3 数据分析
测定的短尾高原鳅b序列使用Clustal X v2.0软件进行比对,并在SEAVIEW软件中参照序列峰图进行人工校正。使用MEGA v6.0软件将基因序列翻译成氨基酸序列进行勘误,并计算序列中碱基组成、变异位点以及转换()颠换()比值等参数。利用DnaSP v5.1软件分析短尾高原鳅的遗传多样性指数,包括单倍型数目()、单倍型多样性()和核苷酸多样性()等。
采用贝叶斯推断(Bayesian inference,BI)和最大似然法(Maximum likelihood,ML)分别重建单倍型的系统发育树。首先在PhyloSuite v1.2软件PartitionFinder v2.1模块中基于修正的赤池信息准则(corrected Akaike information criterion,AICc)和密码子分区筛选核苷酸替换模型,得到的最佳模型用于下一步系统树的构建中。贝叶斯树的构建在MrBayes v3.1软件中实现;最大似然树的构建在RaxML v8.0软件中实现。利用popart 1.7软件中的TSC方法绘制单倍型的进化网络图,分析单倍型之间的进化关系。使用Arlequin v3.5软件检测不同地理群体间遗传分化指数(),基于分子方差分析(analysis of molecular variance,AMOVA)估算群体遗传结构和地理群体遗传变异的分布。
种群历史动态分析使用Arlequin v3.5软件对各群体和总体进行中性检验,计算Tajima′s和Fu′s值两项参数;错配分布分析基于粗糙指数(Harpending′s raggedness index,)和偏差平方和()衡量结果与预期模型是否相符合及其显著性水平。使用BEAST v1.8软件进行种群动态的贝叶斯天际线(Bayesian Skyline Plot,BSP)分析:采用鲤形目鱼类常用的进化速率(0.01/ma),碱基替换模型选择GTR模型,Number of Gamma Categories设为6,选择Coalescent Bayesian Skyline模型作为点图模型,马尔科夫链(MCMC)的长度为100 000 000;最后在Tracer v1.5软件中构图。
2 结果
2.1 Cyt b基因序列碱基组成与变异
对125尾短尾高原鳅的线粒体b基因序列进行比对校正后,获得长度为1 140 bp的序列集,起始密码子为ATG,中止密码子为GCT,未检测到碱基的插入或缺失。
基于短尾高原鳅的b序列集检测到碱基变异位点共95个,其中70个为简约信息位点;全部个体的平均碱基组成为A=27.0%,T=29.4%,C=26.9%,G=16.7%,A+T的含量(56.4%)高于C+G(43.6%),碱基组成具有强烈的反G偏倚(bias),其中碱基G在密码子第三位的含量尤其低(10.7%);序列的转换和颠换均未达饱和,转换数明显大于颠换数,平均值为10.26。
2.2 遗传多样性
从125尾个体中检测到52个单倍型,总体单倍型多样性与核苷酸多样性分别为0.953±0.010和0.010 51±0.001 04。具体而言,单倍型多样性最低的是扎绕河群体(0.600±0.175),最高的是那姆曲群体(0.900±0.161);核苷酸多样性最低的是尼洋河群体(0.001 87±0.000 40),最高的是那姆曲群体(0.019 65±0.003 36)。短尾高原鳅各地理群体的序列变异情况和遗传多样性指数见表2。
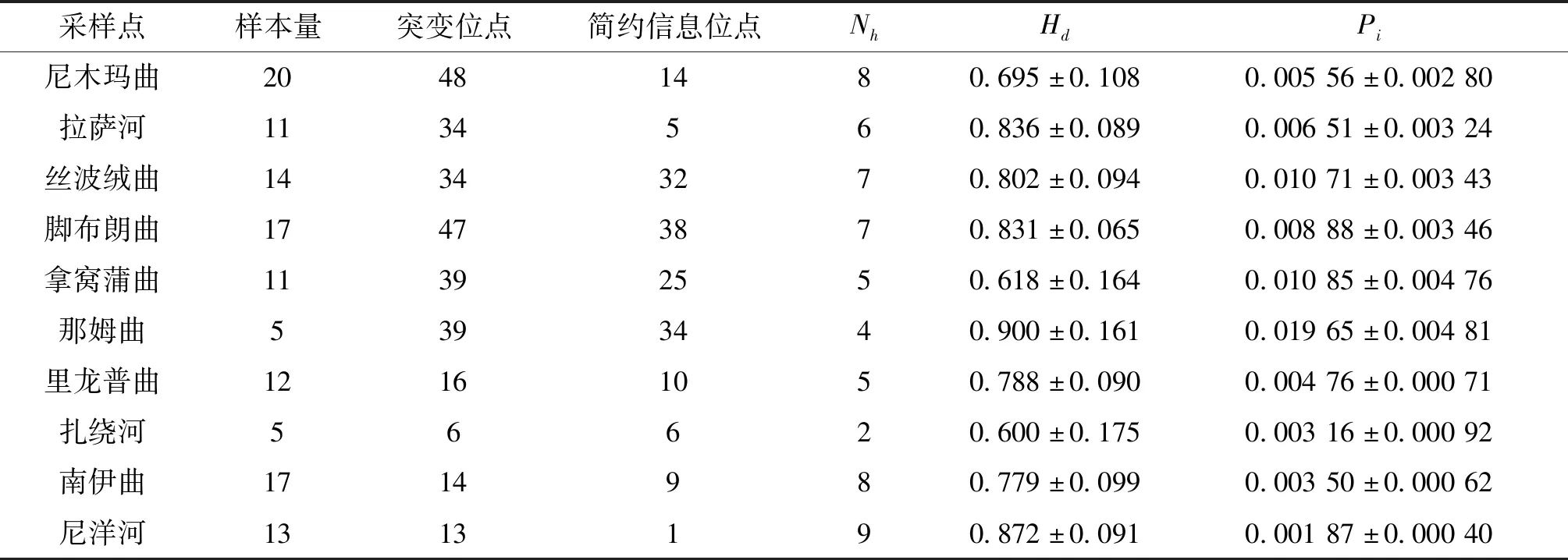
表2 基于Cyt b基因序列的雅鲁藏布江中游短尾高原鳅的遗传多样性Tab.2 Genetic diversity of T.brevicauda in the middle Yarlung Tsangpo River based on Cyt b gene sequences
以分布于雅鲁藏布江中游的另外两种高原鳅属鱼类:细尾高原鳅和异尾高原鳅作为外类群,采用BI法和ML法重建的短尾高原鳅单倍型系统发育树的拓扑结构基本一致,在系统树中所有单倍型可被划分为5支谱系(图2)。其中,谱系I规模最大,其中包含的33个单倍型分布于除拿窝蒲曲和丝波绒曲以外的其他所有群体中;此外,谱系I中还包含若干亚谱系。谱系II中包含的5个单倍型分布于丝波绒曲、脚布朗曲和里龙普曲3个群体中。谱系III中包含的6个单倍型仅分布于尼洋河群体中。谱系IV中包含的5个单倍型分布于尼木玛曲、拉萨河和丝波绒曲3个群体中。谱系V中包含的3个单倍型分布于尼木玛曲、脚布朗曲、拿窝蒲曲和那姆曲4个群体中。
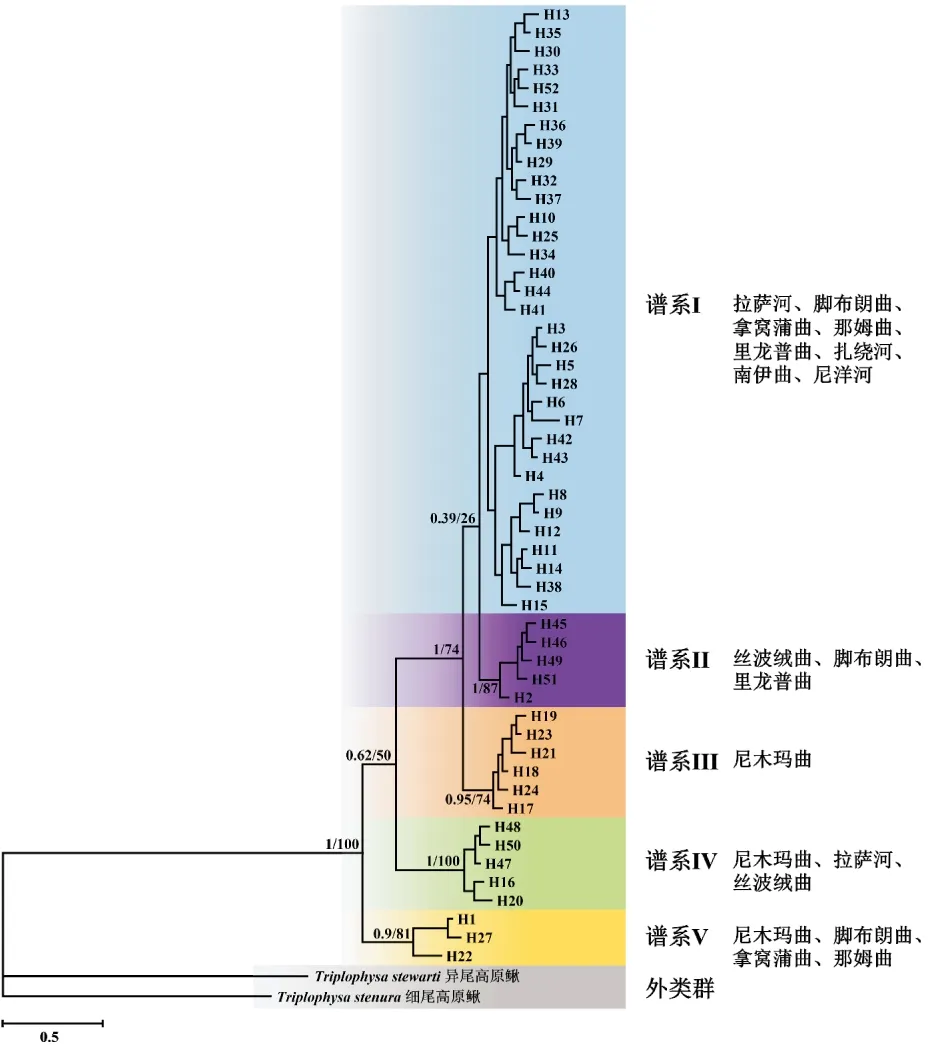
图2 基于Cyt b基因序列单倍型构建的雅鲁藏布江中游短尾高原鳅的系统发育树Fig.2 Phylogenetic tree of T.brevicauda in the middle Yarlung Tsangpo River based on Cyt b gene sequence haplotypes
基于TCS法构建的单倍型进化网络图显示:52个单倍型中有47个单倍型为单一群体所独享,仅有少数单倍型(例如H2)为多个群体所共享(图3)。系统发育分析检测出的5支谱系所属单倍型之间碱基突变大都超过十步;而在谱系内部相邻单倍型之间往往仅经历一到两步的碱基突变,多个单倍型通过缺失的中间单倍型连接。

图3 基于Cyt b基因序列的雅鲁藏布江中游短尾高原鳅单倍型的进化网络图Fig.3 Evolutionary network of T.brevicauda in the middle Yarlung Tsangpo River inferred from Cyt b gene haplotype frequencies
2.3 群体间遗传分化
不同地理群体两两配对计算得到的范围为-0.057~0.605(表3),大部分群体之间的遗传分化指数呈现示出显著或极显著水平,少数群体间未检测出遗传分化。其中,尼木玛曲群体与其他群体之间的最大(0.467~0.605)且均为显著或极显著水平;拿窝蒲曲群体、扎绕河群体与其他群体之间遗传分化指数最小(-0.016~0.525,-0.057~0.566),且部分群体间的检测结果未达到显著性水平。
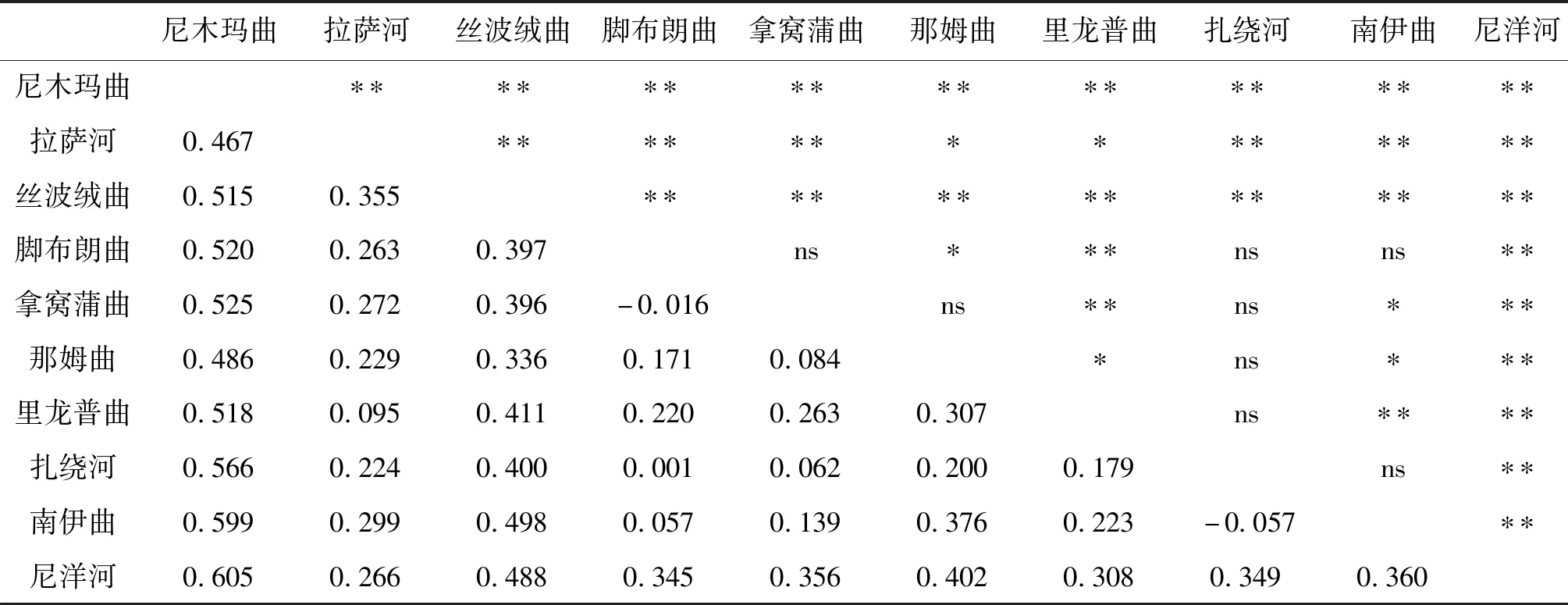
表3 雅鲁藏布江中游10个地理群体短尾高原鳅的FSTTab.3 The FST between 10 populations of T.brevicauda in the middle Yarlung Tsangpo River
AMOVA分析结果显示,在不分组的情况下遗传变异主要来自于群体内部,占比为62.1%;群体间的遗传变异相对较小,占比为37.9%,表明遗传多样性主要产生于个体间的遗传变异,群体间的分化亦占有一定比例。根据杨汉运等对雅鲁藏布江中游不同江段河流形态的划分,将10个群体划分为3组(尼木玛曲和拉萨河群体为一组,分布于曲水宽谷段;丝波绒曲、脚布朗曲、拿窝蒲曲、那姆曲和里龙普曲群体为一组,分布于加查峡谷段;扎绕河、南伊曲和尼洋河群体为一组,分布于米林宽谷段),此时得到的组间变异占9.23%,组内群体间变异占30.28%,群体内变异占60.89%(表4)。

表4 雅鲁藏布江中游10个地理群体短尾高原鳅的AMOVA分析Tab.4 Analysis of molecular variance analysis among ten populations of T.brevicauda in the middle Yarlung Tsangpo River
2.4 种群历史动态
中性检验与核苷酸错配分析的结果见表5,中性检验的结果显示尼木玛曲、拉萨河、尼洋河群体及总体的Tajima′值或Fu′s值均为显著或极显著的负值,而其他群体的Tajima′值或Fu′s值检验结果均不显著。核苷酸错配分析显示,丝波绒曲、拿窝蒲曲、那姆曲、里龙普曲和扎绕河群体检测出具有显著或极显著水平的和,其他群体的参数检验均未达到显著水平。对10条支流短尾高原鳅总体进行BSP分析,结果显示短尾高原鳅在1.12 kya出现过快速的种群扩张,随后又发生了急速的种群收缩(图4)。
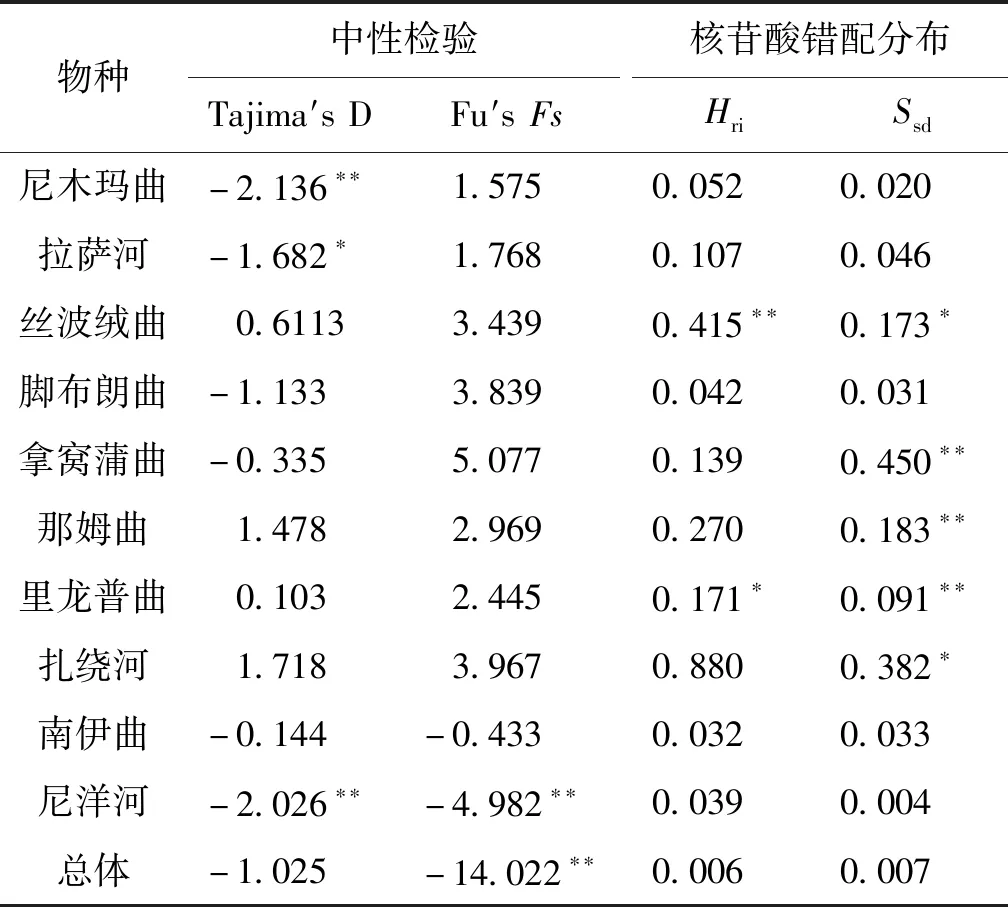
表5 雅鲁藏布江中游短尾高原鳅地理群体的中性检验和核苷酸错配分析Tab.5 Indices of neutral test and mismatch distribution analysis for T.brevicauda in the middle Yarlung Tsangpo River
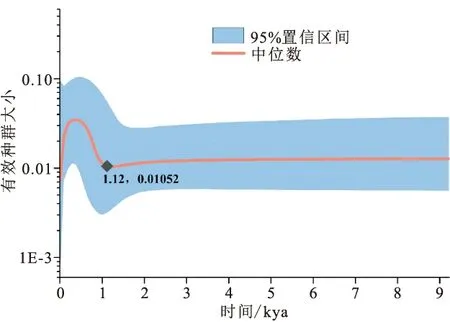
图4 基于Cyt b基因序列的雅鲁藏布江中游短尾高原鳅的贝叶斯天际线分析Fig.4 Bayesian skyline plot analysis based on Cyt b gene sequences for T.brevicauda in the middle Yarlung Tsangpo River
3 讨论
3.1 遗传多样性与群体分化
单倍型多样性指数()与核苷酸多样性指数()被认为是衡量物种或群体遗传多样性水平高低的重要指标。本研究中短尾高原鳅总体及尼木玛曲、拉萨河、丝波绒曲、脚布朗曲、拿窝蒲曲和那姆曲群体≥0.5,≥0.005,表明这些地理群体和总体的遗传结构较为稳定;而里龙普曲、扎绕河、南伊曲和尼洋河群体≥0.5,<0.005,表明这些群体在历史上可能遭遇过遗传瓶颈后又经历了种群扩张。同雅鲁藏布江中游异齿裂腹鱼等其他鱼类的基于b序列的遗传多样性指数相比,短尾高原鳅总体的单倍型多样性和核苷酸多样性均处于较高水平,遗传结构较为稳定。
单倍型系统发育关系与进化网络图显示,短尾高原鳅单倍型大致聚为5支谱系且未按照地理分布聚类,即10个地理群体的单倍型混杂分布于5支谱系中,不符合各支流群体的空间分布格局(个别谱系仅由单一群体的单倍型构成:谱系III包含的单倍型仅分布于尼洋河群体中)。90.4%的单倍型仅出现在单一群体中,不同群体间共享的单倍型极少,这些暗示着雅鲁藏布江中游的短尾高原鳅群体具有共同的祖先起源或曾经发生过充分的遗传交流,在较近的时期内发生了种群收缩和遗传分化。此外,单倍型进化网络图还显示不同谱系的单倍型群组不具有占绝对优势的进化网络中心,仅在谱系局部存在少数单倍型呈中心放射状分布,其他单倍型由它突变演化而来;例如谱系I中的H3和H29,推测这些单倍型为发挥过“奠基者效应”的古老单倍型。
遗传分化指数()可在一定程度上指示群体间基因交流和遗传漂变的程度,是反映群体进化历史的重要参数。尼木玛曲群体与其他9个群体之间均存在极显著水平的高度分化(范围为0.467~0.605);部分群体之间未检测具有显著水平的遗传分化,主要出现在拿窝蒲曲和扎绕河群体与其他少数群体之间,原因可能是这两个群体样本数量较少,后期需要增加样本量进行验证。AMOVA分析同样表明群体间的遗传变异占据相当比例,支持遗传分化的结论。短尾高原鳅在雅鲁藏布江中游不同支流群体间普遍存在高度遗传分化,究其原因可能是由于短尾高原鳅是一种小型定居型鱼类,没有迁移洄游的习性,不同地理群体间基因交流的机会很少,局域种群在长期独立进化过程中朝着不同方向发生遗传漂变。
3.2 种群历史动态
中性检验显示部分群体的Tajima′值和Fu′s值均为显著的负值,偏离了中性突变,表明三种鱼类在近期应该经历过种群扩张事件,对应的核苷酸错配分析中粗糙度指数和偏方差的检验结果均不显著,支持种群扩张的推断。对短尾高原鳅总体进行BSP分析的结果显示其在很近的历史时期(约1.12 kya)经历过急速的种群扩张和种群收缩。
种群的历史动态对区域地质运动和气候变化有着优良的指示作用。相关地质研究表明,青藏高原的隆升是决定雅鲁藏布江河谷地貌形成的主要因素。雅鲁藏布江中游宽谷与峡谷相间呈串珠状分布,说明雅鲁藏布江流域的地质构造复杂多变,具体表现在峡谷江段主要是由地壳上升塑造而成,而宽谷江段主要是由局部地壳下降所导致。本研究的10条支流从上至下依次分布于曲水宽谷、加查峡谷和米林宽谷段,各自经历了不同类型和强度的地质运动,进而影响着各江段内的河流形态和水系格局。同时,全新世以来青藏高原出现过多次明显的冰期和间冰期的冷暖波动,且平均气温变化幅度以西藏南部地区为最大。末次冰盛期以后,青藏高原气温虽然整体上逐步回升,但仍存在多次波动调整,气候依旧不稳定;例如在最近的2 ky,青藏高原先后出现了8次暖期和7次冷期。
作为一种适应高原环境的小型鱼类,短尾高原鳅主要栖息于雅鲁藏布江各支流中,迁移能力弱,对于分布区内的冷暖波动、水系变迁等环境扰动的响应尤为敏感。结合种群动态分析结果,我们认为末次冰期以来青藏高原南部的气候波动可能通过改变短尾高原鳅在不同支流中的适合度,进而影响其种群动态;同时推测地质活动导致的水系变迁也是影响短尾高原鳅种群波动的重要因素。
3.3 物种保护建议
本研究基于线粒体b基因序列分析了雅鲁藏布江中游短尾高原鳅的遗传多样性和群体遗传结构,结果显示各地理群体呈现较高的遗传多样性,不同地理群体间高度分化,共享单倍型极少。随着雅鲁藏布江干流多座梯级水电站的建设运行,不同河段支流间的群体进行基因交流变得更加困难。因此,为了防止小种群遗传资源的丧失,在设置保护单元时应该针对不同支流进行分别管理和保护。同时,作为雅鲁藏布江各支流中常见的高原鳅属鱼类,短尾高原鳅主要栖息于浅水砾石滩缓流水或静水小潭等生境中。然而,随着雅鲁藏布江流域沿线公路、铁路等工程的影响和外来物种的侵入,部分支流河道生境遭到破坏,外来鱼类数量泛滥,短尾高原鳅种群生存受到严重威胁。
因此,我们建议对于诸如拉萨河、尼洋河等流量较大、生境类型丰富且已建有水利工程设施的支流,应当识别短尾高原鳅典型栖息地并划定重点保护河段,对已遭破坏鱼类保护河段进行生态修复,同时进行严格监管和防范外来鱼类进入自然水体;对于其他流量较小、生境类型较为单一的支流,建议进行整体保护,不做水利水电开发,尽可能减少人类活动对河流生态环境造成的影响。此外,本研究也发现短尾高原鳅的种群数量曾受到较近历史时期内气候波动的影响。因此,还应加强对该物种遗传多样性和遗传结构的跟踪监测,及时完善和调整物种保护策略。
