不同窖龄浓香型白酒窖泥细菌群落结构及其多样性分析研究
2022-07-29姚海刚李彦涛郭永昌尉军强郭涛红
唐 云,姚海刚,李彦涛,郭永昌,张 涛,赵 萍,尉军强,郭涛红
(1.金徽酒股份有限公司,甘肃陇南 742308;2.兰州理工大学,甘肃兰州 730050)
浓香型的白酒具有“窖香浓郁、酯香突出、入口绵柔、香气丰满”的风味特点。研究表明由于全国各地自然环境差异,以及生产原辅料,生产工艺等因素影响,使浓香型白酒形成了不同的两大风格,即长江流域“浓郁派”风格和黄淮流域“淡雅派”风格。浓香型白酒的风格与浓香型窖池的窖泥有紧密的联系,全国各大酒厂对窖泥的培养及养护都十分重视,且各酒厂配制及养护方法各具特色。窖泥主要作用是为酿酒有益微生物提供生长繁殖场所,通过长期的富集、驯化菌种,形成乌黑、细腻、酯香突出的优质窖泥。吴冬梅等研究表明新培养的窖泥或使用时间不长的新窖池微生物类别不定因素多,初始泥味重;老窖池的窖泥微生物菌群及酶系丰富多样,菌株大多已被驯化成型,老熟程度越好的窖池越可能生产出性质固定、酒质良好的原酒。为探索不同窖龄窖池中微生物的多样性及地域差异对窖泥微生物的影响,本研究运用高通量测序技术在各个分类的水平上剖析群落的结构,得出不同窖龄窖池中微生物群落的组成架构,准确、完整解析浓香型白酒窖泥中微生物的群落结构,为窖泥中微生物菌群的研究提供理论依据。
1 材料与方法
1.1 材料、试剂及仪器
窖泥:样品分别来源于金徽酒厂10 年、30 年、60 年老窖和四川某酒厂人工窖泥、10 年、30 年老窖。分别从不同窖龄的窖池窖壁及窖底十字交叉法取混合样品100 g。
试剂及耗材:DNeasy Power Soil Kit(100)、QIAamp 96 PowerFecal QIAcube HT kit(5),德 国QIAGEN 公司;Qubit dsDNA Assay Kit,美国Life Technologies;Takara Ex Taq高保真聚合酶。
仪器设备:台式高速离心机、移液器,德国Eppendorf 公司;PCR 仪,伯乐生命医学产品(上海)有限公司;QIAxtractor,德国QIAGND 公司;电泳仪、凝胶成像仪,上海天能科技有限公司;Bioanalyzer,美国Aglient 科技有限公司;tip、离心管,爱思进生物技术(杭州)有限公司。
1.2 实验方法
1.2.1 窖泥微生物样品PCR扩增
本研究采用DNeasy PowerSoil Kit 试剂盒对窖泥微生物样本的基因组DNA 进行提取,利用琼脂糖凝胶电泳检测DNA 的纯度和浓度。以稀释后的基因组DNA 为模板,选取细菌16S rRNA 基因的V3 和V4 区进行扩增,使用的引物为343F(5'-TACGGRAGGCAGCAG-3')和789R(5'-AGGGTATCTAATCCT-3')。
1.2.2 扩增子测序及数据质控
对上述扩增子产物按照二代测序标准建库方法构建测序文库并使用Illumina MiSeq 平台进行双端测序。利用Trimmomatic 软件去除原始测序数据的接头后,切除碱基平均质量值低于20 的窗口并去除长度小于50 bp 的序列。利用Flash 软件将前述合格的序列进行pair-end 双端序列拼接,再使用QIIME 软件去除拼接后含有模糊碱基(N 碱基)、单个碱基重复大于8 或长度小于200 bp 的序列,得到清洗序列(clean tags)。使用UCHIME软件去除clean tags 中的嵌合体,获得有效序列(valid tags)。使用Vsearch(version2.4.2)软件将相似度为97 %的序列划归为一个操作分类单元(operational taxonomic units,OTU)并确定每个OTU 的代表序列,再采用RDP classifier Naive Bayesian 分类算法将代表序列与数据库进行比对,得到每个OTU 对应的物种分类信息。
2 结果与分析
2.1 样本取样分析
对原始测序数据进行接头去除和质量控制后,对每个样本的测序量进行统计,clean tags数据量分布在89539~93508 之间,clean tags 经过去除嵌合体得到valid tags 数据量分布在75607~89235 之间,valid tags 平均长度分布在407.23~425.68 bp,各样本OTU个数分布在425~1416之间。
2.2 窖泥原核微生物物种群落Alpha多样性分析
以对微生物各异性研究的深度和广度不同为参照,该物种各异性可划为Alpha 多样性和Beta 多样性。Alpha 多样性分析反映生物环境内物种的多样性程度。表1汇总了10个样品的微生物多样性指数,老窖泥样品的微生物多样性处于较高的水平,一共检测到30 个纲;金徽10 年窖泥样品的微生物多样性最低,一共检测到22 个纲,优势原核微生物主要集中在Clostridia 和Bacteroidia 中。本研究检测到的窖泥微生物群落多样性水平与已有文献的报道相当。
图1 样品有效序列长度二维图
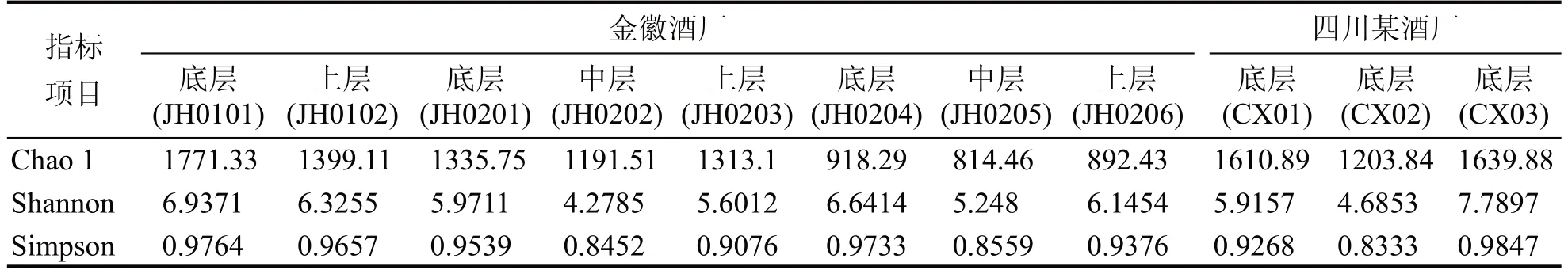
表1 窖泥中菌群微生物多样性指数表
2.3 窖泥原核微生物物种群落Beta多样性分析
对不同窖龄窖泥样品中微生物群落进行主坐标轴分析,金徽酒厂不同窖龄的窖泥样品聚成3类,表明窖泥微生物群落与窖泥质量(窖龄)呈现明显的相关性。OTU 聚类分析结果表明,金徽60年老窖池底层和上层窖泥微生物样品有718 个共同的OTU,30 年老窖池有311 个共同OTU,10 年有170 个共同OTU,随着窖龄增加。在取样前期,为保证窖壁完整,车间采用窖底泥修补中层窖壁,因此窖底与窖壁为相同样本,不作对比分析。相同位置下窖泥样本的共有OTU 数量随使用时间呈现递增趋势;同一窖池不同层次窖泥样本的共有OTU数量随窖泥层次的增加自上而下呈递增趋势,说明窖泥微生物在发酵过程中经过窖泥环境的选择,逐渐淘汰了不适应该发酵环境的微生物,窖泥中不同位置的微生物分布整体趋于稳定并集中到某些优势菌群中。
群落结构或称为“生物群落”,指的是生态学中,在一个群落生物环境内相互之间具有直接或者间接关系的所有生物或者生物的总和。微生物群落中各种群之间是相互作用的,能以有规律的方式共处,具有各自明显的营养和代谢类型。高通量测序结果显示,样本中共检测出了62 个纲,671个属。金徽60 年、30 年以及四川某酒厂30 年、10年的老窖中细菌在纲水平以Clostridia 为主,其含量随着使用时间的延长而递增。
样品JH0202中Bacteroidia含量超过Clostridia,可能是部分窖泥钙化,铲除后用窖底泥拌和封窖泥修补导致。

图2 样品的Venn图
对于四川人工窖泥CX03 而言,窖泥在室外发酵且用塑料布覆盖密封,表层暴露于空气中进行有氧或微氧发酵,菌种以好氧菌及兼性厌氧菌为主;窖泥中层随着底层窖泥发酵气体的溢出和本层氧气的消耗,一些厌氧菌逐步成为优势菌群;底层窖泥在发酵过程中受地温影响较大,发酵最快,接触空气最少,最先形成厌氧优势菌群。人工窖泥发酵过程中各层次差异较大,取样既要保证代表性,又要具有广泛性,因此取表层以下40 cm 处为检测样,测得结果是以Bacilli为优势菌群。
根据图3 数据分析得出,老车间优质窖泥含有较高的纲为Clostridia,平均含量大于40%,主要为。新车间窖泥、人工老窖泥以及退化窖泥中以Bacilli 和Bacteroidia 为主,人工窖泥菌种分布随发酵层次变化而变化,新窖及退化窖泥中以为主。江南大学胡晓龙等研究表明,退化窖泥中的Bacilli 纲中的、及含量高于优质窖泥中的含量,而Bacteroidia、Clostridia、Methanobacteria、Methanomicrobia、Synergistia 及Thermoplasmata 纲中属的含量低于优质窖泥的含量。
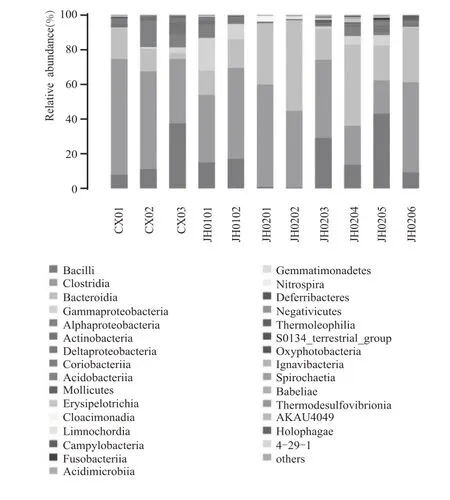
图3 窖泥样品中原核生物纲水平组成
根据高通量测序结果,对纲水平上相对丰度前30 位的菌纲进行分析,如图3 所示,样品CX01 中主要有Clostridia(66.81 %)和Bacteroidia(17.53 %);样品CX02 中主要有Clostridia(56.37%)、Alphaproteobacteria(15.27%)、Bacteroidia(12.62%)和Bacilli(11.08 %);样品CX03 中主要有Bacilli(37.42 %)和Clostridia(37.14%);样品JH0101 中主要有Clostridia(38.92 %)、Gammaproteobacteria(19.24 %)、Bacteroidia(13.67 %)和Bacilli(14.91 %);样品JH0102中主要有Clostridia(52.52 %)、Bacilli(16.85 %)和Bacteroidia(16.40 %);样品JH0201中主要有 Clostridia(59.04 % )和 Bacteroidia(35.15 %);样品JH0202 中主要有Bacteroidia(52.21%)和Clostridia(44.30%);样品JH0203 中主要有Clostridia(45.13%)、Bacilli(28.97%)和Bacteroidia(17.65 %);样品JH0204 中主要有Bacteroidia(46.58 % )、Clostridia(22.44 % )和 Bacilli(13.51 %);样品JH0205 中主要有Bacilli(43 %)、Bacteroidia(19.82 %)和Clostridia(19.19 %);样品JH0206 中主要有Clostridia(52.10 %)和Bacteroidia(31.05%)。
根据高通量测序结果,对属水平上相对丰度前30 位的菌属进行分析,如图4 所示,样品CX01中主要有(10.82 %)和(6.32%);样品CX02 中主要有(40.58 %)和(3.21 %);样品CX03中主要有(7.12 % )、(7.7 %)、(5.07 %)、___12(4.30 %)和(2.96 %);样品JH0101 中主要有(9.78%)、(9.22 %)和(8.87 %);样品JH0102 中主要有(12.96 %)、___12(7.47 %)和(4.97 %);样品JH0201 中主要有(15.92 %)、(11.41 %)、(9.20 % )和(7.70 %);样品JH0202 中主要有(33.00%)、(21.58%)和(13.05 %);样品JH0203 中主要有(28.38 %)和(11.85 %);样品JH0204 中主要有(32.35%)、(11.42%)和(3.08%)。
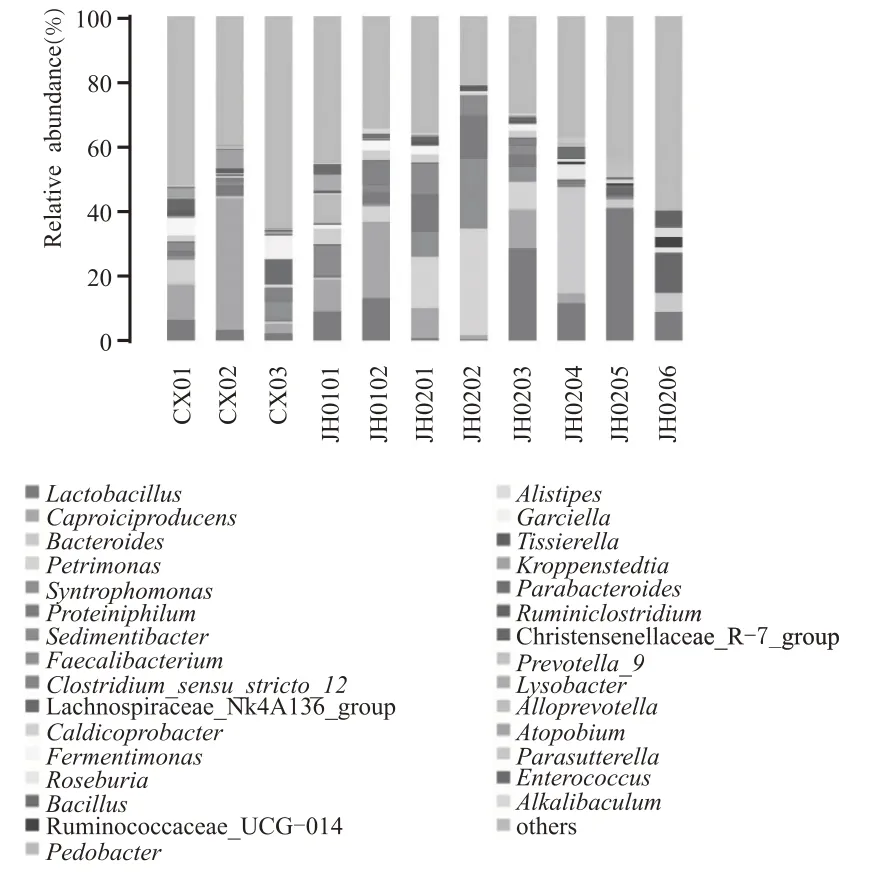
图4 窖泥样品中原核生物属水平组成
3 结论
本试验通过对不同地区的窖泥样品进行高通量分析对比,结果发现:
(1)20 个样品可划分的OTU 数相差较大,两者共有OTU 数仅为32 个。金徽60 年老窖池的样品可划分的OTU 数相差不大,两者共有OTU 数为718 个,样品JH0101 及JH0102 独有的OTU 数分别为698 个和389 个。四川某酒厂的样品可划分的OTU 数相差较大,三者共有OTU 数为311 个,样品CX02 及CX03 可划分的OTU 数相差相对较大。金徽30 年老窖池的样品可划分的OTU 数相差不大,三者共有OTU 数为331 个,样品JH0201、JH0202及JH0203独有的OTU数分别为375个、225个和342个。
(2)就chao1 指标而言,样品JH0101 丰富程度最好,样品CX03 和CX01 次之。Shannon 指标和Simpson 指标数值为样品CX03 最强,表明该样品菌群多样程度最好,其次是样品JH0101 和JH0201。样品JH0101 窖龄最大,在糟醅长期循环发酵过程中,窖泥中各种微生物之间共生、互生、竞争与寄生关系稳定,达到了一个动态平衡的微生态环境,丰富度较高。CX03 为四川某酒厂人工培养窖泥,露天的发酵环境为微生物多样性创造了基本条件。窖泥由外向内分为好氧菌、微好氧菌、兼性厌氧菌、厌氧菌和严格厌氧菌五大类,底部人工窖泥微生物结构与窖池中窖泥微生物结构相似,中上层出现明显差异,上层与空气接触部分人工窖泥微生物结构与窖泥完全不同。黄治国等在2014年发布报道,系统分析研究了窖泥中的古菌,证明古菌随窖龄的增加而增加,窖底含量高于窖壁。古菌与窖底细菌可能存在的共生、互生关系是形成窖泥微生物多样性的重要因素。古菌为自养、异养型菌生长缓慢,细菌为异养型菌生长迅速。二者之间的关系可能是老窖泥中微生物丰富度高,人工窖泥中微生物多样性程度高的重要原因。
(3)根据Beta 多样性从主成分上分析可知,60年窖池中各部位群落相似度比较高,10年及人工窖泥中群落相似性较低。基于UniFrac 距离的NMDS非度量多维尺度分析发现,10年窖池各样品距离较近,群落结构相似度高,60 年窖池样品群落结构差异显著。基于UniFrac 距离的多组比较箱线图分析发现,各个组之间的差异十分显著;各个组内相比较来说,相同窖龄的差别并不显著,窖龄不同的差别最为显著。
(4)从菌落分布图可看出,在纲水平菌落分布图中,无论在哪个样品中,Clostridia 都占有绝对优势。从属水平分析,老窖中各菌种占比均不高,含量相对较高,其他菌属占有一定比例;新窖和人工窖泥中含量相对较高,其他菌种占比较少。从整体分析,窖泥中微生物分布及丰富度与窖龄有紧密的联系,具体的关系有待进一步研究。
