跨膜丝氨酸蛋白酶2-成红细胞特异性转化基因相关基因、成红细胞特异性转化基因变异体1及成红细胞特异性转化基因变异体4在前列腺癌中的表达及临床意义
2022-07-28陈俊泳韩耕宇
陈俊泳,韩耕宇,褚 靖,邓 健,谢 群
(广东省珠海市人民医院,暨南大学附属珠海医院,广东 珠海 519000)
前列腺癌是男性发病率最高恶性疾,多好发于老年人群[1]。目前有关前列腺癌的发病机制尚未十分明确,有学者指出,人类恶性肿瘤与基因融合存在密切联系,参与了肿瘤发生、发展,通过观察基因融合情况,观察基因融合情况对治疗方法选择、预后评估具有重要意义[2]。前列腺癌中基因融合涉及了跨膜丝氨酸蛋白酶2(transmembrane serine protease 2,TMPRSS2)基因及成红细胞特异性转化基因相关基因(ERG)、成红细胞特异性转化基因变异体4(ETV4)、成红细胞特异性转化基因变异体1(ETV1)等,多数前列腺癌患者常伴有上述基因融合改变,而在前列腺良性组织中并不会出现上述改变[3,4]。本研究通过检测前列腺癌患者中各因子表达情况,探讨三者与前列腺癌的关系及其临床意义。
1 资料与方法
1.1 一般资料2018年4月至2020年9月我院收治的82例前列腺癌患者,纳入标准:①均经临床确诊;②年龄>18岁,且无意识、沟通障碍;③无放疗、化疗等治疗史;④资料齐全。排除标准:①自身免疫系统先天性异常;②存在急性前列腺炎、尿潴留等;③非典型性腺瘤样增生者;④精神病、痴呆、孕妇等特殊人群。82例患者年龄52~85岁[(71.65±9.36)岁];病理类型:腺癌69例,鳞癌13例;Gleason 分级评分标准:2~4分17例,5~7分42例,8~10分23例;Jewett-WhitmoreProut临床分期:A+B期34例,C+D期48例。
1.2 方法收集82例患者术后癌组织及距瘤体5 cm以上的正常组织。常规脱水、固定、包埋,5 μm连续厚切片。用于免疫组化检测TMPRSS2-ETV1、TMPRSS2-ERG、TMPRSS2-ETV4表达。试剂:兔抗人TMPRSS2-ERG(浓缩型,稀释度为1∶200)、TMPRSS2-ETV1(浓缩型,稀释度为1∶200)、TMPRSS2-ETV4(浓缩型,稀释度为1∶200)、多克隆抗体,均由美国 Epitomics公司提供。SP免疫组化、DAB试剂盒均由美国 Epitomics公司提供。并采用S-P免疫组化染色法检测TMPRSS2-ETV1、TMPRSS2-ERG、TMPRSS2-ETV4。一抗阴性对照使用PBS进行代替。
1.3 结果判定采用双盲法对结果进行判定,即根据阳性细胞在全部组织细胞中占比及阳性细胞染色强度判定[5]:①按显色细胞数计分,无阳性细胞数为0分;1分阳性细胞<10%,2分10%~50%;3分50%~75%;4分>75%。②着色程度:0分为无色,淡黄色、棕黄色、黄褐色分别记1、2、3分。每张切片取5个高倍视野。两类分数相乘总分<3分为阴性。比较不同组织TMPRSS2-ERG、ETV1、ETV4表达。分析各因子与临床特征之间的关系及对前列腺癌的诊断价值。
1.4 统计学方法采用SPSS 22.0统计软件分析数据。计量资料以均数±标准差描述,组间比较采用t检验;计数资料以n(%)表示,比较行χ2检验;诊断价值分析采用ROC曲线。P<0.05为差异有统计学意义。
2 结果
2.1 不同组织中各因子表达比较前列腺癌组织中TMPRSS2-ERG、ETV1、ETV4阳性表达率均显著高于癌旁正常组织(P<0.05)。见表1。

表1 不同组织中各因子表达比较 [n(%)]
2.2 不同临床特征前列腺癌患者各因子阳性表达率比较临床分期C+D期、Gleason评分≥5分患者的各因子阳性表达率均显著高于临床分期A+B期、Gleason评分<5分(P<0.05)。见表2。

表2 不同临床特征前列腺癌患者各因子阳性表达率比较 [n(%)]
※与A+B期比较,P<0.05;○与<5分比较,P<0.05
2.3 各因子检测对诊断前列腺癌的价值TMPRSS2-ERG、ETV1、ETV4联合检测曲线下面积(AUC)、敏感度、特异度分别为0.814、0.925、0.865,均高于各项指标单独检测(P<0.05)。见表3及图1。
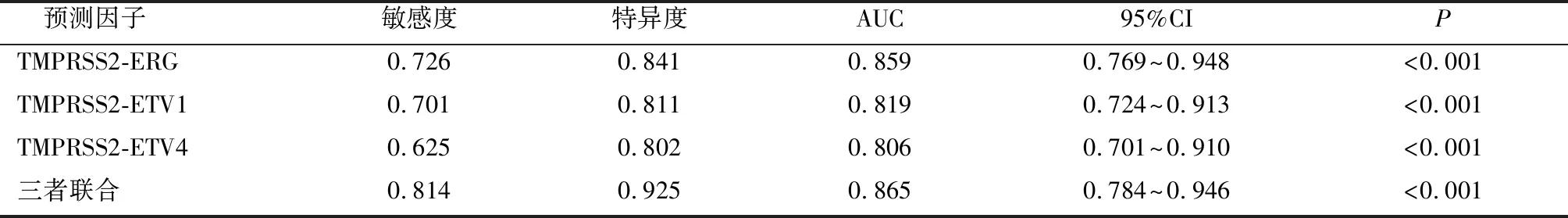
表3 各因子检测对诊断前列腺癌的价值

图1 各因子对诊断前列腺癌的ROC曲线分析
3 讨论
染色体结构改变是正常细胞进展为癌细胞的重要分子生物学事件,其中染色体易位导致基因融合可能是部分肿瘤发生的重要原因。TMPRSS2-ETS基因融合具有多样性,TMPRSS2与ETS家族成员如ERG、ETV1、ETV4等均可发生基因重排,其中以TMPRSS2-ERG发生最为常见[6,7]。
ETS转录因子家族成员可表达于人体各脏器、组织,且同时参与了多个生物学过程,如细胞分化、调节、增殖等[8,9]。国内外相关报道显示,ETS在乳腺癌、前列腺癌等多种恶性肿瘤的血管生成、转移、浸润中具有调控作用[10,11]。周文浩等则指出ERG、ETV1、ETV4基因与TMPRSS2基因融合生成新的融合基因频繁出现在前列腺癌中,在疾病进展中发挥重要作用[12,13]。本研究报道结果与上述研究基本相符,认为可能是融合基因TMPRSS2调节了前列腺癌组织中ERG、ETV1、ETV4的表达,且ERG、ETV1、ETV4易受雄激素的影响;其融合基因的存在同样亦影响雄激素的调节机制[14~16]。大部分的前列腺癌标本中可见出现基因重排,从而促进EST家族表达。但Todorova等[17]发现,在前列腺癌患者中,TMPRSS2-ETV1、ETV4阳性表达率不超过10%,与本研究报道不符,可能与纳入样本量、患者自身差异等因素有关。
国外部分研究指出,TMPRSS2-ERG、ETV1、ETV4的过度表达与ERG、ETV1、ETV4的高表达具有较高的一致性[18,19]。TMPRSS2-ERG、ETV1、ETV4过表达与前列腺癌的侵袭性具有一定关系,且与分化程度、肿瘤分期等亦相关。Carsten等[20]通过检测Gleason评分为7分的前列腺癌中TMPRSS2-ERG、ETV1、ETV4表达,发现含融合基因患者的5年生存率明显高于未含融合基因者。本研究中,随临床分期进展、Gleason评分增高,TMPRSS2-ERG、ETV1、ETV4阳性表达率亦逐渐增高,提示上述因子同样参与了前列腺癌的进展,增加了前列腺癌细胞的侵袭能力,促进肿瘤临床进展。进一步ROC曲线分析发现,三者均可有效诊断前列腺癌,但通过联合检测三者可一定程度提高诊断效能。
综上所述,前列腺癌患者中TMPRSS2-ERG、ETV1、ETV4表达异常,联合检测上述因子可为临床鉴别诊断前列腺癌提供参考。
