蚯蚓蛋白提取物对免疫抑制小鼠肠黏膜免疫功能的调节作用*
2022-07-28段睿洁张航瑜杨卫星徐昆龙
段睿洁,张航瑜,武 玲,杨卫星,徐昆龙
(1.云南农业大学 动物医学院,云南 昆明 650201;2.云南农业大学 食品科学技术学院,云南 昆明 650201)
蚯蚓又名地龙,是中国重要的中药材之一[1],其体内含有丰富的蛋白质、维生素、钙和磷等[2]。《本草纲目》中用蚯蚓入药的处方有40多种[1],不仅可防治多种家畜疾病,如猪丹毒、猪黄白痢和牛瘤胃臌气等,还可用于治疗人的慢性支气管炎、支气管哮喘、中风偏瘫和消化道溃疡等疾病[3]。目前对蚯蚓提取物的研究主要集中在活性蛋白,如小分子蛋白、多肽和酶等,其在抗氧化、提高免疫力、预防血栓和溶血等方面均有较好的效果[4]。WANG等[5]研究表明:蚯蚓提取物在调节免疫功能上具有积极作用。蚯蚓提取物能够有效促进吞噬细胞的吞噬能力和细胞因子上调;同时促进免疫抑制小鼠脾脏指数、胸腺指数和廓清指数升高,提高脾细胞自发分泌或经脂多糖诱导后分泌一氧化氮的水平[6],从而刺激小鼠机体产生免疫反应。
肠道是机体消化和吸收的主要场所,同时由于其庞大的黏膜表面积,也被认为是机体最大的免疫器官[7]。肠道免疫屏障能够抵御外界对肠道的有害刺激,成为机体免疫防御系统最重要的一部分。肠道免疫是机体整体免疫系统的重要指标[8],肠道屏障一旦被破坏会导致细菌侵入机体,引起肠源性脓毒血症等疾病,诱发全身严重反应和多器官功能障碍,从而危及生命[9]。动物蛋白可促进免疫抑制小鼠肠道树突状细胞成熟和细胞因子表达,修复肠道黏膜损伤,从而增强肠道黏膜免疫功能[10]。但是,目前鲜有蚯蚓提取物中活性蛋白对肠道黏膜免疫功能调节作用的研究。
环磷酰胺(cyclophosphamide,CTX)会破坏机体的免疫细胞,启动炎症与抗炎反应,且常伴有胃肠道不良反应[11],是应用最广泛的免疫抑制模型抑制剂。研究表明:CTX能降低肠道细胞因子含量,损伤肠道黏膜及屏障蛋白[12],而动物蛋白可修复CTX造成的肠道损伤[10],从而调节肠道免疫功能。本研究利用CTX建立免疫抑制小鼠模型,以蚯蚓蛋白为受试物,通过ELISA检测肠道TNF-α、IL-2、IFN-γ、IL-10和sIgA 的分泌,采用qPCR分析肠道黏膜蛋白ZO-1、Claudin-1和Occludin基因的表达,探究蚯蚓提取物对免疫抑制小鼠肠道黏膜免疫功能的影响。本研究将为动物免疫疾病的预防和治疗提供新思路,对进一步挖掘蚯蚓提取物的药用价值、促进蚯蚓养殖业发展具有重要意义。
1 材料与方法
1.1 材料
1.1.1 试验动物
试验动物为SPF级雄性昆明种小鼠30只,8周龄,体质量(20±2) g,购自昆明医科大学实验动物中心,许可证号:SYXK (滇) K2020-0006。
1.1.2 药品和试剂
(1) 蚯蚓提取物(earthworm extract,EE)的制备:鲜活蚯蚓(自养,品种为掘穴环爪蚓)经组织匀浆器充分研磨后4 ℃、12 000 r/min离心,取上清液;加入硫酸铵后静置12 h,4 ℃、12 000 r/min离心,取沉淀;沉淀重溶后,灌入透析袋,透析过夜;透析结束后,4 ℃、12 000 r/min离心得到蚯蚓蛋白。按每日灌胃量分装于2 mL无菌离心管,置于-80 ℃冰箱保存。经考马斯亮蓝检测,蚯蚓蛋白质量浓度为3.44 mg/mL。
(2) 试剂:环磷酰胺(德国百特肿瘤制药有限公司);Bradford蛋白浓度测定试剂盒(北京兰杰柯科技有限公司);sIgA、IL-2、IL-10、TNF-α和IFN-γ ELISA试剂盒(江苏晶美生物科技有限公司);PrimeScript™ RT reagent Kit with gDNA Eraser (perfect real time)[宝生物工程(大连)有限公司] ;TBGreen®Premix ExTaq™ II (Tli RNaseH Plus)[宝生物工程(大连)有限公司] 。
1.1.3 主要仪器
高速分散器(宁波新芝生物科技股份有限公司);全波长酶标仪[赛默飞世尔科技(中国)有限公司] ;荧光定量PCR仪[伯乐生命医学产品(上海)有限公司]等。
1.2 试验方法
1.2.1 动物试验分组及设计
动物分组:30只昆明种小鼠均饲喂普通饲料,适应期7 d,分为6组,每组5只小鼠,分别为空白对照组、免疫抑制模型组、免疫抑制+蚯蚓蛋白高、中、低剂量组和蚯蚓蛋白组。经查阅文献[13],免疫抑制+蚯蚓蛋白高剂量组和蚯蚓蛋白组为蚯蚓蛋白液原质量浓度(344.0 mg/kg)试验组,免疫抑制+蚯蚓蛋白中剂量组为5倍稀释(68.8 mg/kg)试验组,免疫抑制+蚯蚓蛋白低剂量组为10倍稀释(34.4 mg/kg)试验组。
适应期结束后,各组连续灌胃不同质量浓度的蚯蚓蛋白液20 d,除空白对照组和蚯蚓蛋白组外,其余4组于灌胃第18天腹腔注射环磷酰胺50 mg/kg,连续注射3 d,建立免疫抑制小鼠模型。试验期间小鼠自由饮食、饮水。每日观察小鼠活动状况,每3 d称体质量。
1.2.2 免疫器官指数测定
灌胃试验结束后解剖小鼠,取胸腺和脾脏并称其质量;经PBS洗净和吸水纸干燥后再称其质量。根据公式计算免疫器官(脾脏或胸腺)指数:免疫器官指数=免疫器官平均质量/平均体质量。
1.2.3 ELISA方法测定肠道sIgA和细胞因子的含量
用PBS和预冷的研钵捣碎肠道组织制备10%小肠组织匀浆液(冰上操作)[10],将肠匀浆液收集于离心管中,3 000 r/min离心20 min,收集上清液于离心管内,随后根据试剂盒操作说明进行操作,测定肠道组织中细胞因子(TNF-α、IFN-γ、IL-10和IL-2)和分泌型免疫球蛋白 A (sIg A)的含量。
1.2.4 RT-qPCR测定肠道ZO-1、Claudin-1、Occludin的基因表达量
(1) 提取总RNA
按Takara RNAiso说明书进行操作。
(2) 反转录反应
通过基因组DNA去除反应得到第1步反应液。反转录体系为:第1步反应液 10.0 μL、Prime-Script RT Enzyme Mix I 1.0 μL、RT Primer Mix 1.0 μL、5×PrimeScript Buffer 24.0 μL和RNase Free dH2O 4.0 μL。混匀后,于PCR仪内37 ℃反应15 min,再85 ℃反应5 s。
(3) 荧光定量PCR
实时荧光定量引物见表1。qPCR反应体系为:TB Green Premix ExTaqII (Tli RNaseH Plus)(2×) 12.5 μL、上游引物 1 μL、下游引物 1 μL、DNA模板 2 μL和灭菌水 8.5 μL。qPCR反应条件为:预变性:95 ℃,30 s;循环反应:95 ℃、5 s,60 ℃、30 s,40 个循环;溶解曲线:95 ℃,10 s;65 ℃,5 s;95 ℃。以管家基因β-actin作为内参,mRNA的结果采用相对定量法,即用2-ΔΔCt来计算每个处理组基因的相对表达量。

表1 引物列表Tab.1 List of primers
1.3 统计分析方法
采用IBM SPSS Statistics 23进行统计分析,试验结果均表示为“平均值±标准差”。采用单因素方差分析(ANOVA)和邓肯检验,P<0.05表示在统计学上有显著差异。
2 结果与分析
2.1 蚯蚓蛋白对免疫抑制小鼠体质量的影响
由图1可知:随着灌胃蚯蚓蛋白时间的增加,小鼠体质量逐渐上升。在20 d试验结束时,蚯蚓蛋白组小鼠体质量显著高于免疫抑制组(P<0.05),表明蚯蚓蛋白可增加小鼠体质量。

图1 蚯蚓蛋白对小鼠体质量的影响Fig.1 Effects of earthworm protein on the body weight of mice
2.2 蚯蚓蛋白对小鼠免疫器官指数的影响
由图2 可知:与空白对照组相比,免疫抑制组、免疫抑制+高、中、低剂量组胸腺指数均显著降低(P<0.05);与免疫抑制组相比,蚯蚓蛋白组胸腺指数显著升高(P<0.05)。与空白对照组相比,免疫抑制组脾脏指数显著降低(P<0.05),蚯蚓蛋白组脾脏指数显著升高(P<0.05);与免疫抑制组相比,免疫抑制+高、中、低剂量组和蚯蚓蛋白组的脾脏指数均显著升高(P<0.05)。以上结果说明免疫抑制小鼠模型建立成功,且蚯蚓蛋白可提高免疫抑制小鼠胸腺和脾脏指数。
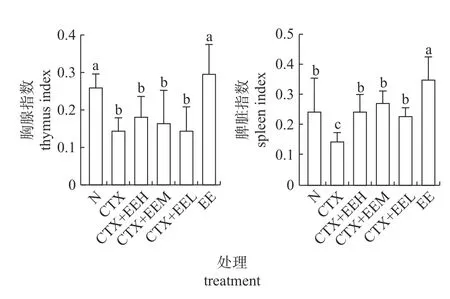
图2 蚯蚓蛋白对免疫抑制小鼠免疫器官指数的影响Fig.2 Effects of earthworm protein on the immune organ indexes in immunosuppressed mice
2.3 蚯蚓蛋白对小肠sIgA分泌水平的影响
由图3 可知:与免疫抑制组相比,免疫抑制+高、中、低剂量组和蚯蚓蛋白组的sIgA含量均显著升高(P<0.05),表明蚯蚓蛋白可增加免疫抑制小鼠肠道内sIgA分泌量,从而改善小鼠肠道免疫抑制情况。

图3 蚯蚓蛋白对免疫抑制小鼠肠道sIgA含量的影响Fig.3 Effect of earthworm protein on the intestinal sIgA content in immunosuppressed mice
2.4 蚯蚓蛋白对小肠组织内细胞因子分泌水平的影响
由图4可知:与空白对照组相比,免疫抑制组的TNF-α、IFN-γ、IL-2和IL-10含量均显著降低 (P<0.05)。与免疫抑制组相比,免疫抑制+高、低剂量组的TNF-α和IFN-γ含量均显著升高 (P<0.05),蚯蚓蛋白组的IL-2含量显著升高(P<0.05),免疫抑制+高、中、低剂量组和蚯蚓蛋白组的IL-10含量均显著升高 (P<0.05)。说明蚯蚓蛋白可不同程度地增加TNF-α、IFN-γ、IL-2和IL-10含量,改善免疫抑制小鼠肠道免疫功能。
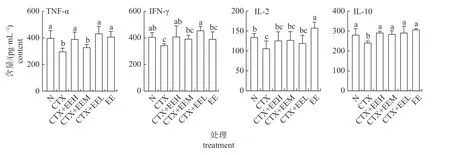
图4 蚯蚓蛋白对免疫抑制小鼠细胞因子的影响Fig.4 Effects of earthworm protein on the cytokines in immunosuppressed mice
2.5 蚯蚓蛋白对肠道屏障功能因子基因表达的影响
由图5可知:与空白对照组相比,免疫抑制+低剂量组和蚯蚓蛋白组的Occludin表达量显著升高(P<0.05),且蚯蚓蛋白组的表达量比对照组高4倍;蚯蚓蛋白组和免疫抑制+中剂量组的Claudin-1表达量显著升高(P<0.05);免疫抑制+高、中、低剂量组和蚯蚓蛋白组的ZO-1表达量均显著升高(P<0.05)。与免疫抑制组相比,免疫抑制+高、中、低剂量组和蚯蚓蛋白组的Occludin表达量显著升高(P<0.05),免疫抑制+低、中剂量组和蚯蚓蛋白组的Claudin-1表达量显著升高(P<0.05),免疫抑制+高、中、低剂量组和蚯蚓蛋白组的ZO-1表达量均显著升高(P<0.05)。表明蚯蚓蛋白可增加免疫抑制小鼠和正常小鼠肠道内Occludin、Claudin-1和ZO-1的表达量,且其表达量远高于对照组,提示蚯蚓蛋白不仅能修复环磷酰胺造成的损伤,还能增强正常小鼠肠道屏障功能。
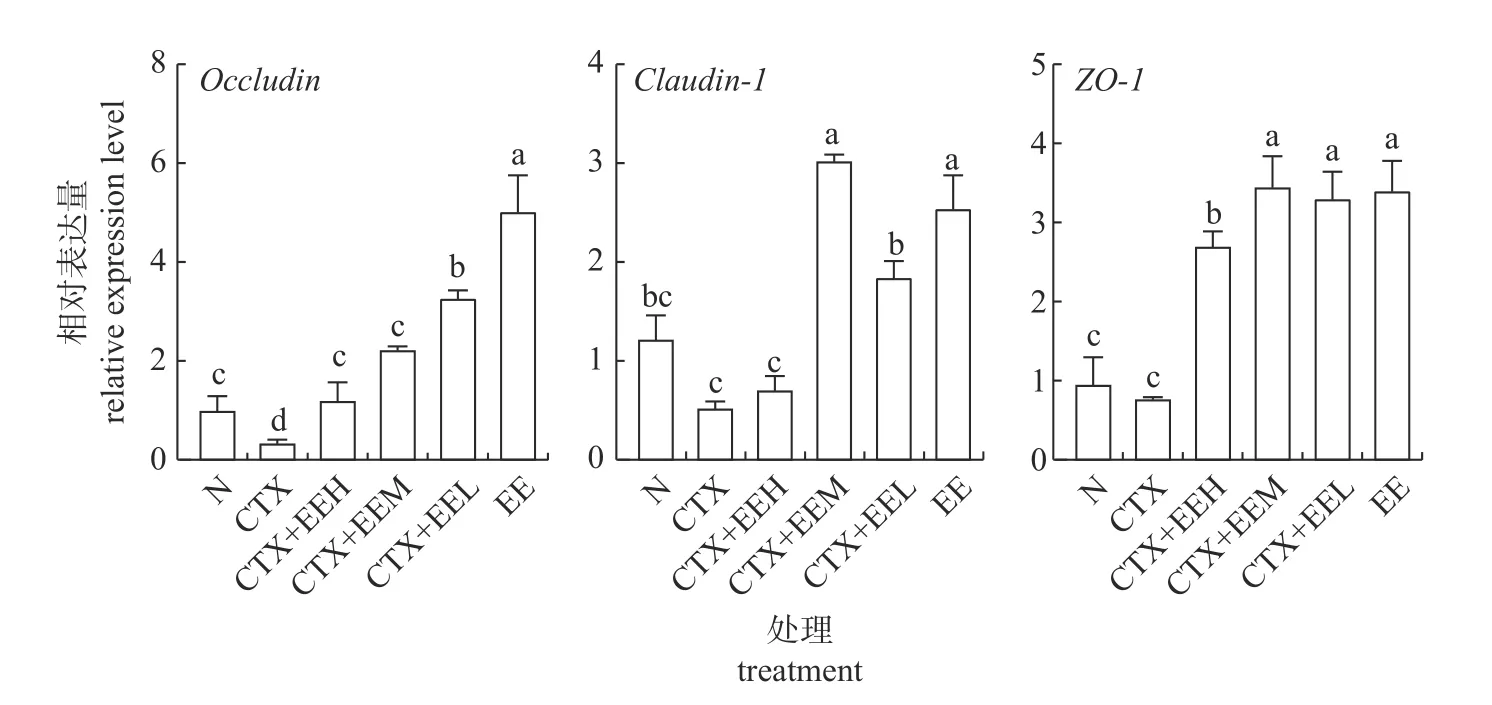
图5 蚯蚓蛋白对免疫抑制小鼠肠道屏障功能因子基因表达的影响Fig.5 Effects of earthworm protein on the gene expression of intestinal barrier functional factors in immunosuppressed mice
3 讨论
3.1 蚯蚓蛋白对免疫抑制小鼠免疫器官的影响
胸腺和脾脏是机体重要的免疫器官,其发育好坏决定机体免疫力的强弱[16]。胸腺是T细胞分化和成熟的场所,对免疫器官和免疫细胞都具有调节作用[17]。脾脏是T细胞和B 细胞的定居场所,可产生各种免疫应答反应[18]。研究发现:环磷酰胺能显著降低正常小鼠胸腺和脾脏质量[19]。本研究结果发现:免疫抑制+高、中、低剂量组脾脏指数均显著高于免疫抑制组,表明蚯蚓蛋白能够恢复环磷酰胺对免疫器官的影响;但是,由于环磷酰胺对小鼠胸腺的抑制作用过强,无法使胸腺的质量恢复至正常水平。蚯蚓蛋白组脾脏指数显著高于对照组,表明蚯蚓蛋白能够提高正常小鼠免疫能力,与李荣[4]的研究结果一致,提示蚯蚓蛋白能提高小鼠机体免疫力。
3.2 蚯蚓蛋白对免疫抑制小鼠肠道内细胞因子的影响
肠道免疫是机体整体免疫的重要指标,肠道黏膜免疫和肠道屏障是其重要组成部分,故本研究进一步检测了肠道黏膜免疫和肠道屏障的变化情况。细胞因子具有调节免疫应答、刺激免疫细胞生长和分化的作用。因此,检测肠道细胞因子的含量可反应肠道黏膜免疫功能。IL-2是预防胃肠道慢性炎症所必需的多效性细胞因子,使用小剂量IL-2可治疗炎症性肠病[20]。IL-10是维持肠道免疫稳态的重要抗炎细胞因子,IL-10或IL-10受体缺陷的小鼠易诱发自发性结肠炎[21]。TNF-α是推动肠道炎症过程的重要介质,IFN-γ可以活化巨噬细胞和NK细胞等增强抗肿瘤和抗病毒的能力[22]。
蚯蚓活性肽能促进环磷酰胺致免疫抑制小鼠脾细胞分泌IL-2并提高小鼠血清细胞因子IL-4和IFN-γ含量[6];蚯蚓提取物能够提高小鼠血清IgG、IFN-γ和IL-6的含量[4]。本研究发现:与免疫抑制组相比,免疫抑制+高、低剂量组的TNF-α含量显著升高,免疫抑制+低剂量组的IFN-γ含量显著升高,表明蚯蚓蛋白可增加免疫抑制小鼠肠道内炎症因子的分泌,刺激肠道免疫功能,从而缓解肠道的免疫抑制。提示蚯蚓蛋白可刺激IL-2、IL-10、IFN-γ和TNF-α分泌,改善肠道内细胞因子异常。
肠道中的sIgA能增强肠道免疫屏障功能,是维持机体免疫稳态的关键物质[23]。本研究表明:与免疫抑制组相比,免疫抑制+高、中、低剂量组的sIgA含量显著升高。有研究发现:多糖可通过增加肠道内sIgA恢复环磷酰胺导致的肠道免疫受损[19],这与本研究结果一致。表明蚯蚓蛋白可通过增加肠道内sIgA改善环磷酰胺致肠道免疫受损,提示长期服用蚯蚓蛋白能够增加sIgA含量,提高肠道黏膜免疫能力。
3.3 蚯蚓蛋白对免疫抑制小鼠肠道黏膜屏障的影响
通常认为主要通过细胞旁途径和细胞间途径破坏肠道黏膜屏障。构成细胞间途径的肠上皮细胞间连接从顶端到基膜依次为紧密连接、黏附连接、桥粒和缝隙连接[24]。Claudin-1、Occlidun和ZO-1作为紧密连接的蛋白标记物对肠道结构至关重要,其表达下降可能会造成肠黏膜结构损伤而增加肠上皮细胞的通透性,并伴随细菌移位和血清中内毒素升高等[25]。本研究表明:免疫抑制+中剂量组的Claudin-1、Occludin和ZO-1表达量均显著高于免疫抑制组,蚯蚓蛋白组的Claudin-1、Occludin和ZO-1表达量均显著高于空白对照组。有研究发现:壳聚糖能促进紧密连接蛋白Claudin-1、Occludin和ZO-1的表达,维持肠黏膜屏障功能,减轻溃疡性结肠炎[26]。ZHUANG 等[27]通过H2O2模拟体外氧化模型造成猪小肠上皮细胞损伤,发现小肠Occludin、ZO-1和Claudin-1表达量下降,而白藜芦醇可提高Claudin-1、Occludin和ZO-1的表达水平,以上结果与本研究结果相似。此外,本研究中蚯蚓蛋白组的基因表达量远高于对照组,提示蚯蚓蛋白可增加肠道黏膜屏障基因Occludin、ZO-1和Claudin-1的表达量,修复肠道屏障受损,并增强正常小鼠肠道屏障功能。
4 结论
经蚯蚓蛋白提取物干预能够显著提高免疫抑制小鼠机体免疫能力,并刺激肠道内细胞因子和sIgA分泌,对肠道屏障损伤有预防和修复作用。
