基于定量磨玻璃样阴影特征的肺癌预后分析研究
2022-07-28吴一鹏吴显宁徐美青
吴一鹏 吴显宁 徐美青
肺癌是世界范围内严重危害人类健康与寿命预期的恶性疾病,每年的发病率逐年升高且位居首位[1]。我国2020年肺癌新发病例数及死亡病例数依旧在各类恶性肿瘤中位列第一,新发病例81.6万例,其中男性53.9万,女性27.6万例;死亡病例71.5万例,其中男性47.2万例,女性27.3万例[2]。随着医学影像学技术的进步及人们健康意识的增强,低剂量计算机断层扫描(low dose computed tomography,LDCT)得以在肺癌的早期筛查与治疗中广泛应用,越来越多的磨玻璃样阴影(ground-glass opacity,GGO)被发现。磨玻璃样阴影不仅可见于良性疾病,而且更多的为肺腺癌的早期表现[3]。目前对于GGO型肺腺癌的主要手术方式为亚肺叶切除术及肺叶切除术,而对于具体术式的选择,目前尚无统一定论。在国外的一些回顾性研究[4-5]中,对于直径在20 mm或更小的I期非小细胞肺癌,与肺叶切除术相比,亚肺叶切除术可以在不损害生存的情况下最大程度的保留肺功能。因此,针对CT筛查提示的GGO病变,通过CT图像对术前病理诊断及手术范围的确定显得尤为重要。
而随着影像学技术的发展,通过定量分析CT的影像学结果对GGO的侵袭性及良恶性逐渐得到广泛应用。目前对于GGO的影像学定量分析指标目前尚无统一标准,在多项定量分析指标中,实性成分占肿瘤比率(consolidation tumor ratio,CTR)为一项常用的影像学表征参数,其定义是肺窗中实性成分大小与结节总大小的比值[6]。根据多项研究结果,CTR对于早期以GGO为表现的肺腺癌的诊断有着良好的诊断作用[7-9],但对于CTR与患者术后生存率及淋巴结有无转移的研究相对较少。本研究通过对接受肺切除手术的112例患者的回顾性研究分析,从而探讨CT定量分析在GGO恶性程度及生存预后的预测意义。
1 资料与方法
1.1 一般资料 选取2014年12月至2019年10月于安徽医科大学附属省立医院胸外科行肺切除手术且术后有明确病理诊断的112例患者,患者术前均接受胸部LDCT、实验室检查,并行脑部MRI,腹腔B超、骨扫描等检查排除远处转移可能。其中男性53例,女性59例,年龄27~78岁,平均(52.11±12.22)岁。根据CTR值将纳入患者分为A组(CTR≤0.25)17例,B组(0.25

表1 4组CTR范围患者临床与影像学资料比较
1.2 纳入及排除标准 纳入标准:术前CT筛查扫描发现单发结节,同时术前未接受放化疗;淋巴结术前影像学评估为N0,术前患者未接受穿刺活检等有创淋巴结检查方法;手术方式为肺叶切除或亚肺叶切除。排除标准:①术前CT检查提示多发结节;②术前检查提示有淋巴结或远处器官转移;③术前行活检已明确病变病理类型的患者;④未行手术或临床资料不完整。
1.3 方法 ①临床资料:所收集患者临床资料均来自于安徽医科大学附属省立医院病案室,所有纳入患者随访3~69个月,平均随访(35.91±1.91)月。统计患者的年龄、性别、吸烟史,手术方式,病理类型,术后TNM分期、总生存期(overall survival,OS)及无复发生存期(relapse free survival,RFS)。其中总生存率为自患者手术后至患者死亡时间或随访截止时间,无复发生存期为自患者手术后至疾病复发或截止随访时间。②CT扫描方法:采用Simens Somatom Sensation 64层螺旋CT机,行CT扫描时嘱患者取仰卧位,同时双臂向上,头先进,并在吸气末屏气用5 mm层面的薄层CT机进行扫描。范围包含从胸廓入口到肺底部。调整机器参数,将肺窗窗宽设置为1 500~2 000 HU(hounsfied units, HU),窗位设置为-700~-600 HU,纵隔窗窗宽设置为350~400 HU,窗位设置为35~50 HU。所有图像均在此参数标准下获得。③CT图像分析:所有CT扫描采集数据均由2位高年资的影像科医师及1位高年资的胸外科医师在未知患者临床资料的情况下共同阅片产生,其中有争议的GGO由第三位具有15年影像经验的高年资影像科医师阅片并得出结果。将肺内呈不规则模糊密度增高,且未掩盖其中的血管及支气管影的局灶性病变归为GGO,通过医学影像存档和通讯系统(picture archiving and communication systems, PACS)对收集的GGO影像资料进行分析,收集GGO最大径、GGO中实性成分最大径。见图1。
其中关于GGO的最大径,定义为在上述规定肺窗之下,找到最大界面,并在此界面下量取的最长直径,而对于GGO实性成分最大径,同样在上述界面下量取其中实性成分的最大直径。CTR定义为GGO实性成分最大径与GGO的最大径之比。④病理结果分析:所有病理标本均来源于胸腔镜或开胸手术,所有标本均通过甲醛固定、切片包埋、HE染色,由2位高年资病理科医师给出结果,诊断分歧时经由病理科讨论达成统一结果。按照2011年版IASLC肺腺癌分类标准予以分类[10]。

注:白线表示GGO最大径,黑线表示实GGO实性成分最大径,GGO实性成分最大径与GGO最大径之比为CTR。
2 结果
2.1 4组GGO患者临床及影像资料比较 4组患者CTR范围的病理类型、复发情况及淋巴结转移比较,差异均有统计学意义(P<0.05)。4组患者手术方式的选择差异有统计学意义(P<0.001)。根据病理结果的浸润程度,将四组患者分为浸润组及非浸润组。不同病程类型侵袭程度差异有统计学意义(P<0.05)。见图2、表2。

注:A为炎性假瘤,B为原位腺癌,C为微浸润性腺癌,D为浸润性腺癌。
表2 A、B组与C、D组间侵袭性差异分析[例(%)]
2.2 GGO生存的Cox回归分析 将年龄、性别、手术方式、GGO最大径、GGO实性成分最大径、CTR、吸烟史及淋巴结转移情况纳入GGO患者的RFS的单因素分析,其中因变量设置为RFS,其中有复发=1,无复发=0。自变量中男性=1,女性=0;肺叶切除术=1,亚肺叶切除术=0;有吸烟史=1,无吸烟史=0;淋巴结转移阳性=1,阴性=0;其余为连续变量。将其中GGO实性成分最大径、CTR、吸烟史及淋巴结转移四项指标纳入多因素分析。CTR(HR=1.972; 95%CI:1.482~3.214;P<0.001)及淋巴结转移(HR=4.177; 95%CI:1.359~12.837;P<0.001)是影响GGO生存的独立影响因素。见表3。

表3 GGO患者生存的单因素及多因素Cox回归分析
2.3 GGO侵袭性的logistic分析 单因素分析中,所有GGO的侵袭性在CTR、GGO最大径、GGO实性成分最大径方面,差异有统计学意义(P<0.05)。将以上因素纳入多因素logistic分析,其中GGO的侵袭性为因变量,浸润组=1,非浸润组=0。自变量中男性=1,女性=0;有吸烟史=1,无吸烟史=0;其余为连续变量。根据SPSS软件计算结果显示CTR为GGO侵袭程度的独立危险因素。见表4。
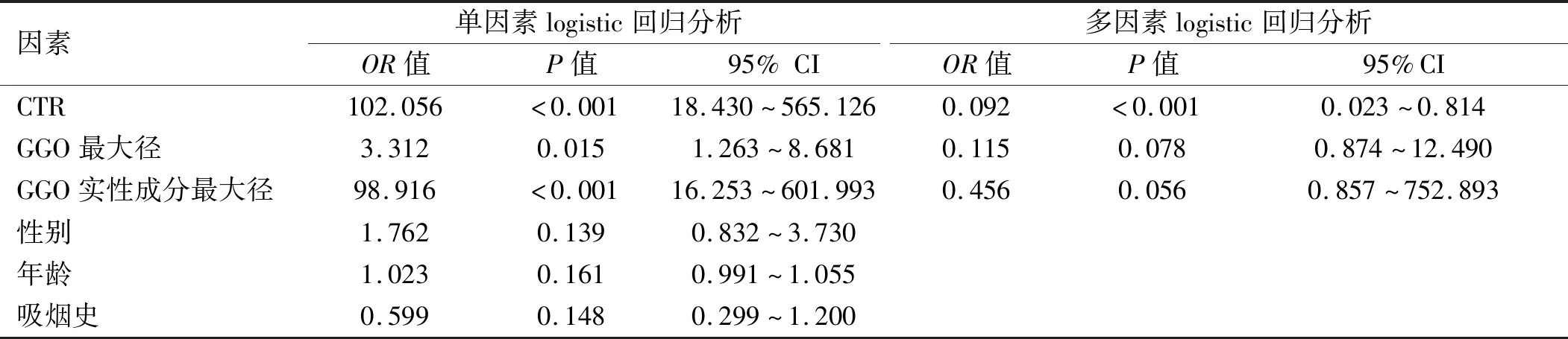
表4 GGO侵袭性的单因素及多因素logistic回归分析
2.4 生存分析 以CTR分组OS与RFS见图3、4所示。总体上随着CTR的增加患者的OS于RFS呈现逐级降低趋势(P<0.05)。通过log-rank检验,证明A、B组与C、D组的OS与RFS,差异有统计学意义。见表5、6。
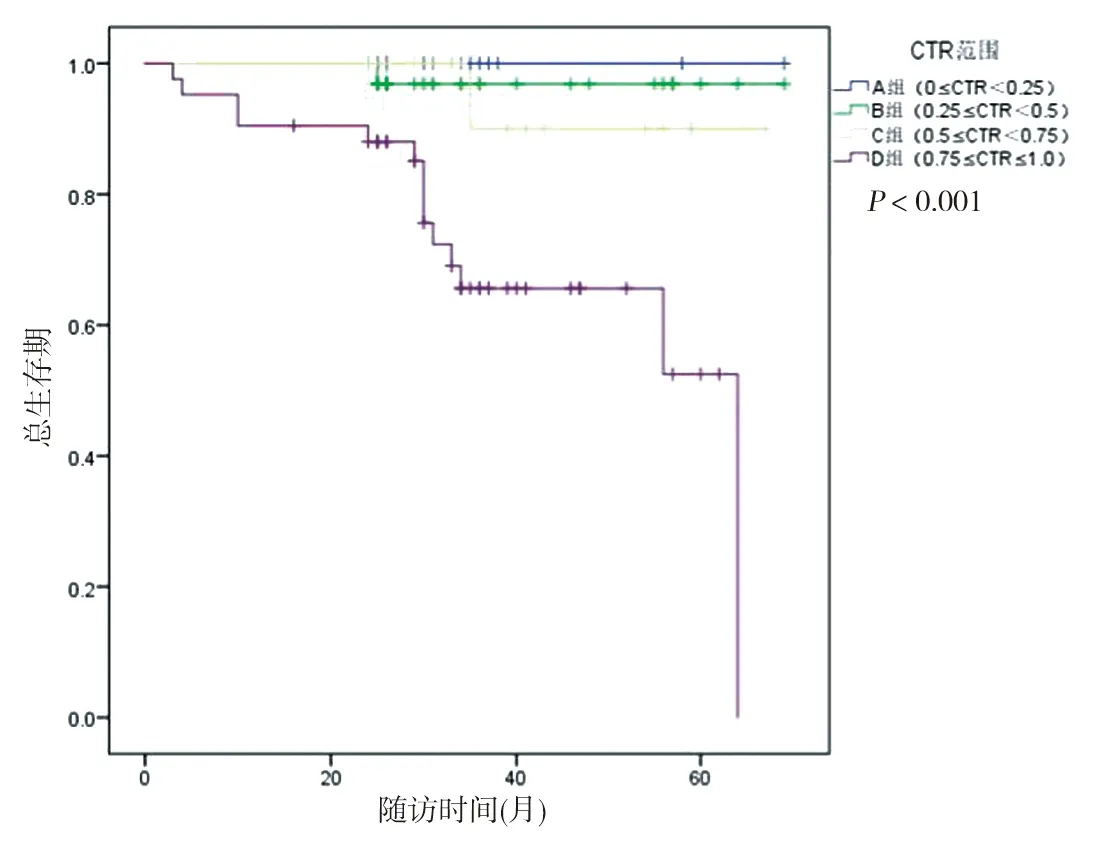
图3 不同CTR患者的总生存率
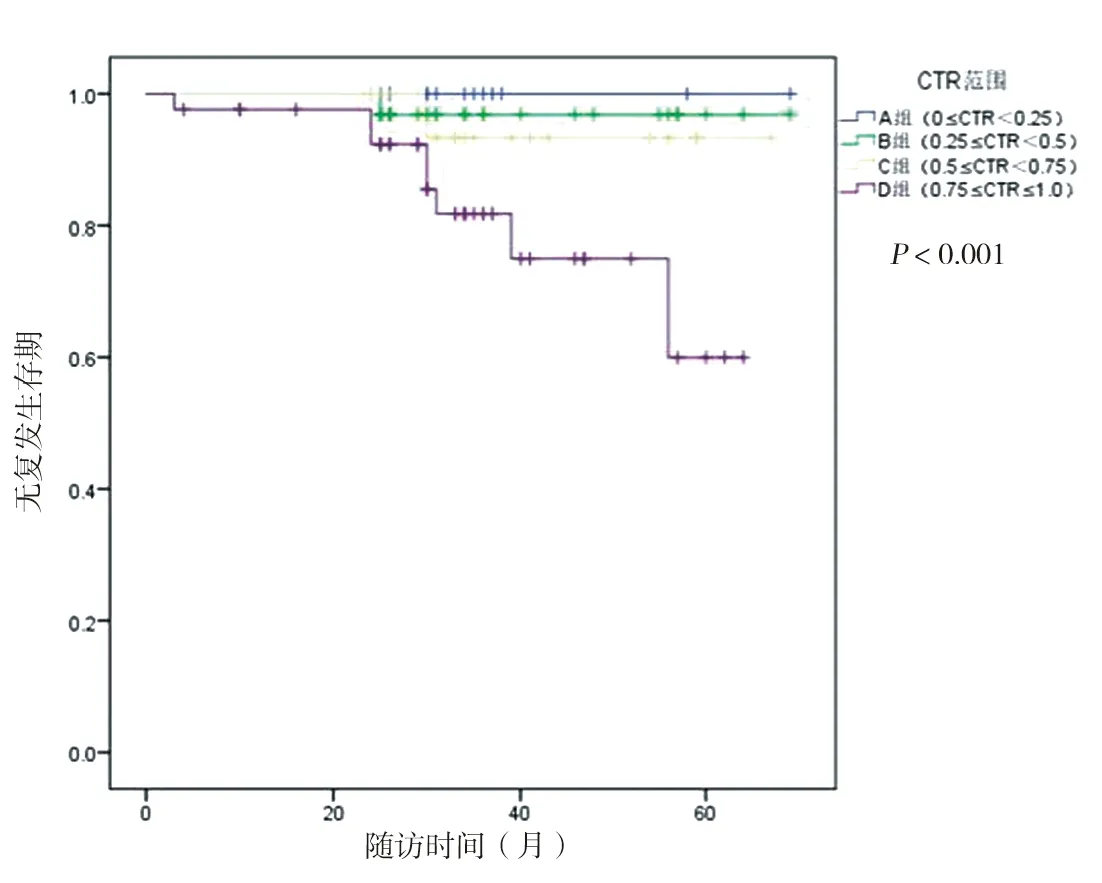
图4 不同CTR患者的无复发生存率

表5 A/B组与C/D组无复发生存率log-rank检验

表6 A/B组与C/D组总生存率log-rank检验
2.5 CTR的诊断价值 以术后病理结果为金标准,通过绘制CTR、GGO实性成分最大径、GGO最大径的影像学指标预测GGO侵袭程度及淋巴结转移的ROC曲线,见图5、6。其中CTR对GGO侵袭程度及淋巴结转移预测的AUC分别为0.841和0.884,对应的最佳截断值分别为0.603和0.733。CTR的AUC值均为最大,提示CTR对于GGO侵袭程度及淋巴结转移的预测均有良好的诊断价值。见表7、8。
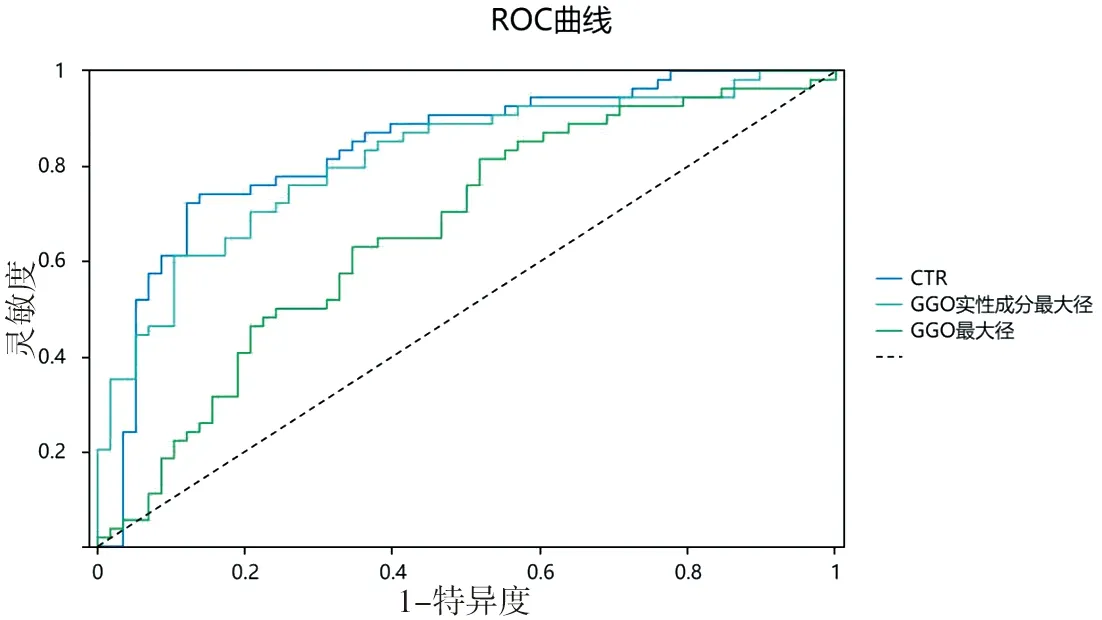
图5 不同CT参数对GGO良恶性预测的ROC曲线

图6 不同CT参数对GGO淋巴结转移预测的ROC曲线

表7 不同CT参数对GGO良恶性预测的ROC曲线AUC汇总
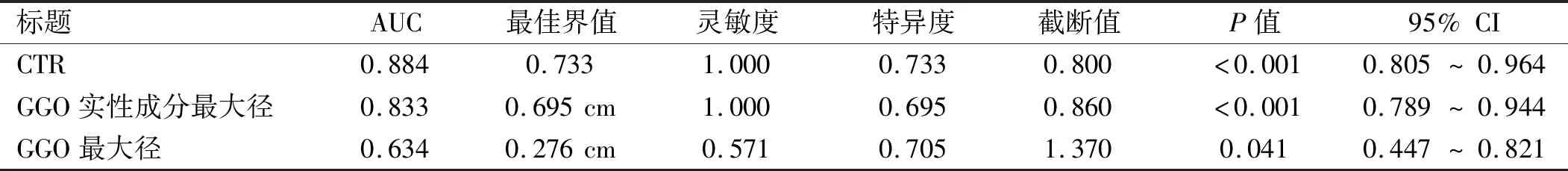
表8 不同CT参数对GGO淋巴结转移预测的ROC曲线AUC汇总
3 讨论
随着对肺癌高危人群CT筛查的开展,大量的GGO得以被筛查发现。大量的学者及临床工作者认为,对于实性成分占比高的亚实性GGO及纯实性GGO患者应该积极行手术干预[11]。目前针对GGO的管理策略,比较知名的有美国Fleischner学会[12]于2017年推出的肺结节管理指南以及2020年美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)制定的肺癌筛查指南[13]。然而不同指南对于GGO的干预策略仍存在一些差异。针对CT筛查提示的GGO病变,其术前诊断及手术范围的确定仍主要依据临床工作者的经验判断。近年来,CT的影像学定量指标在临床病理诊断中发挥重要作用,这些定量指标对明确GGO的性质有重要参考价值。其中,由于CTR通过量化分析准确反映GGO病变中的实性成分占比,因此被认为与GGO的病理恶性程度具有显著相关性。本研究发现,CTR的大小于GGO的恶性程度及预后具有密切相关性。
在本项研究中,通过Kaplan-Meier分析,对4组患者的OS及RFS进行统计,并对A/B组与C/D组进行log-rank检验,结果提示A/B组与C/D组的OS与RFS存在显著差异(P<0.05)。通过对GGO患者RFS的单因素及多因素分析,证实CTR与淋巴结转移为GGO预后的独立预后因素。淋巴结转移作为肺癌转移的一条重要途径,准确掌握淋巴结有无发生转移对肺癌的精准治疗具有重要意义。在本研究中,淋巴结转移作为患者预后的独立影响因素,与术后生存密切相关。张娇等[14]的研究表明,N分期越高,患者的生存预期越差,生存时间越短。本研究结果与其相似。
根据术后病理浸润程度,通过对GGO侵袭性的单因素及多因素logistics回归分析,证实CTR为GGO侵袭程度的独立危险因素。吕全喜等[15]的研究表明,CTR对早期肺癌的影像学诊断具有良好效果,且与病理学侵袭性具有良好的相关性。结合本研究结果中CTR可以作为预测GGO患者术后生存的独立影响因素,提示可以将CTR作为一项术前评价指标,从而为临床工作者的治疗方案的精准化制定提供帮助。
通过绘制ROC曲线,证实CTR对GGO的侵袭性及淋巴结转移的预测效果最佳。其对应最佳截断值与对应的AUC分别为0.603、0.841与0.733、0.884。根据相关文献[16-17]报道,当CTR大于0.504时,GGO表现为较强的侵袭性。在本次回顾性分析中,CTR对于判断GGO侵袭性的最佳截断值为0.603,这表明当CTR>0.603时,GGO更倾向于恶性病变,此时应做到R0切除。由于肺腺癌的阳性转移淋巴结在病理学检查时仍表现为正常大小,术前通过CT扫描明确淋巴结转移的情况仍然是个难点。在Shao等[8]的一项433例患者的回顾性研究表明,CTR是GGO淋巴结转移的独立危险因素,并明确CTR对GGO的淋巴结转移的临界值为0.795。这与本次回顾性分析中的最佳截断值0.733相似。以CTR这一临床上可视且易获得的量化指标可以为GGO的手术治疗方式的选择提供参考。虽然有研究表明对GGO行亚肺叶切除具有良好的预后[19],但淋巴结转移的出现则会导致接受亚肺叶切除的患者无复发生存率降低[20]。因此,对于选择CTR>0.733的GGO病变的手术方式的,淋巴结清扫是必要的。目前关于CTR与GGO病理类型及术后生存的相关性,特别是关于CTR截断值选择问题,国内外研究仍较少。综上所述,当CTR值大于0.603及0.733时,GGO的侵袭程度及淋巴结转移显著增加,此时应选择合适的外科干预方式。
同时,本研究依然存在一定的局限性。首先,由于本研究为单中心回顾性研究,存在样本量较小及选择性偏倚等问题。其次,由于随访时间较短,尽管在近期预后,但远期预后仍有待更深入的研究加以证实。
