CBL-CIPK信号系统参与小桐子抗冷性形成的生物信息学分析
2022-07-28王海波李芙蓉杨金翠郭俊云
王海波, 李芙蓉, 杨金翠, 郭俊云
( 1. 曲靖师范学院 生物资源与食品工程学院, 云南 曲靖 655011; 2. 曲靖师范学院 云南省高校云贵高原动植物遗传多样性及生态适应性进化重点实验室, 云南 曲靖 655011 )
蔗糖非发酵-1型相关蛋白激酶(sucrose non-fermenting-1 related protein kinase,SnRK)是广泛存在于植物中的丝氨酸/苏氨酸(Ser/Thr)类蛋白激酶家族。根据氨基酸序列聚类结果,SnRK家族分为SnRK1、SnRK2、SnRK3三个亚家族。SnRK3又被称为类钙调磷酸酶B亚基互作蛋白激酶CIPK(calcineurin B-like calcium sensor interacting protein kinase)(Shi et al., 1999; Kim et al., 2000) 或盐过敏感蛋白SOS(salt overly sensitive)(Ji et al., 2013),类钙调磷酸酶B亚基蛋白(calcineurin B-like calcium sensor,CBL)是CIPK的直接上游互作蛋白,也能够感知胞内Ca信号,共同组成Ca-CBL-CIPK级联信号系统,参与植物渗透、高盐、低温、高温等非生物逆境胁迫的响应过程(Li et al., 2009; Sanyal et al., 2016)。作为Ca受体蛋白,CBL都含有4个保守性不同的“螺旋-环-螺旋”(helix-loop-helix,HLH)EF手型(EF-hand)基序,是Ca结合所必需的(Weinl & Kudla, 2009),同时,部分CBL蛋白N端还具有脂类修饰的N-豆蔻酰化(N-Myristoylation)或N-棕榈酰化(N-Palmitoylation)位点,辅助该蛋白的跨膜转运(Batistic et al., 2008)。CIPK蛋白N端激酶结构域中都包含1个激活环(activation-loop)基序,位于-DFG-与-APE-序列之间,其中3个高度保守的Ser、Thr、Tyr残基是激酶活性发挥所必须的(Guo et al., 2001),而C端负责调控激酶结构域的催化活性,其中由21或24个氨基酸残基组成的FISL(Phe-Ile-Ser-Leu)/NAF(Asn-Ala-Phe)结构域是CIPK与CBL结合的核心序列(Du et al., 2011),正常情况下,FISL/NAF结构域与N端激酶结构域互作从而具有自抑制作用,当结合Ca而被激活的CBL蛋白与FISL/NAF结构域结合后,可解除FISL/NAF结构域对激酶结构区的抑制作用,从而表现出激酶活性(Akaboshi et al., 2008)。另外,C端还包含1个由37个氨基酸残基组成的PPI(protein phosphatase interaction)结构域,决定与CIPK结合的蛋白磷酸酶PP2C(protein phosphatase 2C)种类,也竞争性将CBL蛋白脱离FISL/NAF结构域,使CIPK回到自抑制状态(Ohta et al., 2003)。
目前,已经对多种植物在全基因组水平进行了与基因的鉴定,基因家族包括:拟南芥()10个(Kolukisaoglu et al., 2004)、水稻()10个(Kolukisaoglu et al., 2004)、玉米()10个(李利斌等, 2010)、杨树()10个(Zhang et al., 2008)、小麦()7个(Sun et al., 2015)、油菜()7个(Zhang et al., 2014)、茄子()5个(Li et al., 2016)等;基因家族包括:拟南芥25个(Kolukisaoglu et al., 2004)、水稻33个(Kolukisaoglu et al., 2004; Kanwar et al., 2014)、玉米43个(Chen et al., 2011)、杨树27个(Yu et al., 2007)、小麦20个(Sun et al., 2015)、大豆()52个(Zhu et al., 2016)、油菜23个(Zhang et al., 2014)、茄子15个(Li et al., 2016)、苹果()34个(Niu et al., 2018)、葡萄()16个(路志浩等, 2017)、番茄()22个(王傲雪和刘思源, 2018)等。小桐子()属大戟科(Euphorbiaceae)麻疯树属(Linnaeus)多年生落叶小型乔木,原产中南美洲地区(林娟等, 2004)。作为重要的木本油料植物,小桐子种子含油量为35%~60%,适应各种柴油发动机,且关键技术指标达到了欧IV标准,具有广阔的开发利用前景(Makkar & Becker, 2009)。目前,对于小桐子与家族的基因鉴定及其互作分析还未见报道。本研究基于小桐子基因组信息(Sato et al., 2011),利用生物信息学方法鉴定小桐子与基因,并对其理化性质、基因结构、蛋白基序、系统进化、低温表达及功能互作进行了分析,以期为研究小桐子与基因家族的抗逆信号转导机制奠定基础。
1 材料与方法
1.1 CBL与CIPK基因家族的鉴定
根据Kolukisaoglu等(2004)、Zhang等(2008)、Yu等(2007)鉴定的模式植物拟南芥、水稻及小桐子近科物种杨树的与基因家族序列,从TAIR数据库(https://www.arabidopsis.org/)下载拟南芥10个基因与25个基因的蛋白序列,从PlantBiology数据库(http://rice.plantbiology.msu.edu/)下载水稻10个基因与33个基因的蛋白序列,从Phytozome数据库(https://phytozome.jgi.doe.gov/pz/portal.html)下载杨树10个基因与27个基因的蛋白质序列,通过Clustal X进行多重序列比对,利用Hmmer 3.0软件的Hmmbuild程序将比对文件生成CBL与CIPK结构域的隐马可夫HMM模型。同时,分别从GenBank(http://www.ncbi.nlm.nih.gov/genome/915/)与Kazusa(http://www.kazusa.or.jp/jatropha/)(Sato et al., 2011)下载小桐子最新注释蛋白质数据库,利用NCBI的Makeblastdb程序将该数据库本地化。利用NCBI Blast程序对小桐子蛋白质数据库进行本地BlastP相似性比对(阈值E<1e-10,序列相似性>50%),得到初步筛选的小桐子CBL与CIPK蛋白质序列。通过序列自对比(self-blast)去除重复序列,将非冗余的候选序列利用Pfam(http://pfam.sanger.ac.uk/)与CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线工具分析CBL的EF-hand基序与CIPK的蛋白激酶结构域(protein kinase domain)做进一步筛选,得到小桐子CBL与CIPK家族蛋白序列。同时下载其对应的基因序列与mRNA序列用于后续基因结构分析。
1.2 CBL与CIPK基因家族的序列分析
利用ExPaSy提供的在线工具ProtParam(http://web.expasy.org/protparam/)对小桐子CBL与CIPK进行氨基酸数目、理论分子量(Mw)、等电点(pI)等基本参数的分析。将鉴定的小桐子CBL与CIPK蛋白序列与拟南芥、水稻及杨树的CBL与CIPK蛋白序列利用Clustal X进行序列相似性比对,然后用MEGA 6.0软件通过邻接法(NJ)构建系统进化树,并采用自展法(bootstrap)进行检验。同时,利用GenDOC软件对Clustal X比对结果进行CBL与CIPK蛋白保守结构域分析。另外,通过CDS序列(coding sequence)与基因序列比对以确定与基因内含子与外显子的结构,并利用GSDS(gene structure display server,http://gsds.cbi.pku.edu.cn/)绘制基因结构图。另外,染色体定位以Wu等(2015)构建的小桐子遗传连锁图谱进行锚定,并通过MapChart(version2.1)绘制基因定位图。利用STRING(http://string-db.org)进行CBL与CIPK蛋白的信号互作网络分析(设置可信度大于0.7)。
1.3 CBL与CIPK基因家族的表达分析
从GenBank的SRA数据库下载小桐子不同器官的Illumina高通量测序数据(叶片SRR1639660、根SRR1639659、种子SRR1639661)。通过Bowtie2与Samtools工具将鉴定到的小桐子与家族基因与测序数据进行比对,得到各与基因的表达reads数据,之后通过Cufflinks程序计算每个基因的表达量FPKM(fragments per kilobase per million)值,进行以2为底的对数转化,并设置以基因与器官同时进行聚类,聚类方法选择层次聚类法(hierarchical clustering)。另外,以我们前期小桐子转录组(Wang et al., 2014)与数字基因表达谱(digital gene expression,DGE)(Wang et al., 2013)数据为基础,提取对照与12 ℃低温处理12、24、48 h的与基因的原始Clean Taq数据,通过TPM(transcript per million clean tags)获得标准化的基因表达量(Thoen et al., 2008; Morrissy et al., 2009),得到小桐子与基因家族在低温处理下的差异表达数据。利用R软件(version 3.4.1)的gplots与pheatmap函数绘制聚类分析热图(heatmap)。
2 结果与分析
2.1 CBL与CIPK的鉴定及序列特征
通过同源序列比对检索,在小桐子基因组中共鉴定到8个基因(1~8)与18个基因(1~18)(表1)。通过ExPASy工具对小桐子与家族基因进行理化参数的分析,结果表明,家族基因长度分布在2 172 bp(7)~9 344 bp(2)之间,蛋白质序列长度分布在211 aa(JcCBL8)~257 aa(JcCBL7)之间,等电点全部显强酸性,分布在4.59(JcCBL5)~5.08(JcCBL4)之间。另外,家族基因长度分布在1 522 bp(16)~9 348 bp(9)之间,蛋白质序列长度分布在422 aa(JcCIPK16)~484 aa(JcCIPK2)之间,除JcCIPK9、JcCIPK14、JcCIPK15及JcCIPK17,等电点全部呈强碱性,分布在8.03(JcCIPK2)~9.26(JcCIPK4)之间。
2.2 CBL与CIPK基因的系统进化与基因结构
通过MEGA分别构建小桐子与拟南芥、水稻、杨树的与基因家族系统进化树(图1),结果表明,基因家族聚类为I、II、III、IV四个亚族,小桐子对应基因数量分别为3(4、6、8)、1(3)、2(5、7)、2(1、2)(图1: A),与小桐子基因家族单独聚类结果吻合(图2: A),其中3在单独聚类中与1、2距离较近,而在多物种共聚类中则属单独II亚族,与3基因结构(9个外显子)不同于1、2(10个外显子)一致。另外,基因家族共聚类为6个亚族,小桐子对应基因数量分别为3、1、5、2、2、5(图1: B),也与小桐子基因家族单独聚类结果吻合(图2: B)。
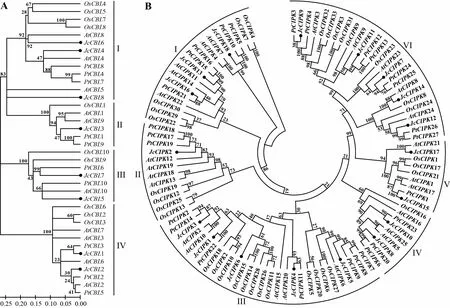
A. CBL基因家族; B. CIPK基因家族。下同。A. CBL gene family; B. CIPK gene family. The same below.图 1 小桐子与拟南芥、水稻及杨树CBL与CIPK基因家族的系统进化分析 Fig. 1 Phylogenetic relationship analysis of Jatropha curcas with Arabidopsis thaliana, Oryza sativa, and Populus trichocarpa CBL and CIPK gene families
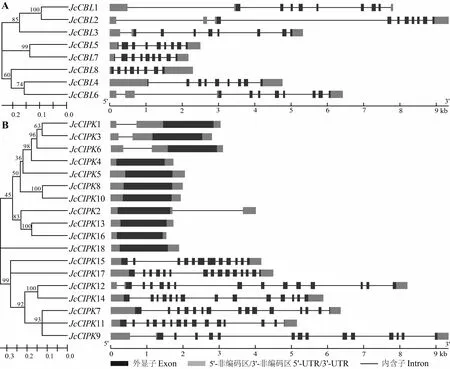
图 2 小桐子CBL与CIPK家族基因的基因结构 Fig. 2 Gene structure features of CBL and CIPK gene families in Jatropha curcas
结合小桐子与基因家族的聚类结果,利用GSDS工具分析其基因结构,结果显示,小桐子与基因家族的亚族聚类特性与基因结构吻合。小桐子8个基因的外显子数量为8~10个(表1),且都包含5′-UTR与3′-UTR区域,其中亚族III的5(2 501 bp)与7(2 172 bp)都包含9个外显子,且基因都较短,而亚族IV的1(7 811 bp)与2(9 344 bp)都包含10个外显子,且基因都较长(图2: A)。Kolukisaoglu等(2004)报道的其他物种基因家族的聚类结果与基因结构关系,小桐子基因家族也都包含5′-UTR与3′-UTR区域,18个基因成员根据基因结构分为两大类,11个基因包含1~2个外显子,其中4、5、8、10、13、16和18仅包含1个外显子,而1、2、3和6包含2个外显子。另外,7个基因包含12~15个外显子,其中7、9、11、12和17都包含15个外显子,而14与15分别包含14个与12个外显子(图2: B)。
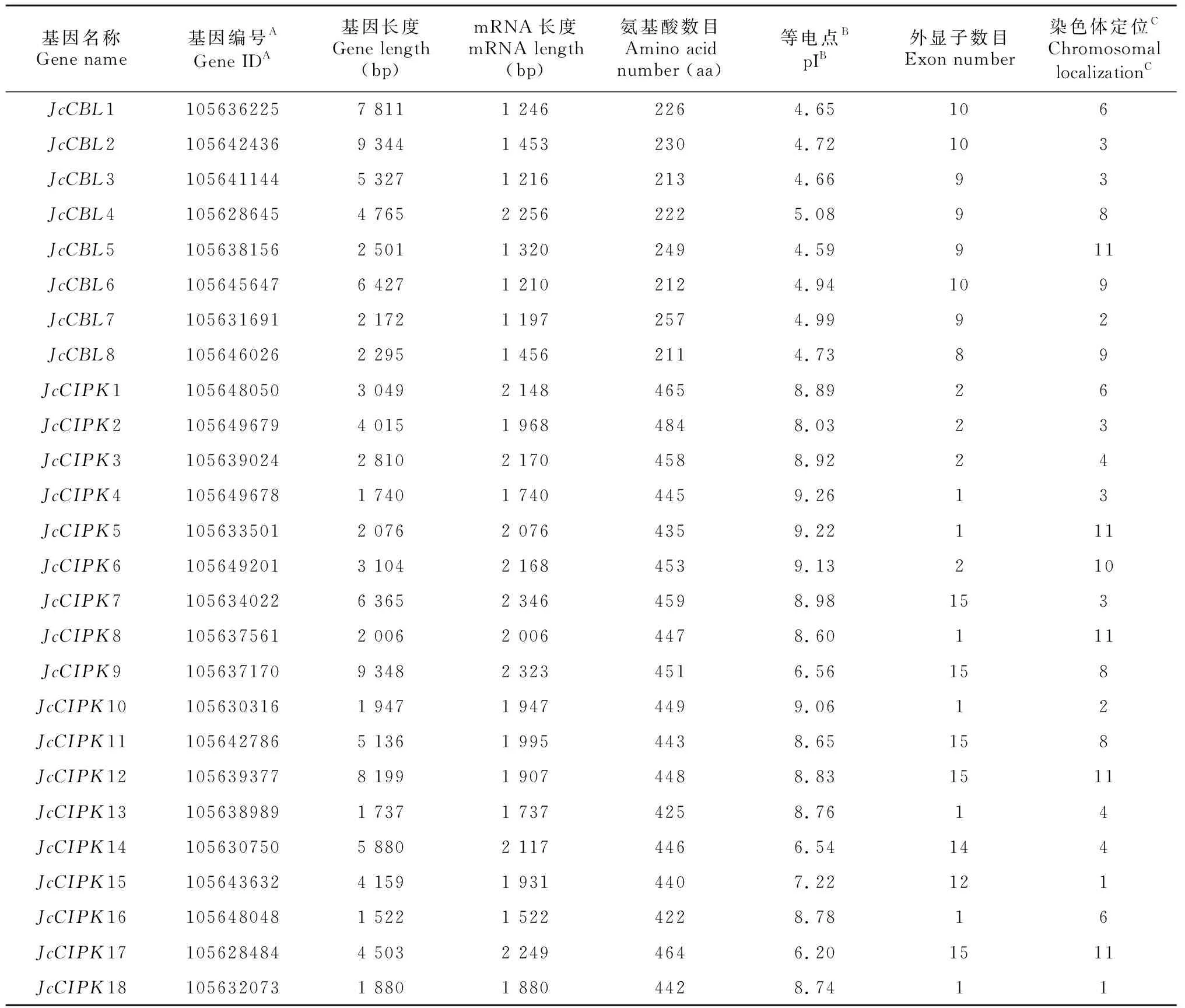
表 1 小桐子CBL与CIPK基因家族的序列特征Table 1 Sequence characteristic of Jatropha curcas CBL and CIPK gene families
2.3 CBL与CIPK氨基酸序列及结构域分析
Kolukisaoglu等(2004)研究表明,CBL蛋白含有4个保守性不同的EF-hand手型基序,螺旋-环-螺旋作为EF-hand的典型结构,中间环(包含12个氨基酸残基,共有序列为-DKDGDGKIDFEE-)的1(X)、3(Y)、5(Z)、7(-Y)、9(-X)、12(-Z)位氨基酸残基较为保守,被认为是CBL蛋白结合Ca所必需的(图3: A)。通过分析8个小桐子CBL蛋白的氨基酸序列显示,第一个EF-hand(EF1)都具有14个氨基酸残基,不是典型的EF-hand结构, 而第2~4个EF-hand(EF2-4)具有典型的12个氨基酸残基,其中除第1位(Asp)和第12位(Glu)氨基酸绝对保守外,其他氨基酸位(3、5、7、9位)都发生了部分取代,且EF4、EF3和EF2的氨基酸取代率逐渐增加。另外,第3位Asp(D)在EF2中被Lys(K)取代,在EF3中被Lys(K)与Arg(R)取代,在EF4中被Lys(K)与Asn(N)取代;第5位Asp(D)在EF2中被Asn(N)与Lys(K)取代,在EF3中被Gln(Q)与Asn(N)取代;第7位Lys(K)在EF2中被Val(V)与Ile(I)取代,在EF3中被Phe(F)与Try(Y)取代;第9位Asp(D)在EF2与EF3中都被Glu(E)取代(图3: B)。以上结果显示,EF-hand2-4结构中都被相同类型的氨基酸取代,保证了EF-hand结合Ca的能力与多样性。另外,根据N端区域的长度,小桐子CBL家族的JcCBL1、JcCBL2、JcCBL3、JcCBL4、JcCBL6和JcCBL8包含16~34 aa较短的N端序列,且在JcCBL3与JcCBL8 N端鉴定到-MGCXXSK/T-的豆蔻酰化序列,以加强CBL蛋白与膜的结合,而JcCBL5与JcCBL7则包含较长的N端序列(图3: A)。

A. 小桐子CBL蛋白N端结构域,下划线表示JcCBL3与JcCBL8的N端豆蔻酰化结构域; B. 小桐子CBL蛋白4个EF手型基序序列比对(EF1-4); C. 小桐子CIPK蛋白N端激酶结构域中的功能激活环,箭头表示保守的Ser、Thr、Tyr残基; D. 小桐子CIPK蛋白FISL/NAF结构域。A. N-terminal domain of J. curcas CBL proteins, N-Myristoylation domains of JcCBL3 and JcCBL8 were underlined; B. Sequence alignment of CBL EF-hand (EF1-4) in J. curcas; C. Activation loop within N-terminal kinase domain in J. curcas CIPK protein was presented, conserved amino acid residues of Ser, Thr, and Tyr were marked by arrows; D. FISL/NAF domain of J. curcas CIPK proteins.图 3 小桐子CBL与CIPK结构域序列比对Fig. 3 Sequence alignment of Jatropha curcas CBL and CIPK domains
植物特有的CIPK蛋白也称为SnRK3,该激酶与酵母SNF1、哺乳动物AMPK同源,都具有N端激酶结构域,其中内部激活环(activation-loop)基序发挥核心作用。在小桐子18个CIPK蛋白的N-端都鉴定到被-DFG-与-APE-序列(图3: C下划线表示)间隔的激活环基序(图3: C),且都包含保守的Ser、Thr和Tyr氨基酸残基(图3: C箭头所示)。另外,在C端都鉴定到CIPK蛋白21 aa自抑制基序FISL/NAF的保守-NAF-序列(图3: D下划线表示),以保证CIPK蛋白正常处于自抑制状态。
2.4 CBL与CIPK基因家族的染色体定位
依据Wu等(2015)构建的小桐子高密度遗传连锁图谱,在染色体水平定位小桐子与基因,结果表明,除5号与7号染色体没有基因分布外,26个小桐子与基因不均匀地分布于9条染色体上,其中3号与11号染色体上的基因数量最多5个,而10号染色体上的基因数量最少,仅包含1个6基因,进一步鉴定到9号染色体上基因家族的串联复制基因6/8,以及3号、4号、6号染色体上基因家族的串联复制基因2/4、3/13和1/16(图4),推测该类基因发生了倍增。

竖线表示基因串联复制; 刻度表示厘摩; LG表示染色体。Vertical line indicates tandem duplication; Scale is in centiMorgans (cM); LG means chromosome.图 4 小桐子CBL与CIPK基因家族的染色体定位Fig. 4 Chromosomal localization of Jatropha curcas CBL and CIPK gene families
2.5 CBL与CIPK基因的差异表达分析
基于GenBank小桐子转录组数据,通过Cufflinks程序得到小桐子与基因家族26个基因的器官表达数据(图5)。结果表明,除6与8在种子中没有表达外,其他24个小桐子与基因在叶片、根及种子中都有表达。其中,2、1、3、5、7、8、13和18在三种器官中表达量都较高(logFPKM>3.5),其中5在三种器官中表达量都最高,推测在小桐子Ca-CBL-CIPK信号转导系统中处于核心地位。其他基因存在器官表达特异性,4在叶片中表达量较高,而在种子中表达量较低;7只在根中表达,而在叶片与种子中表达量甚微;4在叶片与根中表达量较高,而在种子中基本没有表达(图5)。
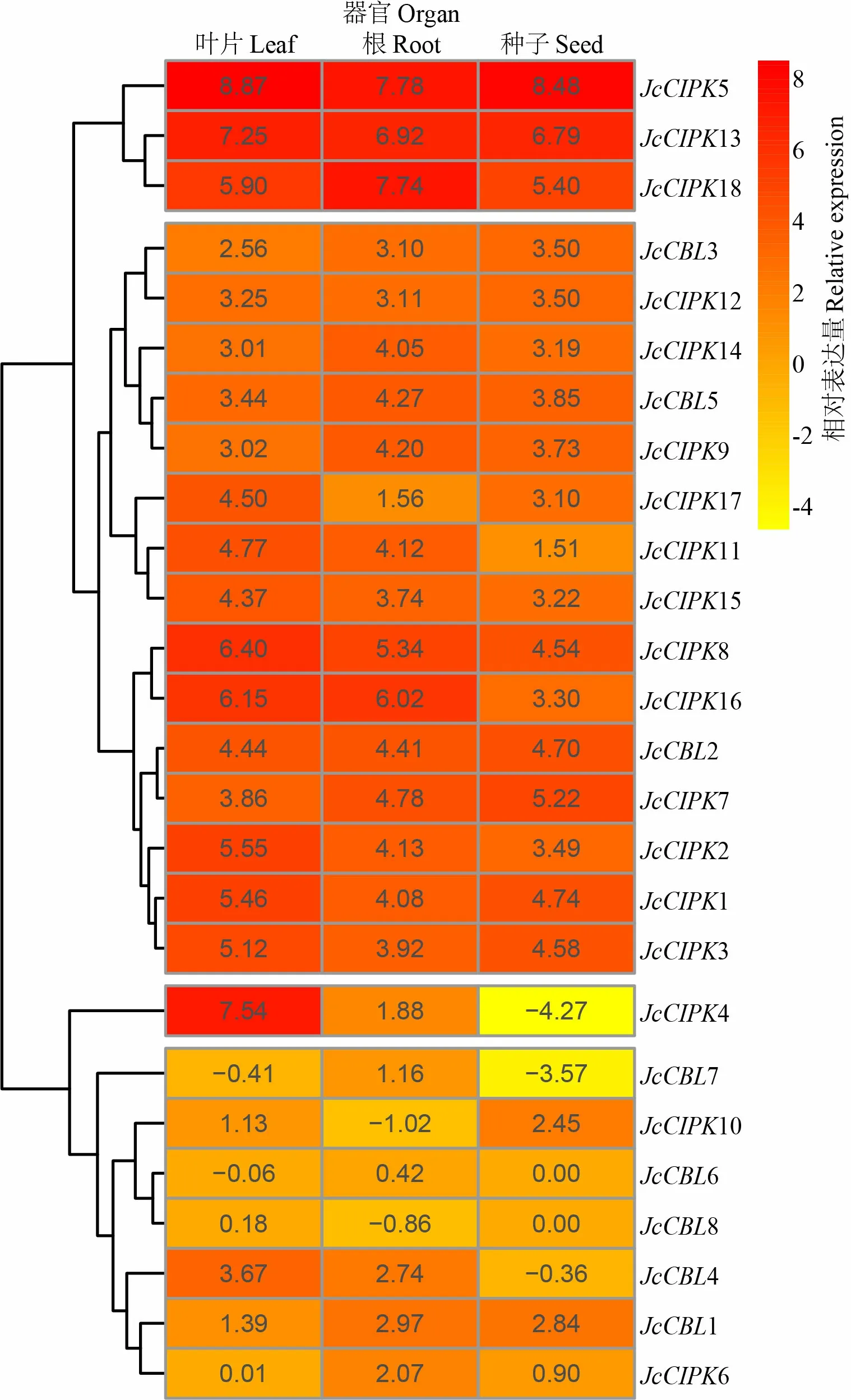
图 5 小桐子CBL与CIPK家族基因的器官差异表达分析Fig. 5 Differential expression analysis of Jatropha curcas CBL and CIPK gene families in different organs
通过DGE数据分析得到9个小桐子与家族基因在低温处理条件下的表达数据(图6)。与对照相比,14与18在12 ℃低温处理12、24、48 h时上调表达量都达到了极显著水平(<0.01),与小桐子的抗冷性直接相关。另外,4与16随着低温处理时间的延长,表达量也在逐渐提高,在低温处理48 h时,分别较对照上调表达9.92倍(<0.01)与2.10倍。同时,1与2是响应低温较快的基因,其表达量都在低温处理12 h时达到最大,分别较对照上调表达5.21倍与2.87倍,之后表达量逐渐下调(图6)。
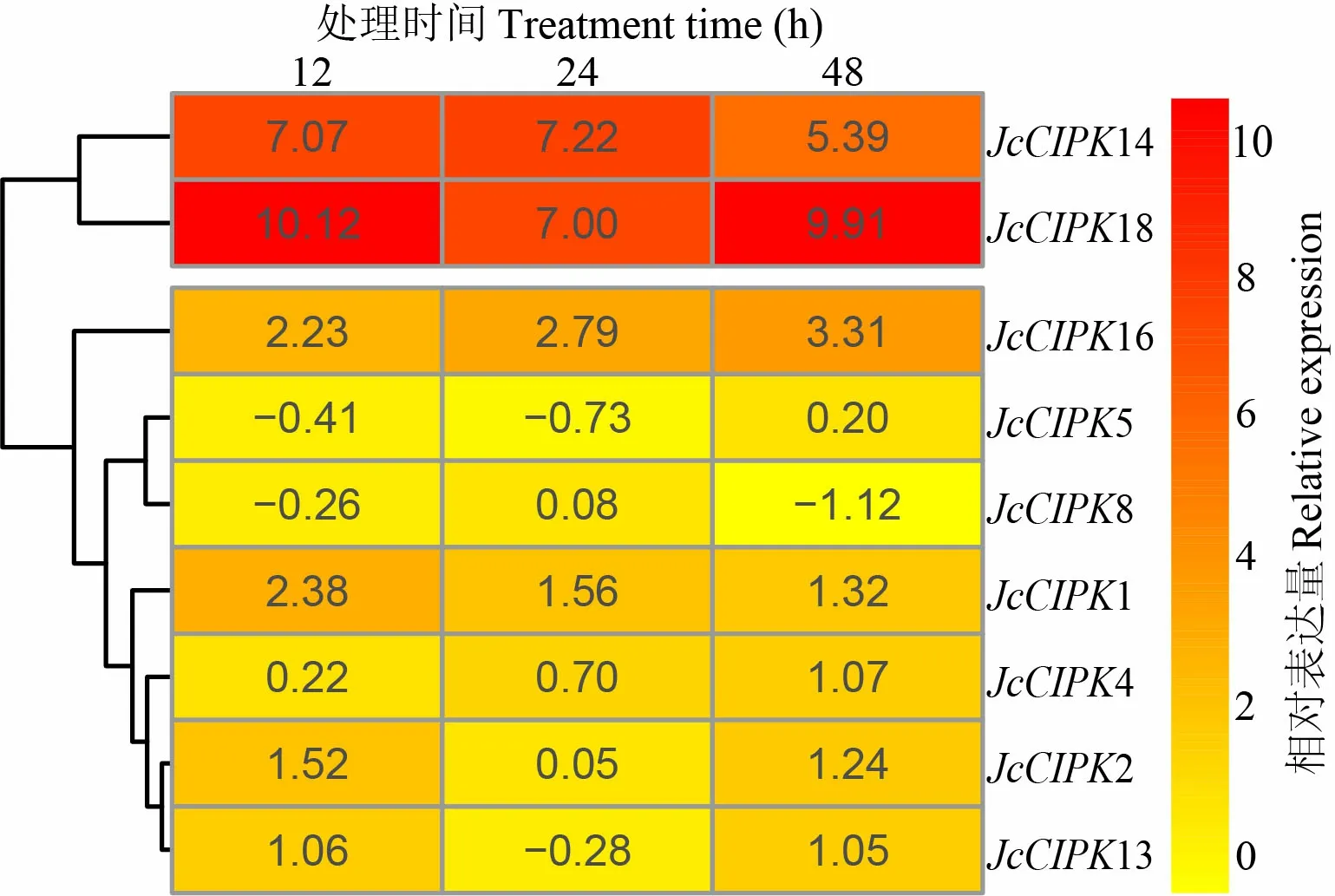
图 6 小桐子CBL与CIPK家族基因的低温处理表达分析Fig. 6 Expression analysis of Jatropha curcas CBL and CIPK gene families under chilling stress
2.6 CBL与CIPK蛋白的互作网络解析
基于小桐子、拟南芥CBL和CIPK同源蛋白,通过STRING 10.5进行蛋白互作网络分析,以解析其参与的信号转导途径以及可能的潜在功能。结果表明,在可信度为0.7的情况下,除JcCIPK1、JcCIPK3、JcCIPK4和JcCIPK6外,另外8个JcCBLs与14个JcCIPKs都参与了典型的CBL-CIPK信号转导途径,且表现出一对多与多对一的互作模式。其中,JcCBL1/2、JcCBL3可分别与12个、10个JcCIPKs互作结合,推测两者在Ca-CBL-CIPK信号网络中可能发挥关键作用,而JcCBL6只能与JcCIPK7和JcCIPK16互作结合。同时,JcCIPK7可以与所有8个小桐子JcCBLs结合,而JcCIPK17与JcCIPK18仅可与JcCBL1/2结合(图7)。
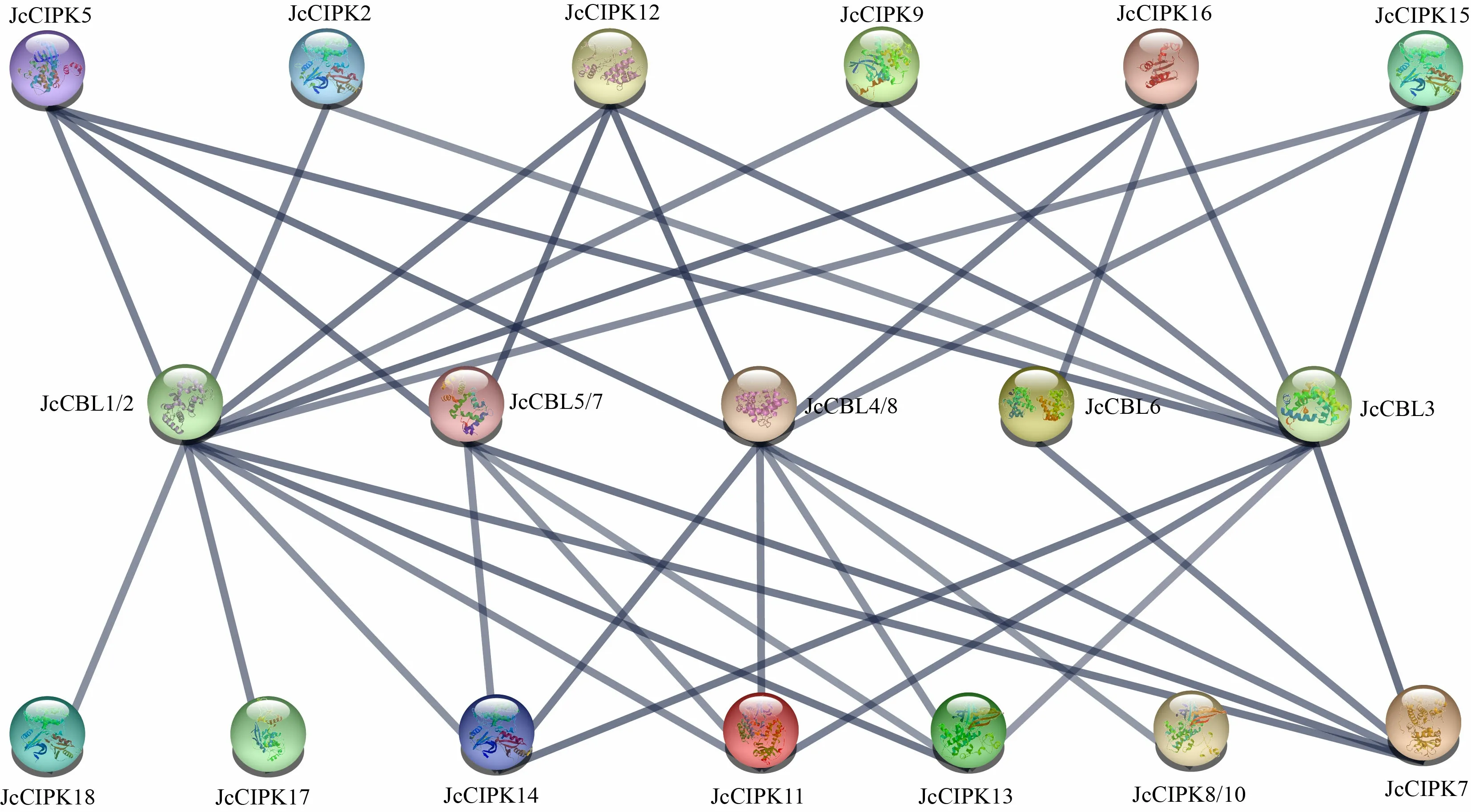
图 7 小桐子与拟南芥同源CBL与CIPK蛋白的互作网络分析Fig. 7 Interaction network analysis of CBL and CIPK proteins identified in Jatropha curcas and homologous proteins in Arabidopsis thaliana
3 讨论与结论
传递类Ca结合蛋白CBL通过解码与感知Ca浓度与分布的变化(Scrase-Field & Knight, 2003; Batistic & Kudla, 2012),并特异结合下游CIPK蛋白共同组成Ca-CBL-CIPK信号系统参与小桐子的抗冷性过程(Sanders et al., 2002)。本研究在小桐子全基因组共鉴定到8个基因与18个基因,其蛋白长度、基因结构都较为保守,尤其CBL与CIPK蛋白的等电点都具有显著的家族特异性,CBL蛋白等电点都呈酸性,而CIPK蛋白等电点大部分都呈碱性,即生理pH环境条件下,这两类互作蛋白带相反的电荷,预示静电库伦力在CBL蛋白结合CIPK蛋白FISL/NAF结构域中可能发挥重要作用。同时,酵母双杂交实验表明,小桐子与拟南芥CBL与CIPK互作结合还表现出交叉性与偏好性(Kim et al., 2000; Guo et al., 2001),如小桐子JcCBL1/2可以与12个JcCIPKs结合,而JcCIPK7可与所有鉴定的小桐子JcCBLs结合,另外,JcCIPK17与JcCIPK18偏好结合JcCBL1/2,而JcCIPK8/10则偏好结合JcCBL4/8。本研究结果与Kim等(2000)的类似,拟南芥AtCIPK7/17偏好结合AtCBL9;AtCIPK24偏好结合AtCBL4;AtCIPK9偏好结合AtCBL2。这种特异性与偏好性,主要由CBL蛋白的EF手型基序决定的Ca结合能力(Nagae et al., 2003; Sanchez-Barrena et al., 2005)、CIPK蛋白的FISL/NAF结构域及其两侧序列结构差异性决定(Kim et al., 2000; Halfter et al., 2000; Guo et al., 2001)。与典型的12个氨基酸残基EF手型基序不同,8个小桐子CBL蛋白的第一个EF手型基序都由14个氨基酸残基组成,较其他3个EF手型基序都变异较大,且Asp(D)多被Ser(S)取代,推测该基序决定了小桐子CBL蛋白与Ca不同的亲和力,赋予小桐子CBL蛋白同时解码不同Ca信号的能力(Sanchez-Barrena et al., 2007;Weinl & Kudla, 2009)。当CIPK蛋白的FISL/NAF结构域结合CBL后,导致CIPK激酶结构域中激活环保守氨基酸磷酸化而被激活(Weinl & Kudla, 2009)。本研究中小桐子CIPK蛋白激活环都位于保守的-DFG-与-APE-之间,且都鉴定到三个保守磷酸化的Ser(S)、Thr(T)及Tyr(Y)残基作为激活位点。
从低等到高等植物,CBL-CIPK信号系统进化与植物的环境适应性如生物与非生物胁迫是协同的(Weinl & Kudla, 2009)。小桐子起源热带,具备较强的抗旱、抗盐能力,但对低温环境耐受力有限。CBL-CIPK信号系统的研究始于拟南芥高盐超敏感SOS途径(salt overly sensitive),当拟南芥遭受高盐胁迫时,AtCBL4(SOS3)、AtCBL10结合Ca,再与AtCIPK24(SOS2)结合形成蛋白复合体,通过AtCBL4/10-AtCIPK24途径调控细胞膜与液泡膜上Na-K逆转运蛋白(SOS1),将过量的Na泵动至胞外或区隔化至液泡中,从而抵抗或减轻高盐胁迫的伤害(Zhu, 2002; Quan et al., 2007),根据拟南芥同源蛋白比较,小桐子对应的SOS级联途径为JcCBL4/5/7-JcCIPK12。基于同样的方法,本研究还鉴定到小桐子抗旱信号途径JcCBL3-JcCIPK15,而对应拟南芥通过AtCBL1/9-AtCIPK1信号途径进行感知,并促进基因家族表达,进而实现渗透平衡,以达到抗旱的目的(Dangelo et al., 2006)。作为低温敏感植物,小桐子在低温环境下,同样会启动CBL-CIPK信号系统,并传递至下游抗冷相关转录因子或关键限速蛋白的基因。本研究中,通过小桐子12 °C低温处理转录组数据,也鉴定到与小桐子抗冷性密切相关的14与18,成为后续克隆与抗冷性功能鉴定的重要候选基因。文献报道,低温胁迫下,拟南芥通过AtCBL1-AtCIPK3感知将信号传递至下游抗冷性相关转录因子如RD29A (Kim et al., 2003),而水稻和玉米分别通过OsCIPK3与ZmCIPK3作用于渗透相关基因,通过提高转基因株系的脯氨酸和可溶性糖含量,进而提高其抗冷性(Xiong et al., 2007; 边鸣镝等, 2008),说明以上转录因子与代谢途径是验证小桐子CBL-CIPK低温信号途径下游作用机制的主要研究方向。
