大剂量维生素C选择性杀伤TSC2基因突变细胞抑制其增殖
2022-07-27夏盈峰方明刘梦玲余雅婕李敏
夏盈峰,方明,刘梦玲,余雅婕,李敏
(三峡大学人民医院.宜昌市第一人民医院神经内科,湖北 宜昌 443000)
0 引言
结节性硬化症(Tuberous sclerosis complex,TSC)为常染色体显性遗传多系统良性肿瘤综合症,患病率为1/6000-1/10000,全球有近100万人罹患此病,而在中国约有20万患者[1,2]。其典型的临床特征包括心脏横纹肌瘤,面部血管纤维瘤、大脑皮层结节、室管膜下巨细胞星形细胞瘤,肾脏血管肌脂瘤等,严重时引起脑积水、肾脏肿瘤破裂出血、肾功能衰竭或肾癌,呼吸衰竭,可危及病人生命[3,4]。因为受众相对较少,与其它罕见病一样,人们对结节性硬化症缺乏重视,药物鲜有开发,这使得探索新型药物治疗结节性硬化症显得尤为重要。
1978年Fryer等人首次发现并报道了1个与TSC发病相关的致病基因并命名为TSC1基因,随后于1992年Kandt等人发现并报道了另一个与该病密切相关基因并命名为TSC2,研究发现,在大约80%的结节性硬化症病人可以发现存在抑癌基因TSC1或TSC2的失活性突变[5,6]。生理状态下TSC1和TSC2作为一蛋白质复合体,负性调节雷帕霉素靶蛋白(mTOR)的功能。mTOR作为一个细胞内承上启下的丝氨酸/苏氨酸蛋白激酶枢纽,主要通过整合生长因子和营养信号来调控细胞生长、增殖、分化和代谢等多种重要生物学过程[7],然而TSC1和TSC2的突变导致mTOR通路的过度活化,引起细胞的异常增殖,引发TSC病变,临床表现为心脏横纹肌瘤,面部血管纤维瘤、大脑皮层结节、室管膜下巨细胞星形细胞瘤等[6-9],已证实应用mTOR特异性抑制剂雷帕霉素(Rapamycin)及其衍生物拮抗过度活化的mTOR能显著改善TSC患者的临床症状[10-12],但rapamycin及其衍生物只部分抑制细胞增长,停药后TSC患者异常增殖的体细胞会恢复生长且目前相关药物售价昂贵,另一方面约 10%-30% 的患者在使用 mTOR 抑制剂过程 中会出现不良反应,临床上常见有 :上呼吸道感染、 口腔炎、痤疮、关节痛、可逆性双下肢水肿、腹泻血液学检查可能出现肝酶或碱性磷酸酶轻度升高, 血脂异常,白细胞、血红蛋白及血小板减低,严重者可能还会出现心包炎或肺炎等情况等[12,13]。因此,深入了解结节性硬化症发病机制和寻找更好的治疗方法,是目前亟待解决的问题。
维生素 C又称抗坏血酸(Ascorbic Acid)是生物体内不可缺少的必需营养素,细胞内外维生素 C转运的形式为脱氧抗坏血酸(Dehydroascorbate,DHA),同时依赖于细胞膜表面的葡萄糖转运蛋白(Facilitative Glucose Transporters,GLUTs)和维生素 C钠协同转运蛋白(Sodium 维生素 C Cotransporters,SVCTs),转运入细胞内的DHA在谷光甘肽(GSH)、硫氧环蛋白及NADPH作用下还原为维生素 C,在该过程中可产生活性氧(ROS)[14-17]。有临床研究表明,高剂量静脉注射维生素C(在大多数试验中,每周两次或每周三次50-100 g)可作为治疗各种癌症的方法,包括胶质母细胞瘤,卵巢癌,前列腺癌,肺癌或直肠癌。与放射和/或标准化学疗法联用时,具有良好的耐受性,且毒性极小,改善了患者的生活质量,并具有协同治疗作用,并减少了其副作用。然而,这些研究大多数都不是作为大规模的随机临床试验而设计的,目前对维生素C的临床疗效的明确验证相当有限[18,19]。2015年Yun J等人研究发现维生素 C可选择性抑制KRAS和BRAF突变的结直肠癌细胞,其主要机制是因KRAS和BRAF突变能够显著增加结直肠癌细胞表面的葡萄糖转运蛋白(GLUTs),使进入细胞中DHA增多,增多的DHA在细胞内还原为维生素 C的过程中产生大量活性氧(ROS),从而导致细胞死亡。而Zhang Hongbing等人的研究证实在TSC2缺失的小鼠成纤维细胞(MEFs)中活化的mTOR可增加细胞中GLUT1和GLUT3的表达水平[20]。因此我们猜测:维生素 C是否能够通过GLUT1和GLUT3而选择性抑制TSC突变所致的细胞异常增殖呢?通过研究我们在细胞水平证实了维生素 C可选择性增加TSC突变细胞内活性氧(ROS)而导致细胞死亡,并初步揭示了维生素 C选择性抑制TSC突变所致的细胞异常增殖的作用机制,这有望为结节性硬化症及mTOR通路异常激活肿瘤的靶向治疗提供新的方法及思路。
1 材料与方法
1.1 实验材料及试剂
小鼠P53基因敲除成纤维细胞系、P53、TSC2敲除成纤维细胞系、TSC2基因缺失宫颈癌细胞系323V及敲入细胞系323T2细胞系均来源于中国医学科学院基础医学研究所张宏冰教授实验室;胎牛血清(FBS)、DMEM培养基、PBS 缓冲液、青霉素和链霉素均购自美国Gibco公司, RNA 纯化试剂盒和 qPCR 试剂盒均购 于 QIAGEN 公司, MTT 及、DMSO 试剂、雷帕霉素粉末均购于 Sigma公司,TRIzol RNA 提取试剂盒、Thermo 逆转录试剂盒购自 Thermo Fisher Scientific 公司。SYBRGreen试剂购买于Takara公司。
1.2 细胞培养与药物处理
细胞培养P53基因敲除细胞及P53和TSC2基因敲除细胞分别置于补充有 10% 胎牛血清,100 U/mL 青霉素和 100 mg/mL 链霉素的DMEM培养基中,并在 37 °C 、5% CO2且饱和湿度的恒温培养箱中培养。
1.3 MTT检测细胞增殖
处于生长对数期P53基因敲除细胞及P54、TSC2基因敲除细胞接种于96孔板中,接种24小时后分别于培养基中加入不同浓度维生素C,终浓度为4uM 40uM 200uM、600uM、800uM及1mM,分别于12小时、24小时、36小时及48小时,吸净上清,PBS洗一遍,加入 150 μL MTT 试剂,孵育4小时后加入DMSO,使用酶标仪在 570 nm 处测量光密度。计算细胞增殖抑制率。
处于生长对数期P53基因敲除细胞及P54、TSC2基因敲除细胞接种于96孔板中,接种12小时后于所有细胞中加入终浓度为10nMRapamycine或DMSO作用24小时后,加入终浓度为4uM 40uM 200uM、600uM、800uM及1mM维生素C,作用24小时后,洗净上清,PBS洗一遍,加入 150 μL MTT 试剂。孵育4小时后加入DMSO,使用酶标仪在 570 nm 处测量光密度。计算细胞增殖抑制率。
1.4 细胞ROS检测
细胞以每孔200000至300000个细胞的密度接种在含有10%FBS的DMEM培养基中的12孔培养板中。48小时后,移除培养基,用PBS清洗细胞,并在含有5 mM维生素C的培养基中培养(不含酚红的DMEM培养基)。在37℃下培养30min后,将最终浓度为10μm的2',7'-二氯荧光素二乙酸酯(DCF-DA,Sigma)添加到培养基中,并将细胞进一步培养30min。用胰蛋白酶消化细胞,用PBS重新悬浮,并用BC FACS Canto II流式细胞仪(BD Biosciences)获取数据并用FlowJo分析软件进行了分析。实验重复三次。
1.5 实时荧光定量PCR
处于生长对数期P53基因敲除细胞及P54、TSC2基因敲除细胞接种于6孔板中,12小时后分别加入终浓度为10nM及20nMRapamycine继续培养48小时后收集用胰蛋白酶消化细胞,离心收集细胞去除上清后加入TRIzol RNA 提取试剂盒提取RNA,Thermo 逆转录试剂盒反转得到cDNA,使用TakaraSYBRGreen试剂盒实时定量PCR检测,实验重复三次。引物信息mouse Glut1 forward:CAGTTCGGCTATAACACTGGTG;Mouse Glut1 reverse:GCCCCCGACAGAGAAGATG;mouse Glut2 forward:TCAGAAGACAAGATCACCGGA;Mouse Glut2 reverse:GCTGGTGTGACTGTAAGTGGG;Mouse Glut3 forward:TGGTAGCTCAGATCTTTGGTTTGG;Mouse Glut3 reverse:GATCTCTGTAGCTTGGTCTTCCTC
1.6 裸鼠成瘤实验
为了测试维生素C的效果,将200万个p53和TSC2敲除细胞皮下注射到6至8周龄雌性裸鼠腋下皮肤。7-10天后,将肿瘤体积为40-60mm3的小鼠随机分为两组。一组接受新鲜制备的维生素C(400微升PBS中的抗坏血酸钠,每千克体重4克)腹腔注射,每天1次。对照组小鼠用PBS代替维生素C,剂量表相同。用电子卡尺每4天测量肿瘤大小,并以非盲方式使用公式计算体积:(L×W2)×0.5,其中L为长度,W为宽度。连续注射16天后麻醉小鼠,取出皮下肿瘤组织。实验重复了两次。所有小鼠实验均通过三峡大学医学院伦理委员会审批并按照相关规定执行。
1.7 统计方法
应用SPSS 18.0统计软件(SPSS Inc.,Chicago,IL,USA)分析。计量资料采用平均数±标准差(±s)表示。多因素比较采用单因素方差分析,两组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 维生素C选择性杀伤TSC2基因缺失细胞抑制其增殖
为研究维生素C对TSC基因敲除细胞是否具有选择性抑制作用,我们使用C57小鼠获得成纤维细胞(MEFs细胞),通过基因敲除方法获得P53基因敲除细胞(p53-/-)使之能够无限增殖,实验组则分别敲除p53基因和TSC2基因(p53-/-,TSC2-/-)。两组细胞分别用不同浓度梯度维生素 C处理不同时间,通过MTT方法检测细胞存活率,结果发现600uM和800uM浓度维生素 C在12-36小时均可显著抑制p53-/-,TSC2-/-MEFs细胞的增殖,且呈时间依赖性,而上述浓度对p53-/-基因缺失MEF细胞无明显抑制作用(图1-A、B、C)。同时我们在另外一组TSC2基因缺失细胞及TSC2基因敲入细胞系(323T2及323V)中获得相同实验结果,323T2为对照组细胞,323V细胞为TSC2基因缺失细胞(见图1-D)。以上结果说明维生素 C能够选择性抑制TSC2基因缺失细胞的增殖。

图1 维生素 C选择性抑制TSC2基因敲除细胞增殖
2.2 mTOR信号通路抑制剂雷帕霉素能够挽救维生素C选择性抑制细胞增殖作用
生理状态下TSC1和TSC2作为蛋白质复合体,负性调节雷帕霉素靶蛋白(mTOR)的功能。mTOR作为一个细胞内承上启下的丝氨酸/苏氨酸蛋白激酶枢纽,主要通过整合生长因子和营养信号来调控细胞生长、增殖、分化和代谢等多种重要生物学过程,然而TSC1和TSC2的突变导致mTOR通路的过度活化,引起细胞的异常增殖,引发TSC病变,现有研究已证实mTOR特异性抑制剂雷帕霉素(rapamycin)及其衍生物可拮抗过度活化的mTOR,现已在临床及基础实验中广泛被运用。为进一步研究维生素C选择性抑制TSC2-/-基因敲除细胞是否通过调控mTOR信号通路来实现,我们进行了挽救实验。首先我们在p53-/-及p53-/-,TSC2-/-细胞中用雷帕霉素(终浓度为10nmM)处理24小时后于两组细胞中分别加入不同浓度维生素C(终浓度为200uM-1mM)处理24小时,而后通过MTT检测细胞增殖情况,结果发现10nM雷帕霉素对无维生素C处理两组细胞增殖无明显作用,而对600uM、800uM及1mM作用TSC2敲除细胞有挽救作用(图2),因此说明维生素C的选择性抑制细胞增殖作用依赖于mTOR信号通路。

图2 mTOR信号通路抑制剂雷帕霉素能够挽救维生素C选择性抑制细胞增殖作用
2.3 维生素C选择性增加TSC2敲除细胞内活性氧(ROS)
最新研究发现维生素 C可选择性抑制KRAS和BRAF突变的结直肠癌细胞,其主要机制是因KRAS和BRAF突变能够显著增加结直肠癌细胞表面的葡萄糖转运蛋白(GLUTs),使进入细胞中DHA增多,增多的DHA在细胞内还原为维生素 C的过程中产生大量活性氧(ROS),从而导致细胞死亡,为进一步研究维生素 C选择性抑制TSC2-/-细胞增殖机制,我们首先检测了对照组细胞和TSC2-/-细胞中GLUTs的表达水平,结果发现细胞中TSC2基因缺失细胞中GLUT1转录水平明显升高,而GLUT3转录水平无明显区别。为进一步证实GLUT1转录水平升高是TSC2基因缺失导致mTOR细胞通路激活所致,我们使用雷帕霉素处理细胞后再次检测GLUT1转录水平,发现雷帕霉素可抑制TSC2基因缺失所致GLUT1转录水平升高(图3-A)。以上结果说明TSC2基因缺失导致mTOR通路激活可导致Glut1表达水平增高。已有研究表明Glut1水平增高,可导致维生素处理细胞内活性氧增加而导致细胞死亡,因此我们进一步通过DCFH-DA染色、流式细胞仪检测方法测定维生素C处理细胞内ROS水平,结果发现维生素 C可显著增加TSC2缺失细胞中ROS水平,而对无TSC2基因缺失细胞无明显作用(图3-B),以上结果说明TSC2基因缺失导致mTOR信号通路激活,使得Glut1表达水平增加,进一步导致维生素处理后细胞内ROS增加而杀伤细胞。
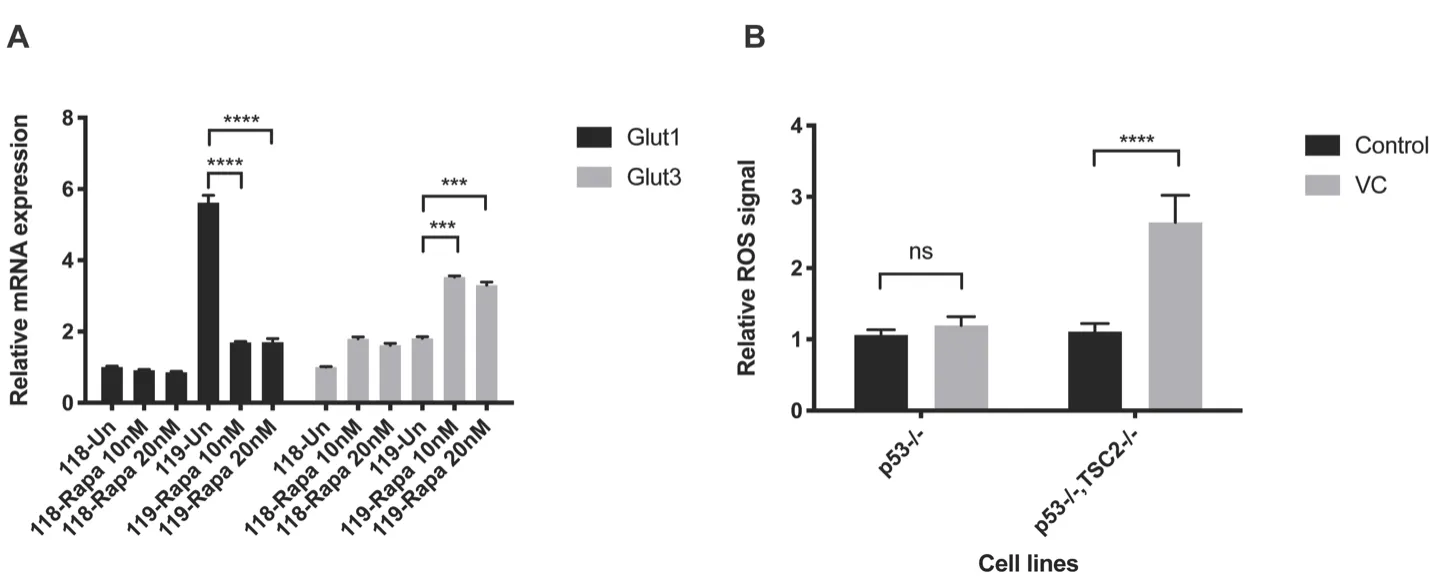
图3 维生素C选择性增加TSC2敲除细胞内活性氧(ROS)
2.4 维生素 C无法抑制TSC2基因缺失细胞在体内的生长
为进一步在体外水平研究维生素 C对肿瘤生长的影响,我们将TSC2基因敲除细胞种植于裸鼠皮下,待肿瘤形成后测量肿瘤体积,随机分为实验组和对照组,实验组腹腔注射大剂量维生素C(4g/kg/day),对照组注射等量生理盐水,每天测量肿瘤体积并记录(图4-A),连续注射16天后处死小鼠,获得肿瘤标本称重比较(图4-B、C),结果发现大剂量维生素C未能抑制肿瘤生长,肿瘤体积及重量与对照组细胞相比差异无统计学意义。
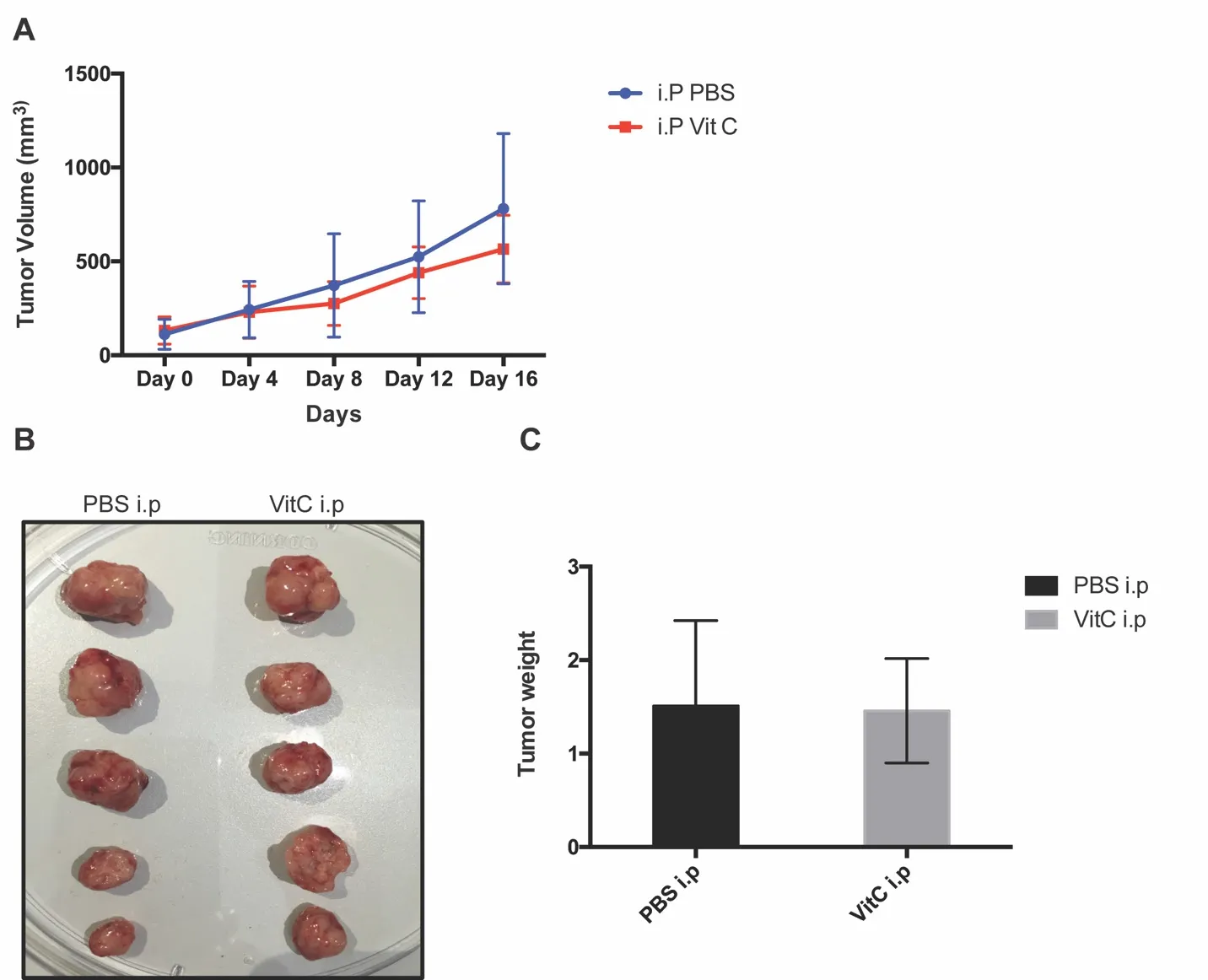
图4 维生素 C无法抑制TSC2基因缺失细胞在体内的生长
3 讨论
结节性硬化症是一种TSC基因突变导致、多系统累积的临床综合症,目前主要治疗方法为使用mTOR通路抑制剂及对症支持治疗,但mTOR通路抑制剂价格昂贵、需要终身治疗,因其仅能抑制细胞增殖而不能杀伤细胞,因此一旦停药相关因细胞增殖引起的临床综合症会复发,且存在免疫抑制相关副作用[3],我们的体外研究发现维生素C能够选择性杀伤TSC2基因缺失细胞,抑制其增殖,更重要的是维生素C获取途径简单、价格低廉,这一发现有望为结节性硬化的治疗提供新的思路。
2015年Yun J 等人研究发现大剂量维生素C能够选择性抑制KRAS和BRAF突变的结直肠癌细胞,其主要机制是因KRAS和BRAF突变能够显著增加结直肠癌细胞表面的葡萄糖转运蛋白(GLUTs),使进入细胞中DHA增多,增多的DHA在细胞内还原为维生素 C的过程中产生大量活性氧(ROS),从而导致细胞死亡[20]。同时有研究表明,TSC2基因缺失导致的mTOR通路激活可促进Gluts的表达[21],因此在上述研究基础上,我们进一步通过细胞实验验证了mTOR通路激活可导致Glut1转路增加,且使用mTOR通路抑制剂Rapamycin可抑制TSC2缺失导致的Glut1表达增加,这一结果说明Glut1激活表达依赖于mTOR通路的激活,有研究表明mTOR通路激活可通过IKK/NFκB信号通路激活Gluts的表达[21],因多种肿瘤中均可见mTOR通路的异常激活,因此这一现象已在乳腺癌、膀胱癌等多种肿瘤中被证实[22,23]。为进一步证明维生素C是通过激活的mTOR信号通路而发挥选择性杀伤作用,我们使用mTOR通路抑制剂Rapamycine预先处理TSC2缺失细胞24小时,而后再次给予不同浓度维生素C发现,维生素C选择性杀伤作用消失,这更进一步说明维生素C的选择性杀伤作用依赖于mTOR通路的激活,同时这也提示使用mTOR抑制剂联合维生素C治疗可能不是一个合理的选择。为进一步探讨其选择性杀伤TSC基因缺失细胞机制,我们结合Yun J等人的研究,运用荧光标记及流式细胞检测方法测定了实验组细胞与对照组维生素C处理细胞中活性氧,发现维生素C处理TSC2基因缺失细胞中ROS增加,而对照组细胞中无明显改变,这一结果与Yun J研究结果一致[20],因此我们推测维生素C也可能通过高表达的葡萄糖转运蛋白进入细胞而杀伤TSC突变细胞,其具体调控机制有待进一步研究。为研究其在体治疗作用,我们通过裸鼠成瘤实验发现大剂量维生素C连续皮下注射2周与对照组细胞相比,TSC2基因缺失细胞肿瘤生长有抑制作用,但统计学无差异。分析可能存在以下原因,一是使用样本量较小,虽然有抑制趋势,但较难获得统计学差异;二是维生素C使用剂量不足,维生素C半衰期为2小时[16,17],我们采用每日1次腹腔注射方法可能无法达到抑制肿瘤生长效果。后期可增加样本量,测定小鼠维生素C代谢时间重新确定注射剂量。如有条件可使用TSC2缺失转基因小鼠进一步验证上述结果。
3 结论
大剂量维生素C可选择性杀伤TSC2基因突变细胞、抑制其增殖,其可能通过TSC2突变细胞高表达的Gluts进入细胞而导致ROS增多而杀伤细胞,这一发现有可能为结节性硬化症及mTOR通路激活肿瘤的治疗提供新的思路及方法。
