S100A1在子宫内膜癌中的表达及其对子宫内膜癌细胞增殖的影响*
2022-07-27宋秀红王灵芝刘翔宇崔竹梅
田 甜,宋秀红,孔 琰,王灵芝,刘翔宇,杨 晶,崔竹梅
(青岛大学附属医院妇科,青岛 266061)
子宫内膜癌是妇科常见恶性肿瘤。多种因素可导致子宫内膜癌的发生发展,但是具体机制尚不明确。S100蛋白作为EF手相钙结合蛋白家族中的最大成员,具有调控细胞增殖、迁移、转录因子等多种生物学功能[1],与肿瘤关系密切[2]。S100A1与多种恶性肿瘤的发生发展有关,但是其在子宫内膜癌组织中的表达和作用尚不明确。本研究通过免疫组化法检测子宫内膜癌组织中S100A1表达水平,通过慢病毒载体转染构建过表达S100A1的子宫内膜癌细胞系,通过细胞外功能实验明确S100A1对子宫内膜癌细胞增殖、细胞周期调控、迁移和侵袭的影响,探讨S100A1在子宫内膜癌发生发展中的作用。
1 材料与方法
1.1 资料来源
1.1.1 组织标本 收集2003年1月至2005年12月在青岛大学附属医院接受手术治疗的74例子宫内膜癌、14例子宫内膜不典型增生和26例良性子宫内膜增生患者的临床资料和石蜡标本。子宫内膜癌患者的年龄为(53.48±9.14)岁;临床分期:Ⅰ期59例,Ⅱ~Ⅳ期15例;病理分化程度:高分化者24例,中分化者33例,低分化者10例,7例非子宫内膜样腺癌被排除。子宫内膜癌患者术前均未接受放化疗。子宫内膜良性增生包括单纯性增生和复杂性增生。手术分期依据2009年FIGO分期标准。本研究经医院伦理委员会的讨论并获得同意。
1.1.2 细胞与试剂 人肾上皮细胞系293细胞、子宫内膜癌细胞系HEC-1A和HEC-1B细胞均源自美国典型培养物保藏中心(ATCC),由课题组实验室保存。PV-9000免疫组化试剂盒购自北京中杉金桥。慢病毒质粒pLVX-IRES-Neo和慢病毒包装质粒pCMVΔ8.9、VSVG和PLP2为课题实验组保存。转染试剂Lipofectamine 2000购自美国Invitrogen公司。DMEM培养基和胎牛血清购自美国GIBCO公司;逆转录检测试剂盒购自美国ABI公司;实时定量PCR试剂盒购自日本Takara公司;蛋白印迹(Western blot)法检测试剂购自美国Pierce公司;活细胞计数(CCK-8)法检测试剂盒购自日本同仁化学研究所。单克隆鼠抗S100A1、β-actin抗体购自Santa Cruz公司。
1.2 方法
1.2.1 免疫组化方法 组织切片脱蜡,用磷酸盐缓冲液(PBS)清洗。3%过氧化氢室温孵育,柠檬酸盐缓冲液的修复盒中进行高压抗原修复。冷却,血清封闭。一抗过夜孵育,辣根过氧化物酶(HRP)标记的二抗工作液室温孵育30min。二氨基联苯胺(DAB)显色和苏木素复染,脱水并封片。阴性对照用PBS缓冲液替换一抗。数字图像扫描仪Scanscope XT获取图像,使用Aperio Image Scope软件(美国Aperio公司)进行染色定量评分。软件自动计数每个视野中弱阳性细胞数(Nwp)、阳性细胞数(Np)、强阳性细胞数(Nsp)及总细胞数(Ntotal)。每份标本采用半定量方法,按不同染色强度细胞所占百分比分别赋值之和进行计算,计算公式为(Nwp/Ntotal)×(100)+(Np/Ntotal)×(200)+(Nsp/Ntotal)×(300)[3]。
1.2.2 过表达S100A1子宫内膜癌细胞的构建及鉴定 (1)细胞系构建和筛选:将扩增的S100A1 cDNA克隆到pLVX-IRES-Neo的XhoI/BamHI酶切位点,构建慢病毒载体。按Lipofectamine 2000说明书步骤进行转染。5μg pLVX-IRES-Neo-S100A1或pLVX-IRES-Neo、1.25μg VSVG、3.75μg pCMVΔ8.91和1.25μg PLP2转染293T细胞。收集病毒上清,-80℃保存。病毒感染子宫内膜癌细胞HEC-1A和HEC-1B。400μg/mL G418进行稳定细胞的筛选。(2)鉴定:①Western blot法检测HEC-1A和HEC-1B细胞中S100A1表达:裂解细胞,BCA法测定蛋白浓度。取定量蛋白进行SDS聚丙烯酰胺凝胶电泳、PVDF转膜、一抗4℃孵育过夜、二抗孵育1h,增强化学发光(ECL)液显色,凝胶成像仪采集成像。应用Image J软件进行分析。②荧光实时定量PCR(qRT-PCR)检测S100A1 mRNA表达:TRIzol试剂(Invitrogen)提取RNA,逆转录反应合成cDNA。采用SYBR Green PCR Master Mix (Applied Biosystems)和StepOne Plus实时荧光定量PCR仪进行检测。PCR反应体系20μL,反应条件:95℃预变性30s;90℃ 5s,55℃ 35s,共40个循环。按公式2-△△Ct分析S100A1 mRNA表达水平。S100A1基因引物序列,上游:5'-CCGCTCGAGAGCAGCCACATTTGCAACCT-3',下游:5'-CGCGGATCCGCTGGTGAGAGAGAAGCCTTTA-3'。
1.2.3 CCK-8法检测子宫内膜癌细胞的增殖能力 将子宫内膜癌细胞按3×103细胞/孔接种于96孔板,每组设置3个复孔。于24、48、72h去除培养液,加稀释的CCK-8 10μL,37℃温箱作用1h,酶标仪检测450nm吸光度(A)值。根据A值绘制细胞增殖曲线。
1.2.4 流式细胞仪检测子宫内膜癌细胞周期比例 0.25%胰蛋白酶收集细胞,制成单细胞悬液。PBS洗涤,冰冷70%乙醇4℃固定过夜。PBS洗涤细胞2次,500μL碘化丙啶(PI)染色液37℃避光放置30min。使用FACSCalibur流式细胞仪检测染色细胞。实验重复3次。
1.2.5 Transwell小室和划痕实验检测细胞迁移和侵袭能力 Transwell小室实验:提前制备平铺matrigel的小室。无血清培养基制备单细胞悬液,200μL细胞悬液加入平铺和未平铺matrigel的Transwell上室,600μL含10%胎牛血清细胞液加入下室,温箱培养24h。去除上室表面细胞,4%多聚甲醛固定,0.3%结晶紫染色。显微镜拍照,统计穿膜细胞数。实验重复3次。划痕实验:将相同数量的子宫内膜癌细胞接种于6孔板,用相同型号的移液管刮取细胞层。PBS清洗去除细胞碎片,于0h和24~48h拍摄图像,测量划痕距离。

2 结 果
2.1 子宫内膜癌组织中S100A1蛋白表达水平比较 免疫组化结果表明,S100A1主要表达于细胞浆和细胞核(图1)。子宫内膜癌组织、子宫内膜不典型增生组织中S100A1蛋白表达水平显著高于良性增生子宫内膜组织(Z=-3.53,P=0.000;Z=-3.001,P=0.003);子宫内膜癌和子宫内膜不典型增生组织之间无明显差异(Z=-0.201,P=0.84)(图2)。子宫内膜癌组织中S100A1表达水平与年龄有相关性(Z=-3.822,P=0.000),与肌层浸润、宫颈受累、组织学类型、FIGO分期、肿瘤分化、肿瘤大小、淋巴结转移无相关性(P均>0.05)。见表1。

图1 免疫组化法检测S100A1蛋白在子宫内膜组织中的表达(SP法×400)

图2 免疫组化分值
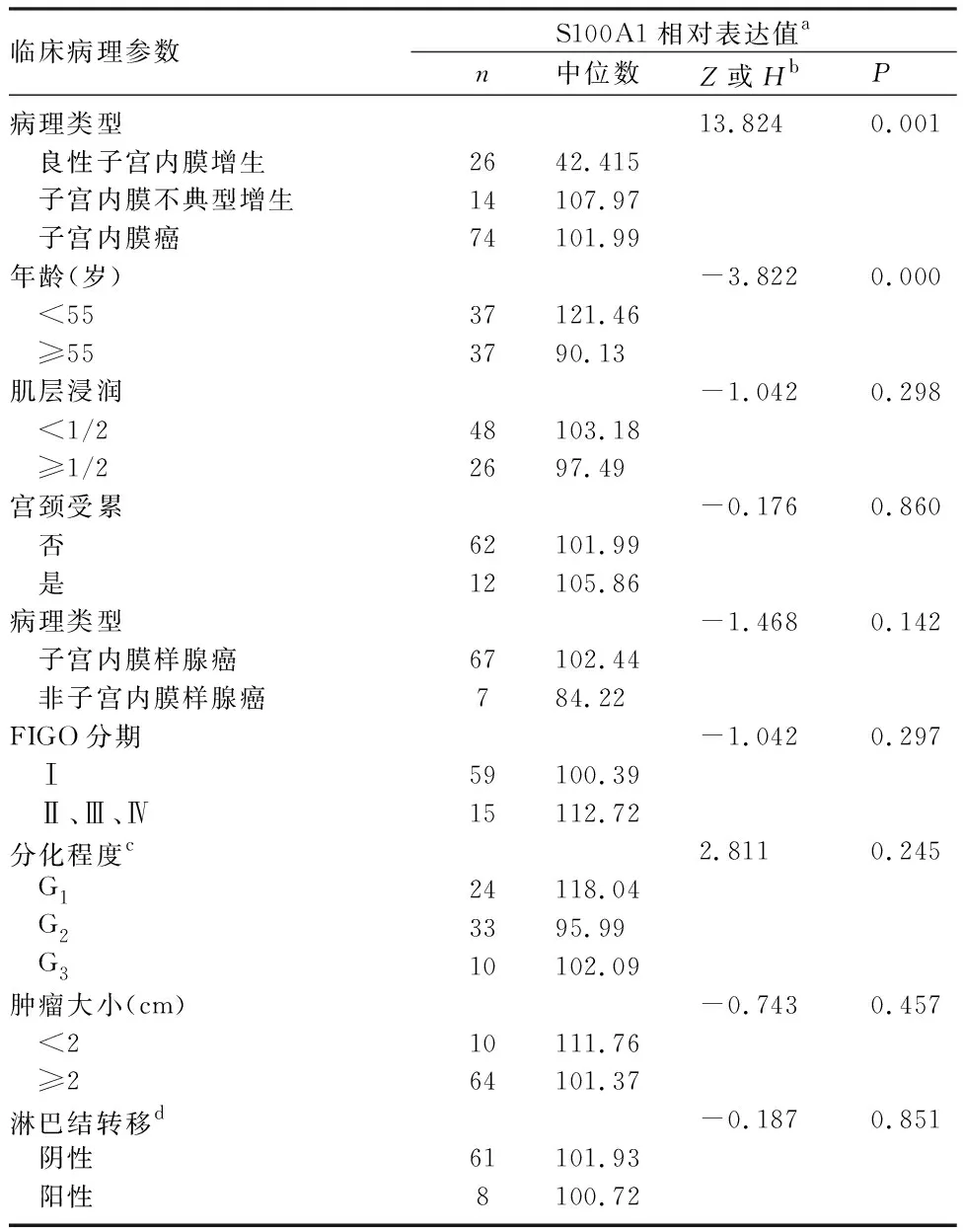
表1 S100A1在子宫内膜癌中的表达和临床病理参数分析
2.2 稳定表达S100A1基因的HEC-1A和HEC-1B细胞系的建立及鉴定 本研究成功构建转染S100A1基因的子宫内膜癌细胞系。Western blot法检测显示,转染组HEC-1A和HEC-1B细胞中S100A1蛋白表达强度均明显高于各自对照组。qRT-PCR结果显示,转染组HEC-1A细胞、HEC-1B细胞的S100A1 mRNA表达水平分别为(831.67±47.56)和(390.50±47.56),均明显高于对照组细胞(t=17.47,P=0.0001;t=8.19,P=0.001)(图3)。

图3 转染组和对照组子宫内膜癌细胞中S100A1蛋白表达
2.3 转染组和对照组子宫内膜癌细胞增殖能力的比较 CCK-8法检测显示,转染组HEC-1A细胞培养48h的A值(0.69±0.02)明显高于对照组(0.62±0.02,t=4.778,P=0.008),培养72h的A值(1.09±0.05)明显高于对照组(0.90±0.09,t=3.327,P=0.029);转染组HEC-1B细胞培养48h的A值(1.08±0.04)明显高于对照组(0.87±0.03,t=7.166,P=0.002),培养72h的A值(2.29±0.05)明显高于对照组(1.98±0.10,t=4.925,P=0.0079)。见图4。
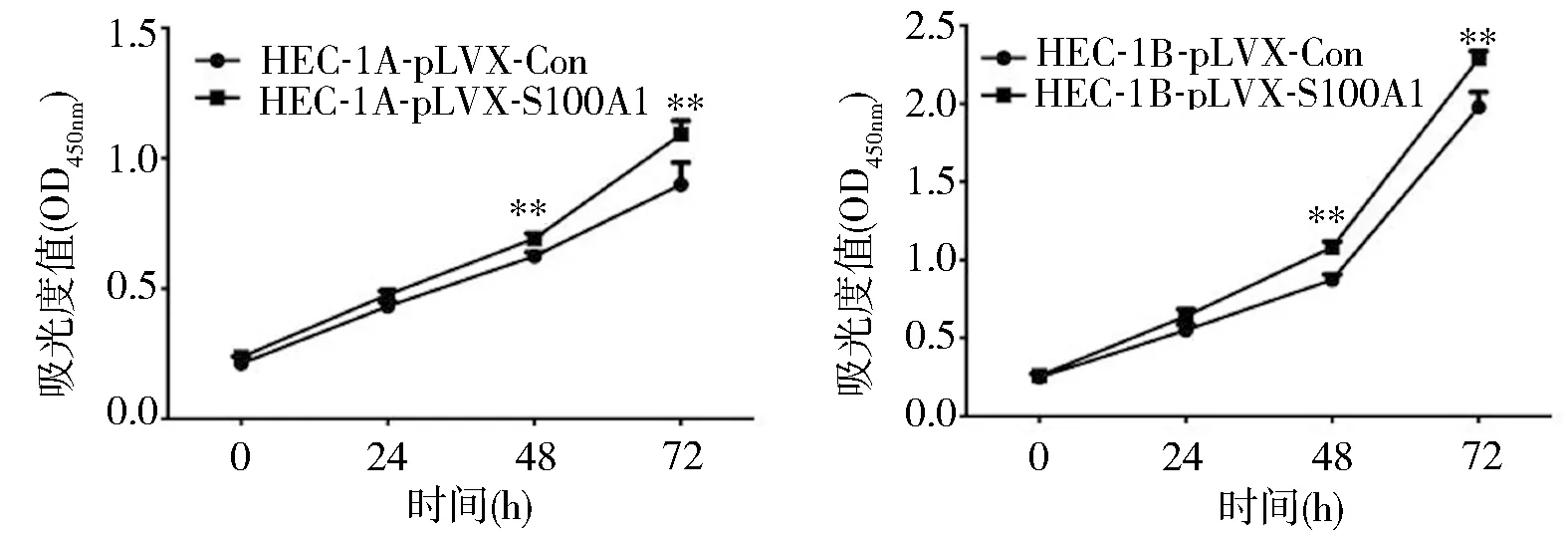
图4 CCK-8检测子宫内膜癌细胞增殖能力的变化
2.4 转染组和对照组子宫内膜癌细胞的细胞周期比较 转染组HEC-1A和HEC-1B细胞的G2/M期细胞比例分别为(13.19±0.02)%和(19.94±0.36)%,明显高于对照组[(11.68±0.47)%和(16.66±0.85)%],差异均有统计学意义(P均<0.05)。HEC-1A细胞转染组与对照组相比,G1期细胞比例显著下降[(64.60±0.16)% vs(67.90±0.28)%,P<0.05],S期细胞比例无明显变化[(22.27±0.06)% vs(20.45±0.76)%,P<0.05]。HEC-1B细胞转染组与对照组相比,G1期细胞比例显著增高[(45.41±0.35)vs(42.35±0.65)%,P<0.05],S期细胞比例显著下降[(34.66±0.01)%与(40.99±0.20)%,P<0.05]。见图5。

图5 流式细胞仪检测子宫内膜癌细胞周期比例的变化
2.5 转染组和对照组子宫内膜癌细胞迁移和侵袭能力的比较 Transwell体外迁移实验显示,转染组HEC-1A和HEC-1B细胞的穿膜细胞数分别为(106±15)和(38±12)个,对照组的穿膜细胞数分别为(120±9)和(41±3)个,差异均无统计学意义(P>0.05)。Transwell体外侵袭实验显示,转染组HEC-1A和HEC-1B细胞的穿膜细胞数分别为(120±15)和(96±12)个,对照组的穿膜细胞数分别为(109±4)和(108±21)个,差异均无统计学意义(P>0.05)。划痕实验结果显示,两组子宫内膜癌细胞的迁移能力无明显变化。
3 讨 论
S100蛋白属于EF手相钙结合蛋白家族成员,在体内发挥广泛的生物学作用,如钙离子稳态、细胞骨架构成、转录因子调节、细胞增殖分化、细胞周期、细胞运动、炎性反应等[4]。多种S100蛋白如S100P、S100A4、S100A7、S100A8/A9、S100A14参与肿瘤的发生发展[5-9]。S100A1主要在心肌中表达,调节心肌内Ca2+环境、细胞收缩和能量代谢[10]。S100A1在病理条件下表达异常,与肿瘤发生发展有关[11]。研究发现,S100A1在黑色素瘤、肾细胞癌、乳腺癌、卵巢癌和甲状腺癌的发生进展过程中发挥重要作用[12-16]。然而,S100A1在子宫内膜癌中的表达和作用尚不清楚。本研究通过免疫组化法检测S100A1在子宫内膜组织中的表达,结果显示其在子宫内膜癌和子宫内膜不典型增生组织中的表达均高于良性子宫内膜组织,表明S100A1在子宫内膜癌和癌前病变组织中表达异常,可能在良性子宫内膜向恶性肿瘤发生癌变的病理过程中发挥一定的促进作用。本研究结果显示,子宫内膜癌组织中S100A1表达水平与年龄相关,与肌层浸润、宫颈受累、组织学类型、FIGO分期、肿瘤分级、肿瘤大小和淋巴结转移等临床病理特征无明显相关性;良性子宫内膜及不典型增生子宫内膜的S100A1蛋白表达与年龄无相关性。DeRycke等[17]报道,在子宫内膜样子宫内膜癌中,S100A1表达量与肿瘤分化和临床分期无相关性,这与本研究结果一致。本研究未行生存预后分析。研究发现,子宫内膜样子宫内膜癌中S100A1高表达与患者无复发生存率下降有关,认为S100A1可作为子宫内膜样恶性肿瘤预后不良的标志[17]。
本研究结果表明,S100A1增强子宫内膜癌细胞的增殖能力,但不影响细胞迁移和侵袭能力。有研究发现,S100A1在神经细胞中调节细胞增殖[18-19],参与肿瘤细胞增殖的异常调节[1]。细胞周期改变引起的细胞增殖失调是肿瘤发生的重要环节,S100A1蛋白参与肿瘤细胞周期的调控[13]。本研究结果显示,S100A1过表达的子宫内膜癌细胞G2/M期细胞比例显著增加。S100A1促进肿瘤细胞增殖可能与调节细胞周期有关,但是具体作用机制尚不明确。多数S100蛋白家族通过与RAGE相互作用并激活细胞信号通路发挥作用,该信号通路涉及MAP激酶、NF-κB和磷脂酰肌醇3-激酶(PI3K)/Akt信号通路[1]。子宫内膜癌中S100A1蛋白调控细胞周期的分子机制需进一步深入研究。
综上所述,S100A1在子宫内膜癌中表达异常,促进子宫内膜癌细胞的增殖,影响细胞周期调控。因此,S100A1在子宫内膜癌的发生发展中发挥重要作用,为子宫内膜癌的治疗提供新的分子靶点。
