激活素A对胃癌细胞迁移和有氧糖酵解的影响
2022-07-27赵丽琴郭伟剑余诺亚吴珺玮
赵丽琴, 郭伟剑, 余诺亚, 吴珺玮, 张 俊
(1.上海交通大学医学院附属瑞金医院肿瘤科,上海 200025;2.复旦大学附属肿瘤医院肿瘤内科,上海 200032)
胃癌是常见的消化系统恶性肿瘤之一,在全世界范围内发病率居第5位,死亡率居第4位[1]。而在我国,胃癌发病率显著高于世界平均水平,发病率和死亡率均居第3位[2]。晚期胃癌患者极易出现恶病质,是导致肿瘤患者死亡的主要原因之一。恶病质本质上是肿瘤或肿瘤治疗导致的代谢紊乱综合征,目前尚无行之有效的治疗方法[3]。
激活素A(activin A)是转化生长因子-β(transforming growth factor-β,TGF-β)超家族中的一种分泌型细胞因子,其下游信号通路与TGF-β信号通路有相似之处。既往研究表明激活素A在胚胎发育、干细胞维持和分化、造血、肿瘤侵袭转移、抗肿瘤免疫等多种病理生理过程中发挥重要作用[4-5],也有研究发现激活素A促进小鼠骨骼肌萎缩和体重下降,促进肿瘤恶病质的发展[6],通过靶向激活素A,可明显抑制在太空微重力环境下小鼠骨骼肌萎缩和骨质丢失[7],在结直肠癌等恶性肿瘤患者中也观察到激活素A水平与肿瘤恶病质显著相关[5]。
激活素A促进恶病质发展的机制目前尚不完全清楚。通常认为某些肿瘤可分泌大量激活素A,干扰正常组织代谢,导致恶病质发生、发展[3]。Ghosh等[8]发现,果蝇中激活素A通过调节线粒体相关酶和三羧酸循环关键酶的表达,影响胰岛素释放,在糖代谢和维持酸碱稳态过程中发挥关键作用。
本课题组前期研究发现激活素A的重要受体2A(activin A receptor type 2A,ACVR2A)在胃癌转移中发挥重要作用[9]。有报道称激活素A可抑制某些胃癌细胞系增殖,但其在胃癌转移、糖酵解中的作用鲜见报道[10-11]。本研究旨在探索激活素A在胃癌细胞迁移和有氧糖酵解中的功能和可能的作用机制,以及激活素A编码基因抑制素βA亚基(inhibinβA,INHBA)表达与胃癌患者预后的相关性。
材料与方法
一、材料与试剂
MGC803胃癌细胞系为本课题组实验室保存,购自中国科学院上海生命科学研究院细胞资源中心,该细胞系经短串联重复序列(short tandem repeat,STR)基因型鉴定,确定为MGC803胃癌细胞。激活素A购自美国R&D Systems公司(货号:338-AC),根据试剂说明书采用4 mmol/L HCL溶解激活素A至浓度为10 ng/μL。Transwell小室为日本康宁(Corning)公司产品,乳酸检测试剂盒(货号:K627-100)和葡萄糖摄取检测试剂盒(货号:K676-100)购自美国BioVision公司。磷酸化Smad2/3(phosphorylated Smad2/3,pSmad2/3)、snail、slug、波形 蛋 白 (vimentin,VIM)、N-钙 黏 着 蛋 白(N-cadherin)、基质金属蛋白酶(matrix metalloproteinase,MMP)2、MMP9一抗购自美国Cell Signaling Technology公司,缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIFIA)一抗购自美国Novus Biologicals公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、乳酸脱氢酶(lactate dehydrogenase,LDH)A、LDHB、己糖激酶2(hexokinase 2,HK2)、果糖二磷酸醛缩酶A(aldolase A,ALDOA)、葡萄糖转运体(glucose transporter,Glut)1、Glut3、Glut4一抗均购自中国武汉Proteintech公司。辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠抗体和HRP标记的山羊抗兔抗体均购自Cell Signaling Technology公司。
二、方法
1.激活素A作用浓度筛选:经典激活素信号通路中,pSmad2/3是其下游信号通路被激活的标志,pSmad2/3水平可反映经典激活素信号通路激活情况。既往文献中大多采用5~30 ng/mL的激活素A处理细胞,并研究激活素A的生物学功能[10,12-13];本研究分别采用0、5、10、20、40、80 ng/mL等不同浓度的激活素A,处理MGC803细胞24 h后,提取细胞总蛋白,BCA(bicinchoninic acid)法测定蛋白浓度,蛋白质印迹法(Western blotting,Wb)检测激活素A下游靶基因Smad2/3磷酸化情况,即pSmad2/3水平,若pSmad2/3明显升高,则表明激活素A下游信号通路被激活,选取该作用浓度,开展后续的功能实验。
2.细胞迁移能力检测:包括Transwell小室法和划痕实验。①Transwell小室法:取对数生长期的MGC803细胞,分为对照组和激活素A处理组,分别用相同体积的4 mmol/L HCL和20 ng/mL的激活素A处理48 h。将2组细胞消化吹打成单细胞悬液,离心后弃上清,再用不含血清的DMEM培养基重悬细胞,计数细胞密度。利用康宁8μm孔径的小室和配套的24孔板进行细胞迁移实验,下室内加入含20%胎牛血清的DMEM培养基,上室中加入用不含血清的DMEM培养基重悬的MGC803细胞。2组均设置3复孔,每孔加入4万个细胞,36 h后终止培养,4%多聚甲醛固定,结晶紫染色,显微镜下拍照,观察2组迁移过去的细胞数目的差别。②划痕实验:取对照组和激活素A处理组细胞,将细胞接种到6孔板中,接种密度为过夜后融合率能达到100%。第2天用同一只无菌吸头在2组细胞上进行划痕,划痕完成后,用无菌磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗细胞3次,然后更换新鲜的无血清培养基培养,2组中继续加4 mmol/L HCL和终浓度为20 ng/mL的激活素A处理,将细胞放入培养箱中培养,0 h、48 h后取出细胞,在显微镜下观察拍照,测量划痕的宽度,比较2组细胞划痕愈合的速度。
3.细胞有氧糖酵解水平检测:测定乳酸产生量和葡萄糖摄取量可反映细胞糖酵解水平,在有氧培养条件下,测定乳酸产生和葡萄糖摄取情况来检测激活素A对胃癌细胞有氧糖酵解的影响。包括乳酸生成检测和葡萄糖摄取检测。①乳酸生成检测:取对照组和激活素A处理组细胞,2组细胞用胰酶消化后在细胞自动计数仪上进行计数,12孔板中每孔接种8万个细胞,每组细胞设3复孔,约6~8 h后细胞贴壁,弃去原培养基,每孔中换无血清培养基500μL,放回培养箱中培养1 h,从每孔中吸出培养基上清100μL,放入-80℃冰箱中冻融1次。采用BioVision公司的乳酸检测试剂盒,按照试剂盒说明书操作步骤检测培养基上清中的乳酸浓度。②葡萄糖摄取检测:取对照组和激活素A处理组细胞,2组细胞用胰酶消化后在细胞自动计数仪上进行计数,将细胞接种到96孔板中,每孔接种1万个细胞,待细胞贴壁后(约6~8 h),采用BioVision公司的葡萄糖摄取检测试剂盒检测2组细胞摄取葡萄糖能力的差别。
4.Wb检测蛋白表达:采用放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液提取细胞总蛋白,将细胞置于冰上,用预冷的PBS洗细胞2次,加入适量已添加蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液裂解细胞,用细胞刮将细胞和裂解液一起刮下,转移至1.5 mL EP管,置于冰上继续裂解约30 min。采用BCA法对蛋白浓度进行测定,根据试剂盒说明书步骤操作,最后用已添加蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液将蛋白调整至相同浓度。Wb检测:制备10%的聚丙烯酰胺凝胶,将凝胶夹好后放入电泳槽内,加入电泳液,向凝胶的每个孔内加入30μg蛋白样品,并在合适位置加入蛋白预染标志物指示分子量,电泳、转膜、封闭、一抗4℃孵育过夜,再用TBST溶液洗膜3次,每次10 min,加入相应的二抗室温孵育1 h,TBST溶液洗膜3次后,曝光显影。
5.激活素A编码基因INHBA在胃癌中的表达及对预后影响的分析:在基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)在线平台 (http://gepia.cancer-pku.cn/index.html)中分析INHBA与上皮间质转化(epithelial mesenchymal transformation,EMT)、糖酵解相关基因表达的相关性,了解INHBA在胃癌组织和癌旁正常组织中表达的差异,该在线平台的基因表达数据来源于癌症基因组图谱(the cancer Genome Atlas,TCGA)数据库和GTEx数据库。利用Kaplan-meier Plotter数据库(https://kmplot.com)分析来源于基因表达综合数据库(Gene Expression Omnibus,GEO)数据库 (GSE14210、GSE15459、GSE22377、GSE29272、GSE51105)的593例胃癌患者和来源于TCGA数据库的375例胃癌患者肿瘤组织中INHBA表达水平与胃癌患者生存的相关性。
三、统计学分析
采用R语言(Version 3.5.1)进行统计学分析,图形绘制采用Graphpad Prism 5.0软件。实验均重复3次或3次以上,结果以±s表示。若无特殊说明,2组间差异的比较应用双侧t检验。P<0.05认为差异具有统计学意义。
结 果
一、合适的激活素A作用浓度
激活素A 0、5、10、20、40、80 ng/mL分别处理MGC803细胞24 h,Wb检测pSmad2的相对表达水平分别为1.000±0.027、1.802±0.130、1.761±0.072、2.819±0.110、3.062±0.158、2.767±0.138,20 ng/mL的激活素A可显著上调pSmad2/3的表达,更高浓度的激活素A并不能进一步上调pSmad2/3的表达(均P<0.01)(见图1)。因此选择20 ng/mL的浓度进行后续的功能实验。

图1 MGC803胃癌细胞中激活素A可激活激活素下游Smad信号通路
二、激活素A促进胃癌细胞的迁移和有氧糖酵解
Transwell细胞迁移实验显示,与对照组细胞比较,经激活素处理后的细胞迁移能力显著增强(每高倍镜视野迁移的细胞数为:161.333±14.572比56.000±9.849,P<0.001)(见图2A)。
划痕实验结果显示,激活素处理组较对照组划痕愈合比例明显升高(48 h后划痕愈合比例为:62.000%±5.568%比35.667%±4.041%,P<0.01)(见图2B)。
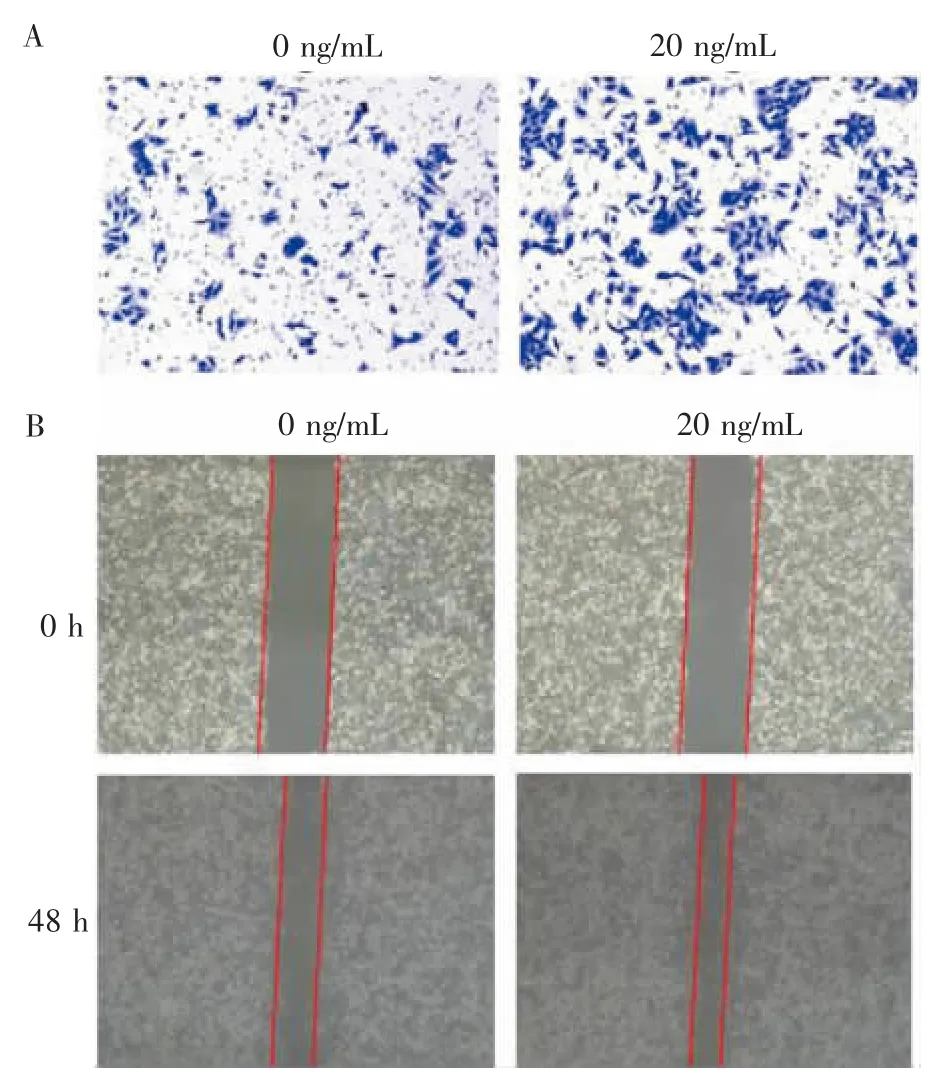
图2 激活素A可促进胃癌细胞迁移
与对照组相比,激活素A处理组细胞乳酸产生明显增加(相对乳酸产生量1.713±0.076比1.0±0.126,P<0.01),葡萄糖摄取明显增加(相对葡萄糖摄取量2.857±0.215比1.0±0.097,P<0.001)。
三、激活素A可促进EMT相关基因和GLUT3的表达
通过在线工具GEPIA分析TCGA数据库中胃癌组织测序数据,发现INHBA与SNAI1(编码Snail)(r=0.47,P=0)、SNAI2(编码slug)(r=0.51,P=0)、VIM(编码VIM)(r=0.37,P=2.1×10-14)、MMP2(r=0.64,P=0)、MMP9(r=0.27,P=2.8×10-8)等多个EMT相关基因表达呈显著正相关(见图3A~E)。
Wb检测发现,与对照组相比,20 ng/mL激活素A处理24 h后的胃癌细胞snail(187%比100%,P<0.05)、slug(191%比100%,P<0.05)、波形蛋白(156%比100%,P<0.05)、MMP2蛋白(145%比100%,P<0.05)表达升高,MMP9(89%比100%,P=0.254)、N-钙黏着蛋白(129%比100%,P=0.089)变化不明显(见图3F)。

图3 激活素A对EMT相关基因和GLUT3表达的影响
INHBA与糖酵解相关基因HIF1A(编码HIF-1α)(r=0.45,P=0)、SLC2A3(编码GLUT3)(r=0.42,P=0)表达呈显著正相关(见图4A),Wb检测发现,与对照组相比,经20 ng/mL激活素A处理24 h后的胃癌细胞,GLUT3蛋白表达明显升高(328%比100%,P<0.05),LDHA(108%比100%,P=0.875)、LDHB(92%比100%,P=0.768)、HK2(117%比100%,P=0.743)、GLUT1(86%比100%,P=0.272)、GLUT4(115%比100%,P=0.657)、ALDOA(96%比100%,P=0.833)等其他糖酵解相关基因表达无明显变化(见图4B),HIF-1α未检测到清晰条带,可能与常氧条件下HIF-1α表达量很低有关。
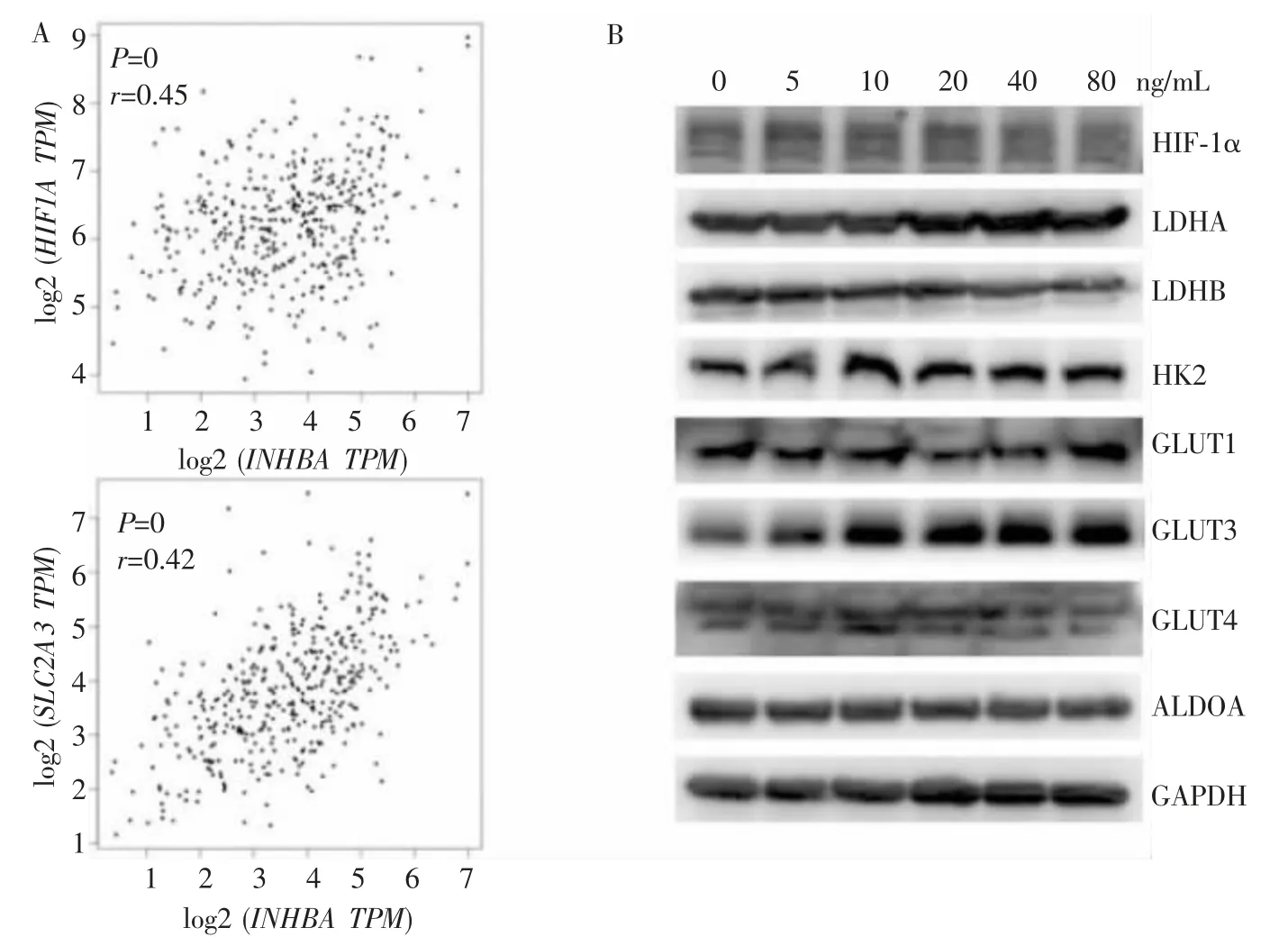
图4 激活素A对糖酵解相关基因及GLUT3蛋白表达的影响
四、INHBA在胃癌组织中的表达及对患者生存的影响
利用GEPIA在线工具分析TCGA胃癌数据发现INHBA在胃癌组织中表达水平显著高于癌旁胃黏膜组织 (P<0.05)(见图5A~B)。Kaplan-Meier plotter数据库分析发现,来源于GEO数据库的患者中,INHBA高表达组患者总生存(overall survival,OS)时间[风险比(hazard ratio,HR)=1.33,P=0.008 6]和无进展生存(progression-free survival,PFS)时间(HR=1.36,P=0.013)均较低表达组患者短(见图5C~D)。来源于TCGA数据库的患者中,INHBA高表达组患者OS时间(HR=1.62,P=0.004 4)和PFS时间(HR=3.13,P=0.007 3)也较低表达组患者短(见图5E~F)。

图5 激活素A编码基因INHBA在胃癌组织中的表达
讨 论
肿瘤转移和恶病质都是导致肿瘤患者死亡的重要原因。有氧糖酵解是肿瘤细胞代谢异常的特征之一[14],与正常细胞不同,肿瘤细胞即使在正常氧分压环境中,也主要通过糖酵解获取能量,这种现象就是“瓦尔堡效应”(Warburg effect),即有氧糖酵解[15]。有氧糖酵解虽然产能效率较低,但反应步骤少,因此单位时间内产生的ATP较多。更重要的是糖酵解过程中生成的碳中间体可以作为肿瘤细胞合成生物大分子的原料,有利于肿瘤细胞分裂增殖。此外糖酵解的终产物乳酸,可以降低肿瘤微环境pH值,过低的pH值可能减弱免疫细胞对肿瘤细胞的杀伤作用,有利于肿瘤细胞免疫逃逸[16]。有氧糖酵解对肿瘤细胞的增殖转移至关重要,糖酵解调控基因可能成为抗肿瘤治疗的新靶点[17]。
本研究发现激活素A可以调控胃癌细胞有氧糖酵解。经典激活素信号通路中,激活素A通过与细胞膜上具有丝氨酸/苏氨酸激酶活性的Ⅱ型受体结合,进而招募、磷酸化、激活Ⅰ型受体,激活的Ⅰ型受体与细胞质中的2种Smad蛋白(Smad2和Smad3)短暂相互作用,并使之磷酸化,磷酸化的Smad2和Smad3与Smad4结合,由此产生的Smad复合物进入细胞核,与多种靶基因的启动子区域结合,调控靶基因表达。经20 ng/mL激活素A处理后,胃癌细胞pSmad2/3表达水平明显上调,在随后的机制探索中观察到激活素A可上调GLUT3蛋白表达。GLUT3是糖代谢中的重要基因,肿瘤组织GLUT3的高表达有利于肿瘤细胞摄取葡萄糖,因此考虑激活素A可能通过上调GLUT3表达促进胃癌细胞有氧糖酵解。最近有研究证实Smad可与HIFIA形成复合体,通过调控c-Myc促进有氧糖酵解[18]。将在以后的实验中对激活素A调控糖酵解的分子机制进行深入研究。
本课题组既往研究发现激活素A重要受体ACVR2A在胃癌转移过程中发挥重要作用[9]。ACVR2A基因编码区存在2个微卫星位点,在高度微卫星不稳定胃癌患者中ACVR2A突变率高达70%以上,突变后ACVR2A则失去了转导激活素信号的能力。本研究也发现激活素A可促进胃癌细胞迁移,EMT是肿瘤细胞侵袭转移的重要机制,激活素A可上调EMT相关基因表达。另有研究表明,肿瘤细胞有氧糖酵解水平升高和肿瘤细胞迁移能力的增强显著相关[19]。考虑激活素A一方面可能通过激活EMT信号通路促进胃癌细胞迁移,另一方面可能通过增强胃癌细胞有氧糖酵解,促进胃癌细胞迁移。通过公共数据分析,发现激活素A编码基因INHBA在胃癌组织中表达水平显著高于癌旁胃黏膜组织,高表达INHBA的胃癌患者OS和PFS时间均显著短于低表达者。
综上,本研究结果提示,TGF-β超家族细胞因子激活素A可促进胃癌细胞迁移和有氧糖酵解,机制可能是激活素A可促进EMT通路关键基因及GLUT3的表达。激活素A编码基因INHBA高表达可作胃癌患者预后不良的标志。该细胞因子可能成为抑制胃癌转移和改善恶病质的作用靶点。
