基于MRI、钼靶和病理的列线图预测肿块型乳腺浸润性导管癌前哨淋巴结转移的价值
2022-07-27朱芸张书海王小雷杨昭李淑华杨丽汤晓敏马宜传谢宗玉
朱芸,张书海,王小雷,杨昭,李淑华,杨丽,汤晓敏,马宜传,谢宗玉*
乳腺癌是我国女性最常见的恶性肿瘤,发病率呈逐年上升趋势,在女性恶性肿瘤中位居首位。乳腺癌包括多种类型,其中浸润性导管癌(invasive ductal carcinoma,IDC)占据大约70%,是威胁女性健康最大的一种类型[1-2]。前哨淋巴结(sentinel lymph node,SLN)反映了淋巴结(lymph node,LN)的组织学状态,在乳腺癌分期、选择合适的治疗方式及预后的评估中都至关重要[3]。目前临床上多采用腋窝淋巴结清扫(axillary lymph node dissection,ALND)或前哨淋巴结活检(sentinel lymph node biopsy,SLNB)来确定SLN 的状态。然而,这些方式都是有创的,常引起一定的并发症,如上肢淋巴水肿、感觉障碍、肩关节活动受限等,影响患者的生活质量及精神状态[4-5]。此外,术前注射放射性示踪剂、手术时间延长以及SLNB期间可能出现的假阳性结果等限制因素不容忽视[6]。因此如果能够在ALND 或SLNB 术前,找到一种方便直观且较为准确的评估SLN 状态的方法具有重要意义。目前MRI 和钼靶(mammography,MG)是术前评估乳腺癌分期及LN转移与否的主要影像学手段,但是他们都有各自的局限性。MG 是乳腺癌筛查首选的影像检查方法,对钙化敏感度高,但对致密型腺体的敏感度较低[7]。MRI的多方位、多参数、多序列成像,可以作为MG重要的补充检查手段,获取更多的信息。其中T2加权成像(T2-weighted imaging,T2WI)频率衰减反转恢复序列(spectral attenuated inversion recovery,SPAIR),能清除病灶周围高信号脂肪成分,显示病灶内部及周围含水成分;扩散加权成像(diffusion weighted imaging,DWI)上有助于显示高信号的病灶,在发现隐匿病灶、明确病变范围等方面有优势;动态对比增强磁共振成像(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)可以显示病灶的强化方式及程度,分析病灶内部的血流动力学特征。但MRI 对钙化识别能力有限,特异度较差,容易造成假阳性从而导致不必要的活检和过度治疗。目前还没有基于术前MRI、MG 影像特征联合临床病理构建的列线图用来预测SLN 转移的研究,本研究以肿块型IDC 为研究对象,探讨基于术前MRI、MG 影像特征联合临床病理因素构建的列线图在预测SLN 转移中的价值。
1 材料与方法
1.1 一般资料
回顾性分析2018 年1 月至2021 年4 月蚌埠医学院第一附属医院乳腺癌患者临床病理及影像资料,共纳入312 例IDC 患者,均为女性,年龄23~73(49.4±9.0)岁。纳入标准:(1)经病理证实为IDC 患者;(2)术前或穿刺活检前行MRI和MG检查;(3)病灶为肿块型;(4)原发性乳腺癌。排除标准:(1)双乳癌或隐匿性乳腺癌;(2) MRI 及MG 检查前行放化疗等辅助治疗;(3)已发生远处转移的患者;(4)图像质量不佳或资料缺失。
将312例IDC患者按3∶1随机分成训练组(234例)与验证组(78例)。记录所有患者的临床资料及术后病理信息。包括:年龄、肿瘤位置、肿瘤象限、肿瘤最大径、肿瘤数量、临床T分期、LN触诊、病理分级、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体2 (human epidermal growth factor receptor 2,HER2)、Ki-67、脉管浸润、SLN 转移情况。当病灶数量≥2 个,仅对最大病灶进行评估[8]。本研究经过蚌埠医学院第一附属医院医学伦理委员会批准,免除受试者知情同意,批准文号:2020-84。
1.2 检查设备及方法
(1)采用Philips Achieva 3.0 T双梯度超导型MRI扫描仪,SENSE 7通道乳腺专用线圈。采取俯卧位,双乳置于线圈环槽中。MRI 扫描序列和参数:(1) SE T1WI:TR 400 ms,TE 10 ms,层厚5 mm,层间距1 mm,FA 90°,FOV 350 mm×350 mm,矩阵 216×194,NEX 2.0;(2) FSE T2WI SPAIR:TR 5000 ms,TE 60 ms,层厚5 mm,层间距1 mm,FA 90°,FOV 350 mm×350 mm,矩阵 260×274,NEX 1.0;(3) DWI:TR 2500 ms,TE 40 ms,层厚5 mm,层间距1 mm,FA 90°,FOV 350 mm×350 mm,矩阵 184×95,NEX 2.0,b=0、800 s/mm2;(4) DCE-MRI:TR 4.8 ms,TE 2.4 ms,层厚5 mm,层间距1 mm,FA 10°,FOV 350 mm×350 mm,矩阵252×339,NEX 1.0。分6 个时相采集图像,每个时相扫描80 s,从第2 个时相扫描开始,对比剂为钆喷酸葡胺(拜耳先灵医药公司,德国),剂量为0.2 mmol/kg,随后以流速1.5 mL/s 注射生理盐水20 mL。在Philips Extended MR Workspace EWS工作站,选取病灶强化最明显的位置画感兴趣区,尽量避开囊变坏死区,绘制时间-信号强度曲线(time intensity curve,TIC)。
(2)采用德国Siemens Mammomat Inspiration乳腺X 线机,行头尾位及内外斜位标准双体位投照,采用自动曝光装置,必要时进一步行数字乳腺断层摄影。
1.3 MRI及MG图像分析
分别由一名具有18年影像诊断经验的主治医师与一名具有15年影像诊断经验的副主任医师对图像进行独立阅片,依照第5版美国放射学院的乳腺影像报告和数据系统[9](Breast Imaging Reporting and Data System,BI-RADS)进行图像分析,当意见出现分歧时,经协商达成一致。MRI评价指标包括:(1)背景实质增强(background parenchymal enhancement,BPE):指纤维腺体组织的正常强化,大约在强化后90 s 出现,包括极少、轻度、中度、重度;(2)纤维腺体组织构成分类:几乎全部为脂肪(a型),散在分布的纤维腺体组织(b 型),不均匀分布的纤维腺体组织(c 型),致密纤维腺体组织(d 型);(3)肿块形状:卵圆形(包括分叶状)、圆形、不规则形;(4)肿块边缘:清晰、不清晰;(5)病灶强化特点:均匀、不均匀、边缘强化;(6) TIC曲线:持续上升型(Ⅰ型)、平台型(Ⅱ型)和速升速降型(Ⅲ型);(7) BI-RADS 分类;(8)是否伴有腋窝淋巴结(axillary lymph node,ALN)转移(图1)。MG 评价指标包括:(1)肿块边缘:规则、不规则;(2)病灶内有无钙化;(3) BI-RADS分类;(4)是否伴有ALN转移。根据国内外研究报道[10-11],ALN发生转移时,主要影像征象包括:(1)形态改变:LN门结构消失、偏心性皮质增厚、LN边缘不规则、短径≥10 mm、纵横比减小(常<2)、形态近似圆形、LN融合;(2)LN强化:强化幅度增高、不均匀强化或环形强化、DWI呈高信号、TIC为Ⅱ型或Ⅲ型。
1.4 病理及免疫组化检查
ER、PR 判定标准:阳性细胞≤10%为阴性,>10%为阳性;HER2 判定标准:+++为阳性,-/+为阴性,++或++~+++时用荧光原位杂交检测存在基因是否扩增;脉管浸润判定标准:以D2-40 和CD34 分别标记淋巴管和血管,D2-40和CD34阳性的淋巴管和血管内发现癌细胞即可判定为脉管浸润。
1.5 统计学分析
采用SPSS 26.0 和R 软件(版本3.5.1)进行统计分析。计数资料以“例(%)”表示。两组间比较采用χ2检验或Fisher 精确检验,对于四格表,当总样本量n≥40,且频数T≥5,采用χ2检验;n≥40,且至少1 个1≤T<5,采用校正χ2检验;n<40 或至少1 个T<1,采用Fisher 精确检验。对于多行多列表,不超过20%单元格的T<5,采用χ2检验;如果超过20%单元格的T<5,或至少1 个T<1,采用Fisher 精确检验。采用多因素Logistic 回归分析,筛选出独立预测因子,构建预测SLN 转移的列线图模型。通过绘制ROC曲线,利用ROC曲线下面积(area under the curve,AUC)、校准曲线、Hosmer-Lemeshow (H-L)检验对模型进行评估。P<0.05为差异有统计学意义。
2 结果
2.1 训练组与验证组比较
312 例患者中,训练组234 例,验证组78 例。患者的临床病理、MRI、MG 特征在两组间差异无统计学意义(P>0.05) (表1~3),可用于模型的构建与验证。
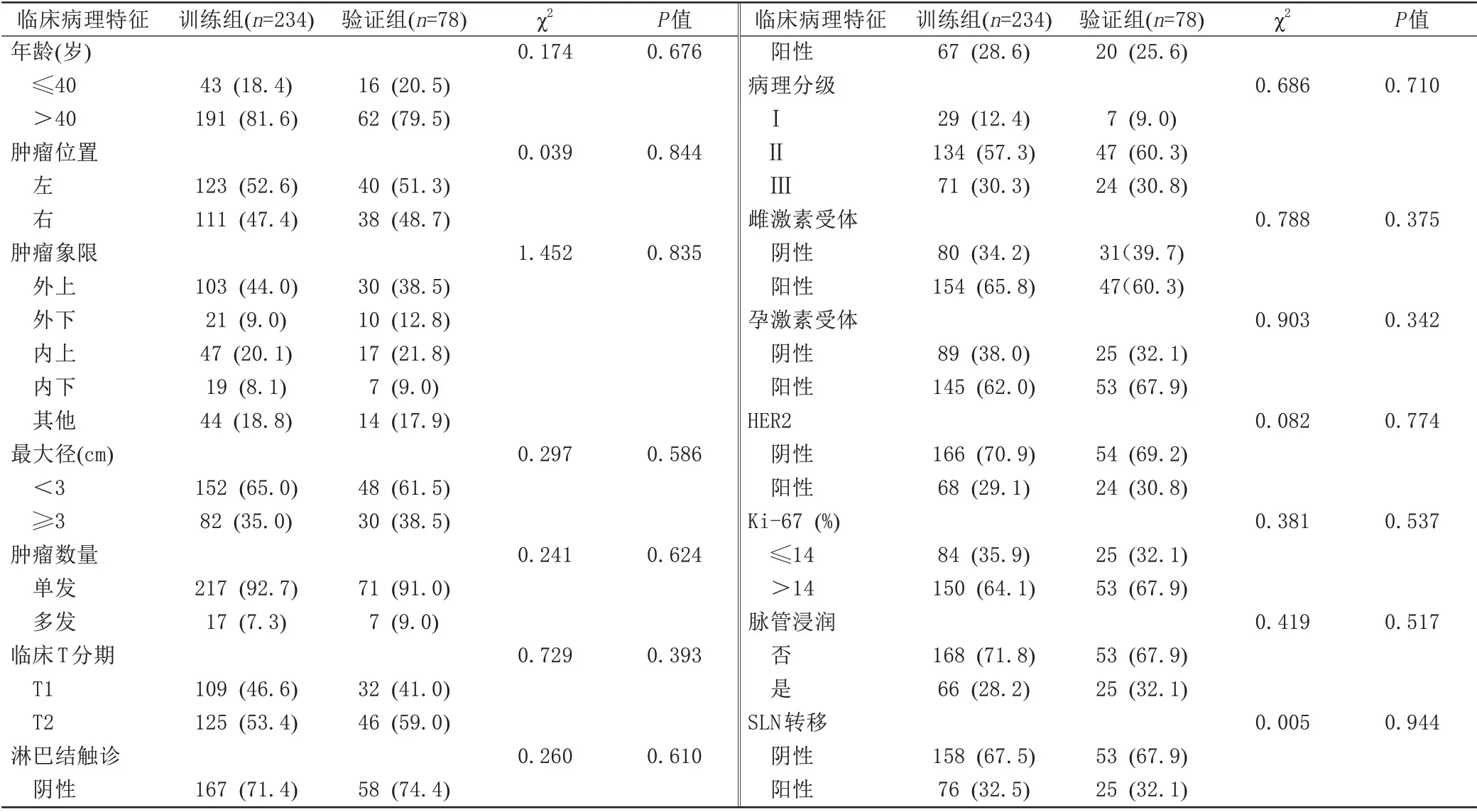
表1 训练组与验证组临床病理特征的比较Tab.1 Comparison of clinicopathological features between the training and validation groups
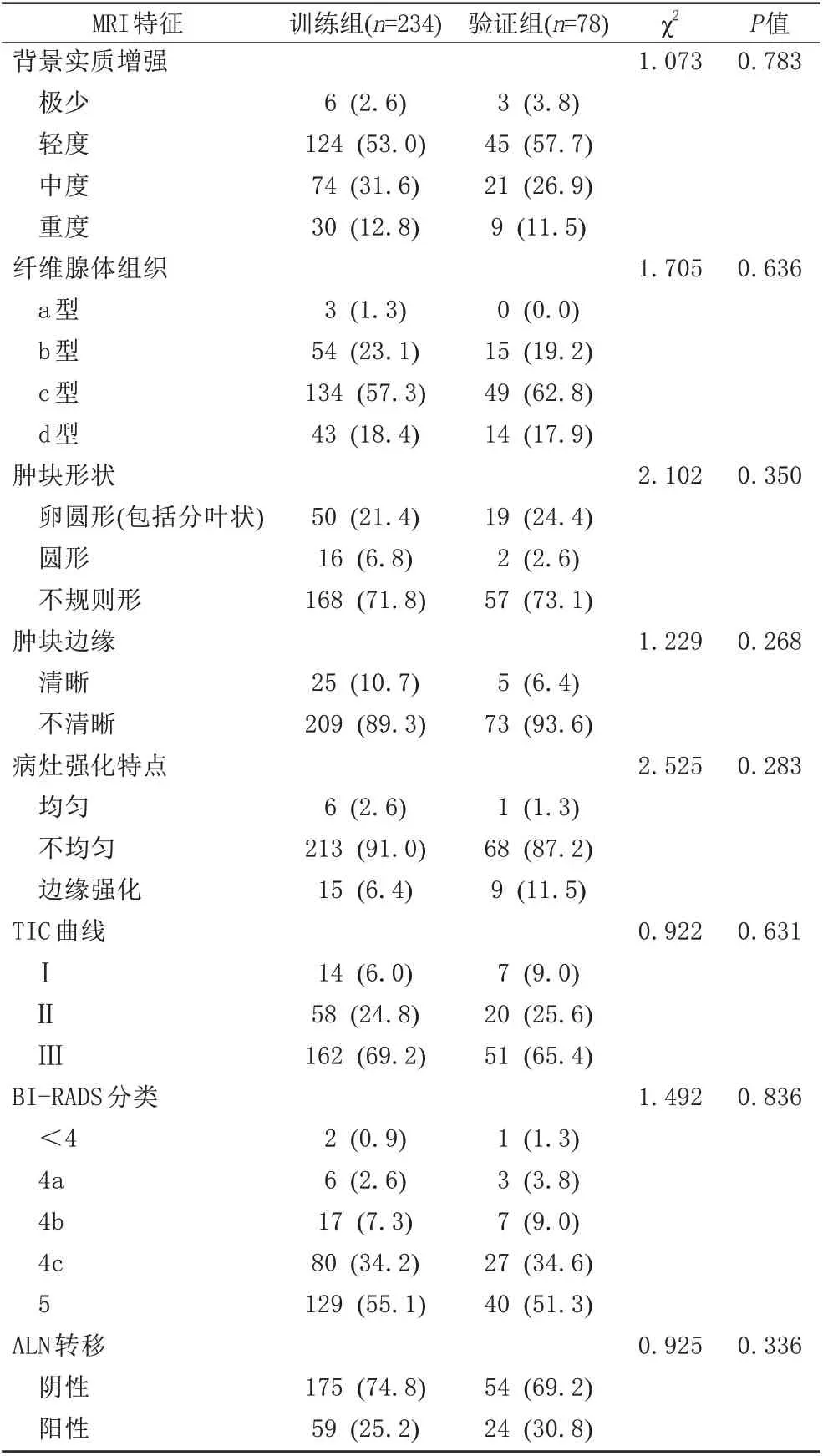
表2 训练组与验证组MRI特征的比较Tab.2 Comparison of MRI features between the training and validation groups
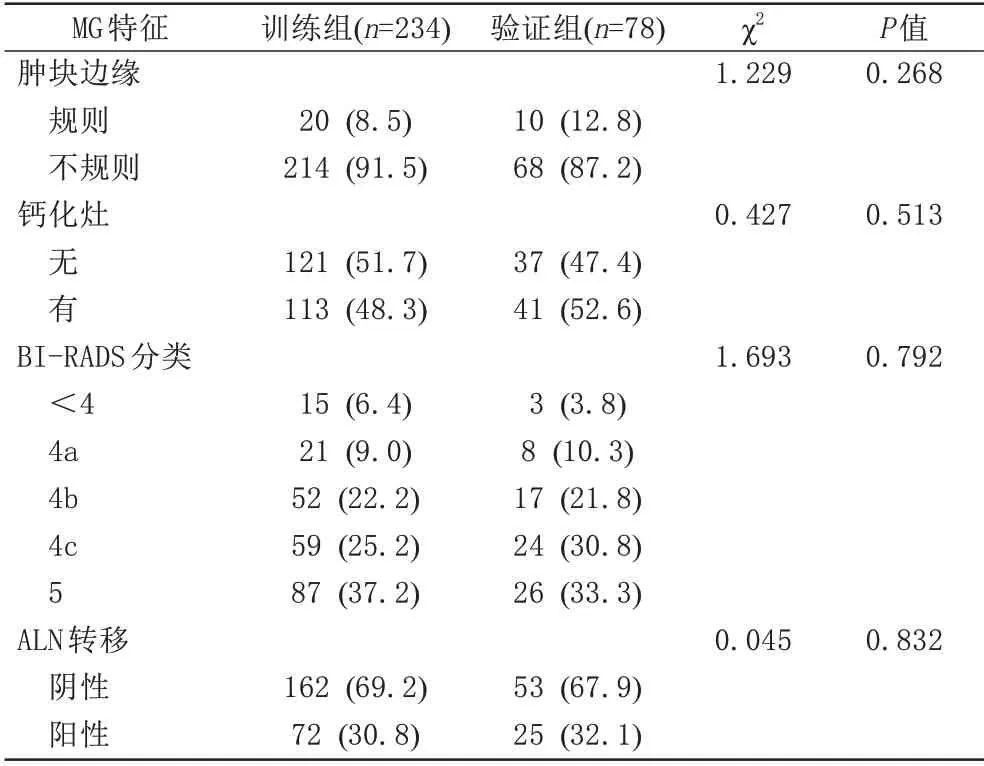
表3 训练组与验证组MG特征的比较Tab.3 Comparison of MG features between the training and validation groups
2.2 列线图预测模型的建立
使用训练组数据进行模型的构建,训练组234例IDC中,SLN阴性组158例,阳性组76例,2组患者的临床病理、MRI、MG特征比较见表4~6。结果显示,肿瘤最大径、临床T分期、LN触诊、PR、HER2、脉管浸润、MRI(肿块形状、BI-RADS 分类、ALN 状态)、MG (BI-RADS 分类、ALN 状态)这11 个变量在2 组间差异均有统计学意义(P<0.05)。通过多因素Logistic 回归分析,得到肿瘤最大径(P=0.037)、LN 触诊(P=0.045)、MRI(ALN 状态) (P=0.020)、MG (ALN 状态) (P=0.022)、脉管浸润(P<0.001)为预测SLN 转移的独立危险因素(表7)。使用R 软件对这5 个变量绘制列线图预测模型(图2)。
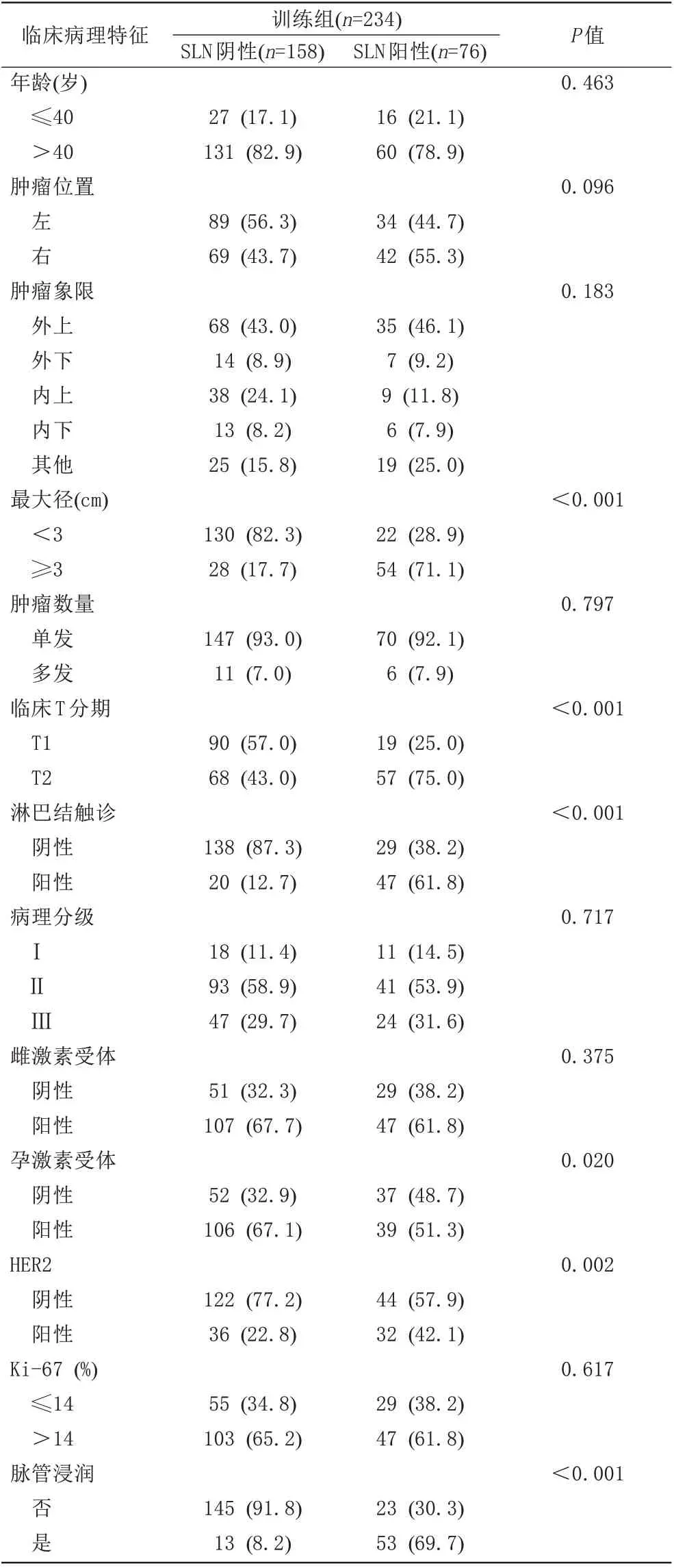
表4 训练组临床病理特征与SLN转移的相关性Tab.4 Correlation between clinicopathological features and sentinel lymph node metastasis in the training group
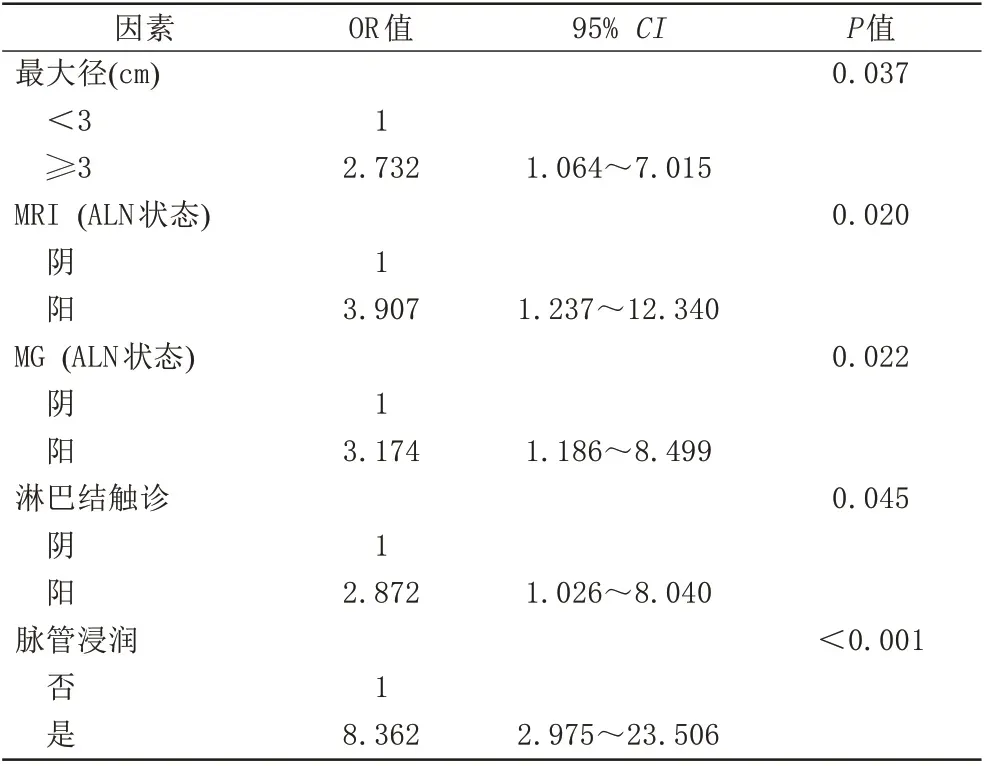
表7 预测SLN转移的多因素Logistic回归分析Tab.7 Multi-factor Logistic regression analysis for predicting SLN transfer
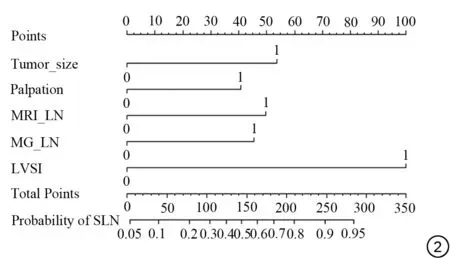
图2 SLN转移列线图预测模型。Tumor_size:肿瘤最大径(0:肿瘤最大径<3 cm,1:肿瘤最大径≥3 cm);Palpation:淋巴结触诊(0:阴性;1:阳性);MRI_LN:MRI 上淋巴结转移(0:阴性;1:阳性);MG_LN:钼靶上淋巴结转移(0:阴性;1:阳性);LVSI:脉管浸润(0:否;1:是)。Fig. 2 The nomogram prediction model of SLN metastasis. Tumor_size:maximum diameter of tumor (0: tumor maximum diameter <3 cm; 1:tumor maximum diameter ≥3 cm); Palpation: lymph node palpation (0:negative; 1: positive); MRI_LN: LN metastasis on the MRI (0: negative;1: positive); MG_LN: LN metastasis on the MG (0: negative; 1: positive);LVSI:lymphovascular invasion(0:no;1:yes).
2.3 列线图预测模型的评价
训练组与验证组AUC 值分别为0.908 (95%CI:0.863~0.942)和0.897 (95%CI:0.808~0.955),提示模型的预测能力好(图3)。同时绘制校准曲线,得到训练组与验证组中3条曲线走势基本一致,提示模型预测值与实际值差异无统计学意义(图4)。在Hosmer-Lemeshow 检验拟合优度中得到,训练组:χ2=1.746,P=0.883,验证组:χ2=4.730,P=0.579,P均>0.05,提示模型的预测能力好。
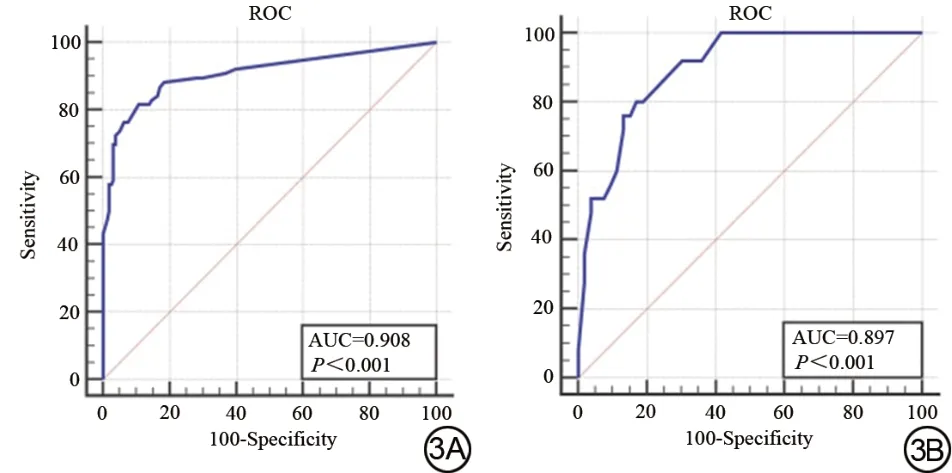
图3 训练组(3A)及验证组(3B) ROC 曲线,曲线下面积AUC 分别为0.908和0.897。Fig. 3 The ROC curve of the training (3A) and the verification (3B)groups,whose AUC is 0.908 and 0.897.
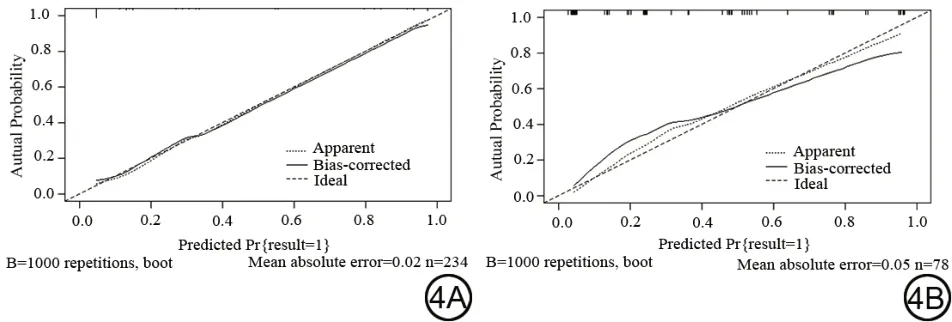
图4 训练组(4A)及验证组(4B)校准曲线。Fig. 4 The calibration curve of the training (4A) and verification (4B)groups.

表5 训练组MRI特征与SLN转移的相关性Tab.5 Correlation between MRI features and sentinel lymph node metastasis in the training group
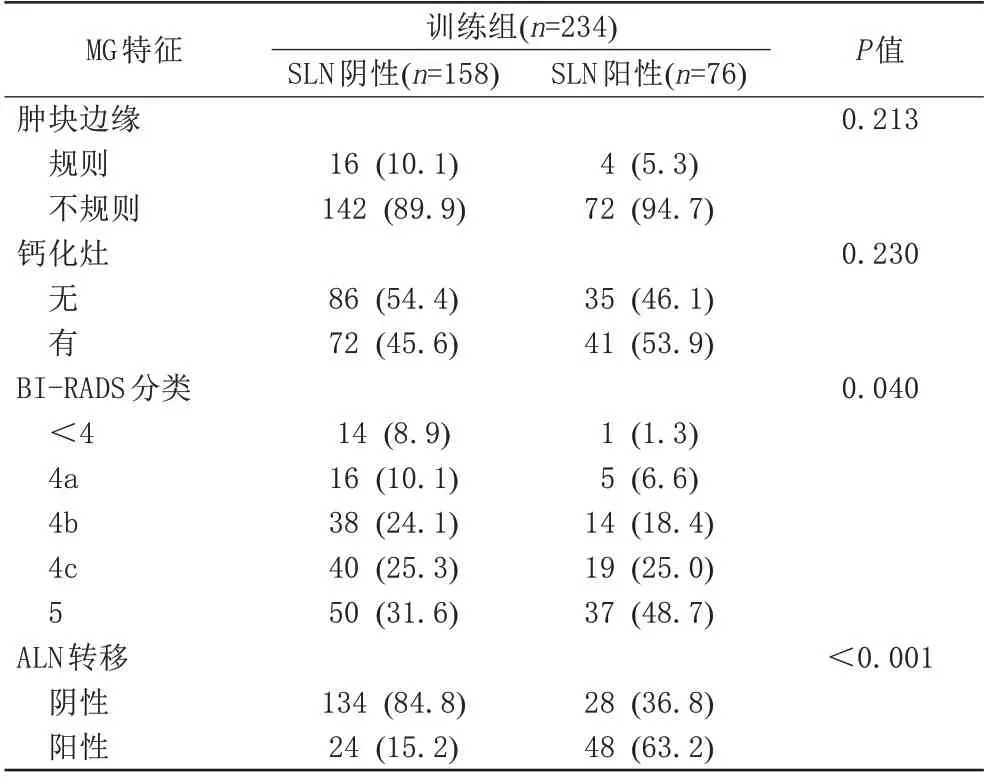
表6 训练组MG特征与SLN转移的相关性Tab.6 Correlation between MG features and sentinel lymph node metastasis in the training group
3 讨论
本研究以肿块型IDC 为研究对象,分析了术前MRI 及MG 影像特征与SLN 转移的相关性,并联合临床病理因素,建立列线图预测模型,通过内部验证评估模型的预测效能。研究结果表明,基于术前MRI及MG的影像特征联合临床病理因素构建的列线图模型能较好地预测SLN 转移情况,直观地计算出SLN 转移风险,可以作为SLNB术前与患者,尤其是极低风险患者讨论后续治疗时更容易接受的临床工具。
3.1 术前MRI、MG 影像特征及临床病理因素与SLN 转移的相关性
近年来,有很多学者研究了乳腺癌LN 转移与原发病灶的影像特征之间的相关性[12-13]。本研究单因素分析中MRI 上肿块的形状、BI-RADS 分类以及MG 上BI-RADS 分类与SLN 转移有相关性,这可能是由于肿瘤的形状越不规则,BI-RADS 分类越高提示肿瘤恶性可能性越高,侵袭性越强,当癌细胞过度增殖时,更容易侵犯LN,发生血行转移。但在多因素分析中差异没有统计学意义,这可能与本研究样本量偏少以及与其他特征之间存在共线性产生假关联。本研究中MRI及MG图像上评价是否伴有ALN转移是预测SLN转移的独立危险因素,这与马微妹等[8]研究结果相符,可能是由于癌细胞通过淋巴管引起边缘窦的异常增生,侵犯皮质、髓质,从而导致LN门形态异常、LN皮质增厚、边缘不规则等改变[14-15]。
本研究中年龄、肿瘤的位置、数量及临床T分期与SLN 转移均无相关性,原发肿瘤的最大径、LN 触诊与SLN 转移相关,这与Chen 等[16]研究结果相符。这可能是因为肿瘤越大,生长越活跃,肿瘤细胞过度增殖,越容易发生LN转移。目前对于生物学预后因子对SLN转移的预测价值仍存在争议[17],本研究显示在单因素分析中,PR (+)、HER2 (+)与SLN转移有相关性,在多因素回归分析中,显示无相关性,这与Chen 等[18]研究结果一致,而Xie 等[19]研究显示PR (+)、HER2 (+)更容易发生SLN 转移。本研究表明脉管浸润(+)更容易发生SLN 转移,这与Okuno 等[20]研究结果一致。这可能主要由于癌细胞通过淋巴管或血管转移至区域LN和远处脏器,癌细胞淋巴管浸润和血管浸润的发生在LN转移过程中扮演着重要角色。虽然脉管浸润只能通过肿瘤穿刺活检或者术后病理获得,属有创性参数,但是对比SLNB 及ALND 来说,还是容易获得,且可以减少不必要的术后并发症。
3.2 SLN转移列线图预测模型的临床应用价值
目前,关于乳腺癌LN 转移列线图预测模型是国内外研究的热点[21-23]。Liu 等[24]研究了基于临床、病理及MG 特征的列线图模型,得到AUC 为0.801,准确率为70.3%。Wang 等[25]构建了基于临床病理及超声特征的列线图,得到AUC分别为0.907。还有学者[26]研究了基于DCE-MRI影像组学和临床病理特征,建立SLN转移预测模型,得到AUC为0.869。此外,Yang等[27]建立了预测SLN转移数目的列线图模型,得到训练组和验证组的AUC 分别为0.845 和0.804。以往这些模型大多是提取单一手段的影像特征或单一组学特征,联合两种影像方法的研究比较少见。本研究的创新在于联合了MRI、MG 这两种常用的影像检查方法,分析了原发肿瘤及ALN影像特征,并将临床病理参数纳入模型的构建,提高了预测模型的效能。结果显示,肿瘤最大径≥3 cm、LN 触诊(+)、MRI (ALN+)、MG(ALN+)、脉管浸润(+)在列线图上的分值分别为54、41、50、46、100,将各预测指标的分值进行总和,对应在总分轴上,得到的概率值就反映了患者发生SLN转移风险,从而有利于临床医生与患者之间进行有效的沟通,制订个体化治疗方案。
3.3 局限性
(1)本研究根据BI-RADS 进行图像分析,由于肿块和非肿块这两大类病变影像学特征描述的语言及描述角度不同,且肿块型病灶多见,因此本研究仅针对肿块型病灶进行研究,可能存在一定的选择偏倚,后续会扩大样本量并将非肿块型病灶进一步纳入研究;(2)本研究虽然进行了内部验证,但在投入临床使用前仍需通过大样本、多中心实验数据来验证模型的效能;(3)放射科医师人工阅片获取影像特征,可能存在一些主观误差;(4)本研究笼统地将ALN 的状态定义为ALN 转移与否,未将LN 具体影像特征作为一个独立的预测指标纳入分析,在后续研究中将加入影像组学等数据,争取挖掘出更多有价值的信息。
综上所述,基于术前影像学特征(MRI上ALN状态、MG上ALN状态)及临床病理因素(肿瘤最大径、LN触诊、脉管浸润)构建的列线图模型是一种预测肿块型IDC患者SLN转移状态的新方法,可以有效地协助临床医生预测SLN转移风险,减少低风险患者不必要的侵入性LN切除和相关并发症,使SLN转移阴性患者受益。
作者利益冲突声明:全体作者均声明无利益冲突。
