紫锥菊根中菊苣酸提取工艺及对氧化应激肠道细胞的保护作用研究
2022-07-27李一鹏刘聚祥王庚南
李一鹏,张 虎,任 娟,任 欣,刘聚祥,王庚南
(河北农业大学动物医学院,保定 071000)
目前,中药免疫增强剂成为畜牧养殖业研究热点,其不但能够提高机体的免疫水平,还能够避免长期使用化学药物对动物机体产生的毒副作用以及药物残留等问题[1]。菊苣酸是一种可以从紫锥菊、菊苣等菊科植物中广泛提取出来的咖啡酸衍生物,又名二咖啡酰酒石酸。研究显示,菊苣酸作为一种中药提取物具有抗炎、抗肿瘤、抗氧化、提高机体免疫力等药理功效[2]。紫锥菊的地上部分及根中均含菊苣酸[3],而根中菊苣酸含量最高。伏健[4]曾用乙醇回流法对紫锥菊头状花序进行提取试验,优化提取工艺得到了菊苣酸含量为0.45%。孟创鸽[5]用超声波提取法提取了紫锥菊茎部的菊苣酸,菊苣酸得率为1.51 mg/g。也有学者利用加热回流[6]及超声波协同方法[7]对紫锥菊根部进行了研究,但提取率相对较低。用更安全的提取溶剂更简便的提取方法,更能迎合工业化生产的需求,所以本研究以紫锥菊根为原料,乙醇为溶剂,超声提取为手段,优化菊苣酸的提取工艺。
氧化应激是指动物机体在代谢过程中产生大量的氧化自由基和活性氧,可能会造成机体抗氧化系统的失衡,造成一定程度的氧化损伤。在动物的集约化养殖过程中,氧化应激的危害已经十分明显,如心脏病、乳房炎、肾病、消化道炎症等疾病都可能通过氧化应激导致,很大程度上影响了畜牧养殖业的发展[8]。而造成动物氧化应激的原因多种多样,如环境因素、自身状态的改变、外源致病菌或病毒等[9]。在蛋鸡的养殖中,氧化应激会对蛋鸡产蛋后期繁殖性能造成影响[10],Tarin[11]首次提出蛋鸡卵巢老化是由于胞内活性氧的积聚和与衰老相关的细胞损伤造成的;仔猪的氧化应激会造成采食量和平均日增重的下降[12];更有研究显示,母牛在高产期由于体内大量的代谢活动,造成活性氧的聚积,从而产生氧化应激,对奶牛的产奶量和乳制品的质量有一定影响[13]。故抗氧化剂的研究和发展对畜牧养殖业的发展以及对提高畜牧养殖产品的质量有着重大意义。
研究表明,菊苣酸可以通过降低细胞内活性氧和脂质过氧化物丙二醛的积累、清除自由基、抑制氧化低密度脂蛋白等方式,发挥抗氧化损伤的药理作用[14]。Liu等[15]通过体外抗氧化试验证明菊苣酸清除DPPH·、·OH和ABTS·+自由基的能力很强,高于咖啡酸和酒石酸的抗氧化能力。常小文[16]以人肝癌细胞(Hep G2)细胞为研究对象,证明了菊苣酸体内甲基化代谢产物对该细胞氧化应激损伤有较强的抗氧化活性,且菊苣酸甲基化的程度越高,其抗氧化活性就越强。口服是最常用且是适应性最佳的给药方式,但目前菊苣酸对肠道细胞的抗氧化应激损伤作用鲜有报道。本研究针对人结肠腺癌细胞(Caco-2)及猪小肠上皮细胞(IPEC-J2)两种肠道细胞,构建氧化应激模型,进一步证明菊苣酸在肠道细胞中的抗氧化作用。
1 材料与方法
1.1 材料
1.1.1 细胞和主要试剂 人结肠腺癌细胞(Caco-2细胞)购自协和细胞库;猪小肠上皮细胞(IPEC-J2细胞)购自北纳生物科技有限公司。紫锥菊根粉末(80目)由上海源叶生物科技有限公司提供;菊苣酸标准品由中国食品药品检定研究院提供;无水乙醇由天津北辰方正试剂厂生产;乙腈(色谱级)和甲醇(色谱级)均购自德国默克股份两合公司;DMEM高糖培养基和HBSS溶液均购自北京索莱宝科技有限公司。
1.1.2 主要仪器 液相色谱仪(HPLC1525)产自Waters公司;KQ-500DE型数控超声波清洗仪产自昆山市超声仪器有限公司;离心机产自上海安亭科学仪器厂;细胞培养箱购自赛默飞世尔科技有限公司;酶标仪购自伯乐公司。
1.2 方法
1.2.1 色谱条件 二元溶剂泵(Waters1525),自动进样器(Waters2487),二极管阵列检测器(PDA,Waters2998),Waters Sunfire 反相C18色谱柱(250 mm×4.6 mm,5 μm),流动相为0.1%磷酸水溶液(A)和乙腈(B),等度洗脱流动相比例A∶B为7∶3,流速1 mL/min,柱温35 ℃,检测波长327 nm,进样量20 μL。
1.2.2 溶液的配制及标准曲线的制作 标准品溶液:精密称量1.0 mg菊苣酸标准品溶于流动相中,配制成1 mg/mL,再稀释成500、200、100、50、20 μg/mL浓度的标准品溶液,按照1.2.1项下色谱条件进行检测,记录峰面积,以菊苣酸浓度(μg/mL)为横坐标,以峰面积为纵坐标,绘制标准曲线。
1.2.3 检测限及定量限 配制一系列浓度的标准溶液进行色谱检测,当信号和噪音的比值(S/N)为3时即为方法的检测限,当S/N=10,且将此时的浓度带入标准曲线中,实测浓度和规定浓度偏差在±20%以内时,所得浓度即为定量限。
1.2.4 超声辅助提取单因素试验 称取10.0 g紫锥菊根粉末,放入250 mL圆底烧瓶中,以不同浓度(30%、40%、50%、60%、70%、80%)的乙醇作为提取剂,按照不同料液比(1∶12、1∶15、1∶18、1∶21)进行混匀后,在不同温度(40、50、60、70、80 ℃)下进行最大功率的超声提取(1、2、3次),提取不同时间(1、2、3 h),进行单因素试验,每个因素所得提取液进行冷冻干燥,称重,取一定量样品溶解进行高效液相色谱(HPLC)检测,每个因素进行3次平行试验计算菊苣酸得率。
1.2.5 超声辅助提取正交试验 选取各个单因素最优条件以及最优条件相邻的两个条件,进行正交试验设计,采用L9(34)正交试验设计表,设置时间、温度、料液比和乙醇浓度为影响因素,选取能够提取出最高含量菊苣酸的提取工艺,各项参数如表1所示,进行3次平行试验。

表1 因素水平表
1.2.6 菊苣酸细胞毒性试验 取对数生长期的细胞,以5×104/孔接种到96孔板中,在细胞培养箱中培养24 h,将每孔中的培养基取出弃去,用PBS溶液冲洗3次,分别加入不同浓度的菊苣酸(100、200、400、600、1 000 μmol/L),在细胞培养箱孵育24 h后,每孔中加入20 μL的MTT溶液,孵育4 h后弃去培养基,每孔中加入100 μL DMSO,避光震荡10 min,用酶标仪测定570 nm波长下各孔的吸光度值(D570 nm)。并计算细胞存活率:细胞存活率(%)=(试验组D570 nm/对照组D570 nm)×100%。
1.2.7 细胞氧化应激损伤模型的构建 将细胞接种到96孔板中,以H2O2为造模剂,加入不同浓度的H2O2(100、200、400、600、800、1 000 μmol/L),培养4 h,用MTT法检测各个孔的吸光度并计算各个浓度下细胞的存活率。当细胞存活率处在50%~70%[17]时,即构建氧化应激模型成功。
1.2.8 菊苣酸对细胞氧化损伤保护效果试验 将细胞接种到96孔板中,加入不同浓度菊苣酸(100、200、400、600、800、1 000 μmol/L),以抗坏血酸(200 μmol/L)为阳性对照,以等体积HBSS溶液为阴性对照,孵育24 h后除对照组外,其余组分别加入一定量的H2O2溶液(浓度通过1.2.7的结果确定),孵育4 h后用MTT法检测各个孔的吸光度并计算细胞存活率。以细胞存活率为纵坐标、药物浓度的对数值为横坐标,用GraphPad Prism 6.0软件对数据进行拟合,求得半数抑制浓度(IC50)。
1.2.9 菊苣酸对氧化损伤应激细胞的缓解效果试验 在构建的氧化损伤细胞中加入不同浓度的菊苣酸(浓度同1.2.8),以抗坏血酸(200 μmol/L)为阳性对照,以等体积HBSS溶液为阴性对照,孵育24 h后,用MTT法检测各个孔的吸光度(D570 nm)并计算细胞存活率。
2 结 果
2.1 标准曲线的建立
根据HPLC的结果建立标准品的线性回归方程为:Y=105.4X-47225,R2>0.999。
2.2 检测限和最低定量限
以信噪比(S/N)=3为检测限,S/N=10为定量限,经测定检测限为50 ng/mL,最低定量限为100 ng/mL。
2.3 超声辅助提取菊苣酸单因素试验
2.3.1 提取时间对菊苣酸得率的影响 取紫锥菊根粉末按照1∶18料液比加入80%浓度乙醇,在60 ℃下分别超声1、2、3 h,经HPLC检测后结果见图1A。由图1A可知超声2 h之内菊苣酸得率随时间延长而逐渐增高,但在2 h之后,菊苣酸得率无明显变化,提取时间选用2 h为佳。
2.3.2 乙醇浓度对菊苣酸得率的影响 取紫锥菊根粉末按照1∶18料液比加入30%、40%、50%、60%、70%、80%的乙醇,在60 ℃下超声2 h,经HPLC检测所得结果见图1B。由图1B可知,当乙醇浓度的小于40%时,随着浓度的升高菊苣酸得率增大,到40%达到最大,但是继续增大乙醇浓度其得率呈现逐渐减少的趋势,因此选用40%浓度的乙醇溶液为正交试验的中间浓度。
2.3.3 温度对菊苣酸得率的影响 取紫锥菊根粉末按照1∶18料液比加入80%浓度乙醇,分别在50、60、70、80 ℃下超声2 h,经HPLC检测所得结果见图1C。由图1C可知,在60 ℃以下,随着温度的升高,菊苣酸得率逐渐升高,而60 ℃之后菊苣酸得率随温度的升高而呈现降低的趋势,因此在60 ℃左右对紫锥菊根粉末提取能够得到较多的菊苣酸。
2.3.4 料液比对菊苣酸得率的影响 取紫锥菊根粉末按照1∶12、1∶15、1∶18、1∶21料液比加入80%浓度乙醇,在60 ℃下超声2 h,经HPLC检测所得结果见图1D。由图1D可知,在15倍体积提取溶剂之前随着料液比的增加提取率有所提高,但继续增大溶剂量,菊苣酸的提取率逐渐变小,故选用料液比为1∶15为宜。
2.3.5 提取次数对菊苣酸得率的影响 取紫锥菊根粉末按照1∶18的料液比在60 ℃下进行超声辅助提取2 h,取样后进行抽滤,将残渣收集再按照1∶18的料液比进行提取,总共提取3次,测得结果如图1E。由图1E可知,提取1次时紫锥菊根粉末中菊苣酸绝大部分被提出,只是剩余一小部分残存,出于经济、时间方面考虑,提取次数为1次。

图1 超声辅助提取菊苣酸单因素试验结果
2.4 超声辅助提取菊苣酸正交试验
由表2可知,在所选择的4个因素中温度对菊苣酸提取率影响最大,溶剂浓度次之,料液比和时间对得率影响相对较小,主次顺序为:温度>溶剂浓度>料液比=时间,选择最优水平温度为70 ℃,料液比为1∶18,超声时间为2 h,溶剂浓度选择50%,按照最优组合,即50%乙醇浓度按照1∶18的料液比,在70 ℃下超声2 h提取,菊苣酸提取得率为1.89 mg/g。

表2 正交试验结果
2.5 菊苣酸的细胞毒性试验
用不同浓度的菊苣酸孵育细胞24 h后,细胞存活率如图2所示,菊苣酸浓度在100~1 000 μmol/L的范围下,Caco-2和IPEC-J2细胞的存活率均在90%以上,故菊苣酸在100~1 000 μmol/L的浓度范围内对Caco-2和IPEC-J2细胞均没有毒性。

图2 不同浓度的菊苣酸处理24 h对细胞存活率的影响
2.6 细胞氧化损伤应激模型建立最佳浓度
由图3可知,当H2O2浓度为200 μmol/L时,Caco-2细胞存活率为62.43%,处在50%~70%之间,可以作为Caco-2细胞氧化损伤应激模型建立的最优浓度。当H2O2浓度为400 μmol/L时,IPEC-J2细胞存活率为62.06%,处在50%~70%之间,可以作为IPEC-J2细胞氧化损伤应激模型建立的最优浓度。

图3 不同浓度H2O2处理4 h对细胞存活率的影响
2.7 菊苣酸对细胞氧化损伤的保护效果
如图4所示,在用不同浓度菊苣酸处理细胞后,再用H2O2诱导细胞的氧化损伤,当菊苣酸浓度为800 μmol/L时,Caco-2细胞存活率最高,为74%,与阳性对照组相当;当菊苣酸浓度为100 μmol/L时,Caco-2细胞存活率为54.5%,与阴性对照组相当;经过计算,Caco-2细胞的IC50值为172.6 μmol/L。

图4 不同浓度的菊苣酸对细胞氧化损伤的保护效果
当菊苣酸浓度为600 μmol/L时,IPEC-J2细胞的存活率最高,为67.53%;当菊苣酸浓度为100 μmol/L时,IPEC-J2细胞的存活率为51.8%,与阴性对照组相当。经过计算,IPEC-J2细胞的IC50值为133.1 μmol/L。
2.8 菊苣酸对细胞氧化损伤的缓解效果
由图5可知,当菊苣酸浓度为400 μmol/L时,Caco-2细胞的存活率最高,为70.2%;当菊苣酸浓度为100 μmol/L时,Caco-2细胞的存活率最低,为52.8%。经过计算,其IC50值为207.5 μmol/L。
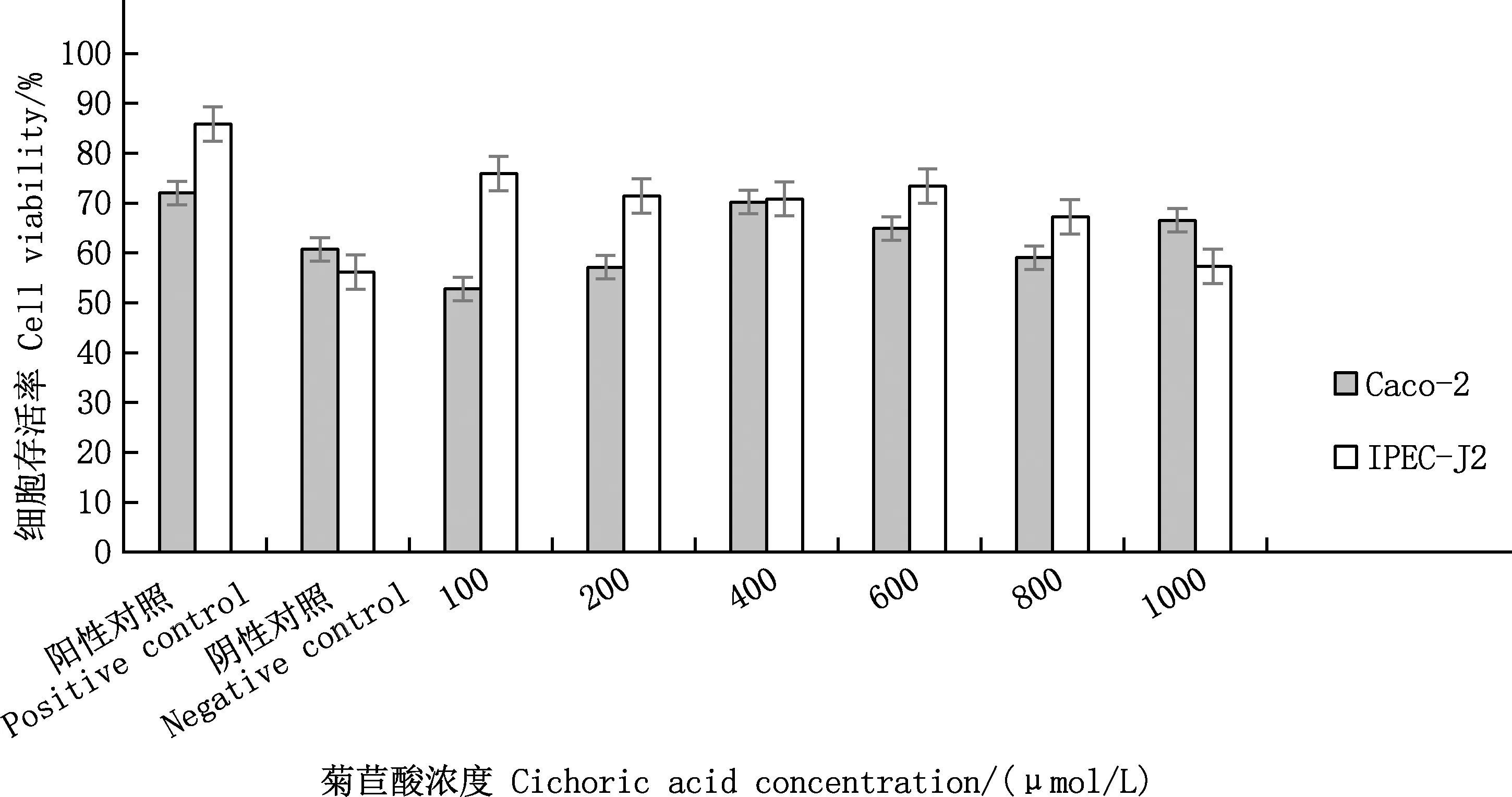
图5 不同浓度的菊苣酸对细胞氧化损伤的缓解效果
当菊苣酸浓度为100 μmol/L时,IPEC-J2细胞的存活率最高,为75.92%;当菊苣酸浓度为1 000 μmol/L时,IPEC-J2细胞的存活率为57.33%,与阴性对照组相当。经过计算,IPEC-J2细胞的IC50值为196.5 μmol/L。
3 讨 论
菊苣酸的获取途径包括用化学方法合成[18]以及从植物体内提取纯化。但由于用化学合成法容易产生较多的副产物,造成一定程度的环境污染,且长期服用容易产生耐药性或造成肝肾损伤。所以天然植物中的菊苣酸提取工艺的优化是重中之重。在有关菊苣酸提取的相关文献中,多以紫锥菊全草或是地上部分为原料,而在相关研究中菊苣酸在紫锥菊的花和根中含量丰富,分别为1.2%~3.1%和0.6%~2.1%[19],且根部含量最高,所以本研究选用紫锥菊根粉作为原材料。而较短的提取时间,较少的提取次数,简单的提取方法,安全的提取溶剂更能适应工业化生产,对比相关文献的回流提取[20]及超声辅助提取法[5],本提取工艺更加便捷,省时,且得率较高。
对于氧化应激损伤细胞模型的建立,应激源的选择多种多样,前人通过很多试验证明了很多应激源均可以成功构建氧化应激细胞模型。除H2O2[21]、MPP+[22]、6-OHDA[23]等化学类应激源外,还包括一些物理类应激源与生物类应激源[24]。本试验选用H2O2为应激源进行细胞氧化损伤应激模型的建立,其优点在于H2O2性质稳定,易于获得、成本较低且效果明显。此外在建立细胞氧化损伤应激模型的过程中发现,IPEC-J2与Caco-2细胞所需的H2O2溶液的浓度并不一致,说明不同的细胞系对H2O2溶液的氧化应激效果有所差异。
天然酚酸及多糖类药物均有良好的抗氧化效果,而菊苣酸是从紫锥菊等菊科植物中提取出来的天然酚酸类化合物。在本研究中菊苣酸作用于两种肠道细胞的氧化应激保护和缓解作用的IC50值在133.1~207.5 μmol/L之间,均远小于文献中用DPPH法测定的茶多酚的抗氧化IC50值(0.143 mg/mL),与三七多糖的抗氧化IC50值(0.055 mg/mL)相接近[25],同时在选定浓度下最强的抗氧化效果与所选定的阳性药物抗坏血酸相当,且保护效果的IC50值小于缓解效果的IC50值,显示菊苣酸在这两种肠道细胞中具有很好的氧化损伤保护和缓解效果,且对氧化损伤的保护效果明显优于其缓解效果,在一定程度上证明了菊苣酸具有成为肠道细胞的天然抗氧剂的潜力。
4 结 论
本研究设计了4个因素3个水平正交试验,对提取方案进行优化,最终得到了菊苣酸提取率最高的优化方案为:50%乙醇浓度按照1∶18的料液比,在70 ℃下超声2 h提取,最终菊苣酸提取得率为1.89 mg/g。并发现菊苣酸对Caco-2和IPEC-J2两种肠道细胞均有很强的保护和缓解氧化损伤的效果,其保护作用的IC50值分别为172.6和133.1 μmol/L,缓解作用的IC50值分别为207.5和196.5 μmol/L。
