糖尿病肾病患者尿液基质金属蛋白酶组织抑制剂2、胰岛素样生长因子结合蛋白7的水平及其临床意义
2022-07-26顾帅帅金艳盛范茂虓
顾帅帅, 朱 琳, 金艳盛, 丁 岚, 范茂虓
(江苏省苏州市吴中人民医院, 1.肾内科, 2.内分泌科, 江苏 苏州, 215000)
糖尿病肾病(DN)是糖尿病最常见的微血管并发症。目前, DN的病因和发病机制尚不明确,但可导致蛋白尿、水肿、高血压等症状,严重者甚至可引起肾衰竭,危害患者生命健康[1-2]。随着糖尿病和DN发病率逐年升高, DN合并急性肾损伤(AKI)的患者例数也逐年增多[3]。国外研究[4]认为,肾小管上皮细胞在DN环境中活化后分泌的炎症因子或纤维化因子在DN发病机制中起重要作用。目前报道[5-6]用于早期检测肾小管上皮细胞损伤的尿液标志物有3类: 第一类为炎症标志物,包括白介素-18(IL-18)和中性粒细胞明胶酶相关的脂质钙蛋白(NGAL); 第二类为细胞损伤标志物,主要包括肾损伤分子1(KIM-1)、肝脂肪酸结合蛋白和α谷胱甘肽S-转移酶; 第三类为细胞周期阻滞标志物,如基质金属蛋白酶组织抑制剂2(TIMP-2)、胰岛素样生长因子结合蛋白7(IGFBP7)。国内有关尿液TIMP-2、IGFBP7在AKI中的研究[7-8]较多,而关于TIMP-2、IGFBP7在DN患者中的研究报道并不多见。本研究分析尿液TIMP-2、IGFBP7水平诊断DN患者发生AKI的价值,现报告如下。
1 资料与方法
1.1 一般资料
选取2017年6月—2020年6月在本院肾内科、内分泌科住院治疗的254例DN患者为研究组,其中男178例,女76例,年龄18~80岁,平均(48.68±16.42)岁。纳入标准: ① 年龄≥18岁者; ② 符合DN诊断标准者,即糖尿病病史超过5年或有糖尿病视网膜病变; ③ 持续蛋白尿者, 24 h尿白蛋白排泄率>30 mg, 或尿白蛋白与肌酐比值>30 mg/g, 或24 h尿蛋白定量>0.5 g。排除标准: ① 进展为终末期肾病或已经开始肾脏替代治疗者,包括血液透析、腹膜透析、肾移植等; ② 糖尿病合并原发性肾小球疾病或其他继发性肾脏疾病患者。选取230例单纯2型糖尿病患者为对照组,其中男155例,女75例,年龄18~76岁,平均(48.27±15.63)岁。
1.2 研究方法
根据血清肌酐水平及尿量将DN患者分为AKI组19例和非AKI组235例。AKI诊断标准: 血清肌酐水平在48 h内上升值超过26.4 μmol/L或血肌酐上升值超过入院时50%以上,或患者尿量<0.5 mL/(kg·h)且持续6 h以上(若仅依据尿量作为AKI诊断标准时,需排除肾后性或脱水等容量不足引起的尿量减少)。合并慢性肾功能不全患者住院期间血肌酐突然上升或尿量突然减少也纳入AKI组。
对照组收集1次晨尿, DN合并AKI患者在入院时收集1次晨尿, DN合并非AKI患者在入院时及入院后每隔48 h收集1次晨尿,至少收集5次或直至确诊为新发AKI。每次收集尿液10 mL, 记录并贴好标签后离心,取上层清液1 mL置于-80℃条件下保存,待统一检测。采用酶联免疫吸附法检测尿液TIMP-2、IGFBP7水平及尿肌酐水平,试剂盒购自美国RayBiotech公司,操作方法均按照试剂盒说明书步骤进行。所有患者尿液TIMP-2、IGFBP7水平均按照尿肌酐水平进行标准化。
1.3 观察指标
记录患者年龄、性别、体质量指数(BMI), 检测血清肌酐、血清白蛋白、糖化血红蛋白(HbA1c)、血尿酸、尿素氮、尿微量白蛋白、24 h尿蛋白定量、尿β2-微球蛋白、估算肾小球滤过率(eGFR)。eGFR[mL/(min·1.73 m2)]= 175×[血肌酐(mg/dL)]-1.234× [年龄(岁)]-0.179× 性别(男性=1, 女性=0.79)。根据eGFR对DN患者进行分期: Ⅰ期为eGFR≥90 mL/(min·1.73 m2); Ⅱ期为eGFR 60~<90 mL/(min·1.73 m2), 表现为轻度下降; Ⅲ期为eGFR 30~<60 mL/(min·1.73 m2), 表现为中度下降; Ⅳ期为eGFR 15~<30 mL/(min·1.73 m2), 表现为大幅下降; Ⅴ期为肾衰竭, eGFR<15 mL/(min·1.73 m2); 分期结果为Ⅰ期32例, Ⅱ期84例, Ⅲ期90例, Ⅳ期48例。
1.4 统计学方法

2 结 果
2.1 研究组与对照组临床资料比较
研究组与对照组患者年龄、男性比率、BMI比较,差异无统计学意义(P>0.05); 研究组血清肌酐、HbA1c、血尿酸、尿素氮、尿微量白蛋白、24 h尿蛋白定量、尿β2-微球蛋白均高于对照组,血清白蛋白、eGFR均低于对照组,差异有统计学意义(P<0.05)。见表1。

表1 研究组与对照组临床资料比较
2.2 不同临床分期DN患者血清肌酐及尿液TIMP-2、IGFBP7水平比较
Ⅲ期、Ⅳ期DN患者血清肌酐、TIMP-2与尿肌酐的比值(TIMP-2/尿肌酐)、IGFBP7与尿肌酐的比值(IGFBP7/尿肌酐)均高于Ⅰ期、Ⅱ期患者,差异有统计学意义(P<0.05)。见表2。
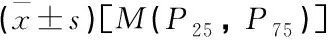
表2 不同临床分期DN患者血清肌酐及尿液TIMP-2、IGFBP7水平比较
2.3 AKI组与非AKI组DN患者血清肌酐及尿液TIMP-2、IGFBP7水平比较
与非AKI组相比, AKI组患者血清肌酐水平及尿TIMP-2/尿肌酐、尿IGFBP7/尿肌酐水平均上升,差异有统计学意义(P<0.05)。见表3。
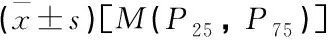
表3 AKI组与非AKI组DN患者血清肌酐及尿液TIMP-2、IGFBP7水平比较
2.4 尿液TIMP-2、IGFBP7水平与相关指标的关系
尿液TIMP-2、IGFBP7水平与血清肌酐、HbA1c、血尿酸、尿素氮、尿微量白蛋白、24 h尿蛋白定量、尿β2-微球蛋白均呈正相关(P<0.05), 与血清白蛋白、eGFR均呈负相关(P<0.05)。见表4。

表4 尿液TIMP-2、IGFBP7水平与相关指标的关系
2.5 尿液TIMP-2、IGFBP7、血清肌酐诊断DN患者发生AKI的价值
ROC曲线结果显示,入院时尿液TIMP-2、IGFBP7、血清肌酐预测DN患者发生AKI的曲线下面积(AUC)分别为0.676(95%CI: 0.587~0.756)、0.864(95%CI: 0.792~0.918)、0.618(95%CI: 0.528~0.703), 尿液TIMP-2联合IGFBP7预测DN患者发生AKI的AUC为0.926(95%CI: 0.866~0.965), 见表5、图1。

表5 尿液TIMP-2、IGFBP7、血清肌酐诊断DN患者发生AKI的价值
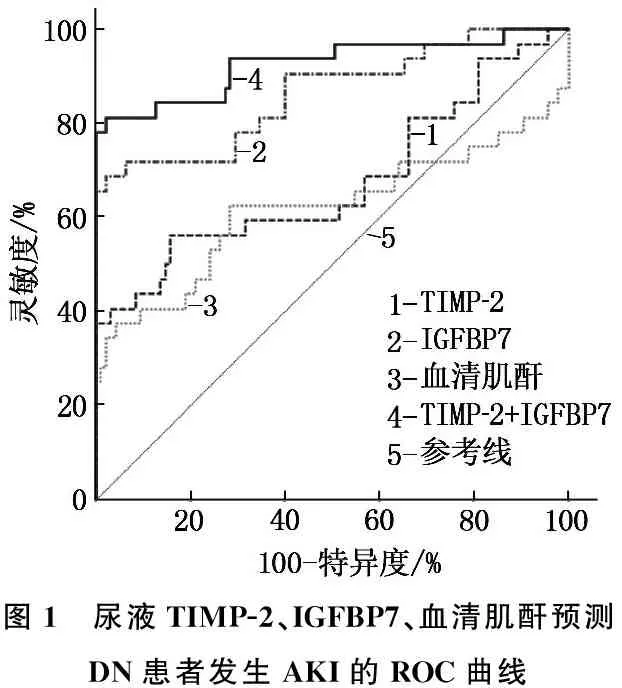
图1 尿液TIMP-2、IGFBP7、血清肌酐预测DN患者发生AKI的ROC曲线
3 讨 论
DN是导致终末期肾脏病的主要原因,也是导致糖尿病患者死亡的重要原因之一[9-10]。早期预测DN患者AKI的发生有利于尽早开展治疗。TIMP-2、IGFBP7作为细胞周期阻滞标志物,国内外多项研究[10-11]发现其在AKI中发挥作用,且可能参与发病机制。基质表达增加和衰退减少导致的细胞外基质成分过度积累是肾纤维化发展的原因之一。基质成分由基质金属蛋白酶(MMPs)调控, TIMP-2被称为MMPs的调节因子[12]。肾小管细胞损伤率的增加导致细胞周期阻滞,而细胞周期阻滞被认为是一种肾保护机制[13]。在这种情况下, TIMP-2、IGFBP7这2种细胞蛋白在肾小管上皮细胞中过度表达,而尿液中这些蛋白的水平升高表明肾小管细胞处于应激状态[14-15]。本研究结果显示,随着DN患者病理分级加重,尿TIMP-2/尿肌酐、尿IGFBP7/尿肌酐水平均升高, Ⅳ期DN患者尿TIMP-2/尿肌酐、尿IGFBP7/尿肌酐水平达到最高,表明尿液TIMP-2、IGFBP7水平变化可反映DN患者肾小球损伤及病情严重程度。XIE Y等[16]开展的一项队列研究发现, (TIMP-2)·(IGFBP7)值在重症监护病房AKI患者不良预后风险预测中有较高的特异性,可以作为AKI患者的预后生物标志物。本研究结果显示, DN合并AKI患者尿液TIMP-2/尿肌酐、IGFBP7/尿肌酐水平显著高于非AKI患者,表明尿液TIMP-2、IGFBP7可反映DN患者病情发展,可能与AKI发生有关,监测DN患者尿TIMP-2/尿肌酐、尿IGFBP7/尿肌酐水平变化可评估患者病情发展状况,实施精准干预措施,改善患者预后。本研究Pearson检验分析显示,尿液TIMP-2、IGFBP7水平与血清肌酐、HbA1c、血尿酸、尿素氮、尿微量白蛋白、24 h尿蛋白定量、尿β2-微球蛋白均呈正相关(P<0.05), 与血清白蛋白、eGFR均呈负相关(P<0.05), 进一步表明尿液TIMP-2、IGFBP7水平升高与DN患者的病情进展有关。
血清肌酐是一种内生肌酐,当患者出现肾损伤时,血清肌酐水平显著上升,可反映患者肾实质损伤情况。本研究结果显示,随着DN患者病理分期加重,血清肌酐水平也逐渐上升,且DN合并AKI患者血清肌酐水平显著高于非AKI患者。临床研究[17]发现,血清肌酐水平只在肾损伤后较长一段时间或者在患者病情发展严重后才显著增高,不能提示肾损伤早期肾功能的变化。有学者[18-19]通过收缩压干预实验研究发现,在AKI背景下,尿液IL-18、KIM-1、NGAL可作为评估肾小管细胞损伤的标志物,但其基线水平不能反映未来AKI发生风险,存在一定的局限性。ZHANG B等[20]在高糖条件下利用全细胞膜片钳记录大鼠肾小球系膜细胞ATP敏感性钾通道(KATP)电流情况,结果发现细胞中TIMP-2水平、KATP通路活性和腺苷酸激活蛋白激酶(AMPK)活性显著降低,同时可促进肾小球膜细胞增殖和Ⅳ型胶原产生; 利用KATP选择性开启剂二氮嗪(diazoxide)预处理可诱导TIMP-2生成,降低Ⅳ型胶原生成,表明TIMP-2可能在高糖诱导肾损伤中起保护作用。IGFBP7是一种与细胞过程有关的分泌蛋白, CAI X J等[21]研究发现,沉默IGFBP7可以抑制高糖诱导的足细胞凋亡和上皮间质转化(EMT), 而TGF-β1/Smad信号通路与细胞增殖、凋亡活性和EMT相关,揭示沉默IGFBP7可抑制TGF-β1/Smad通路活性,改善足细胞损伤,表明IGFBP7可能是治疗DN的潜在靶点。然而, TIMP-2、IGFBP7在DN患者中的具体作用机制有待进一步研究。本研究ROC曲线结果显示,血清肌酐、尿液TIMP-2、IGFBP7预测DN患者发生AKI的AUC分别为0.618、0.676、0.864, 可见尿IGFBP7的预测效能最好; 进一步行尿液TIMP-2、IGFBP7的联合检测,结果显示联合检测预测DN患者发生AKI的AUC为0.926, 特异度高达95.89%, 灵敏度也显著升高,提示尿液TIMP-2、IGFBP7联合预测效能最好。
综上所述,尿液TIMP-2、IGFBP7水平随DN患者病理分级加重而呈上升趋势,或可作为预测DN患者发生AKI的潜在生物标志物,监测两者水平变化可更好地评估患者病情发展,具有一定的临床实际意义。
