罗氟司特通过mTOR/ULK1/Atg13通路改善支气管哮喘小鼠气道炎症反应的研究
2022-07-26沈文婷秦建品
沈文婷, 秦建品, 许 诣
(湖北文理学院附属医院/湖北省襄阳市中心医院 儿科, 湖北 襄阳, 441021)
支气管哮喘(BA)是以喘息、胸闷、呼吸困难等为主要临床症状的慢性气道炎症性呼吸系统疾病[1-2]。支气管收缩、气道神经控制、过敏、细胞因子及炎症反应、免疫及先天易感性是BA的主要发病机制[3]。家族遗传性BA患者支气管组织中发现自噬激活激酶1(ULK1)、自噬相关蛋白5(Atg5)、自噬相关蛋白(Beclin1)等表达异常改变[4], 预示BA的发生发展可能与自噬水平异常关系密切,这也可能为BA的治疗提供新思路。哺乳动物雷帕霉素靶蛋白(mTOR)是自噬的负性调控因子,可磷酸化调控ULK1的不同位点,影响自噬相关蛋白13(Atg13)与FIP200复合物的形成,调控自噬启动及发生[5]。但mTOR/ULK1/Atg13通路介导的自噬反应在BA发生发展中的调控机制的相关研究较少。罗氟司特为一种新型、高度选择性磷酸二酯酶4抑制剂,体内外研究[6]证实其具有抗炎、免疫调节及改善气道重塑作用,被批准应用于慢性阻塞性肺疾病的治疗,但其在BA中的应用还处于探索阶段。本研究建立BA小鼠模型,给予罗氟司特药物干预治疗,并从mTOR/ULK1/Atg13自噬调控方面,探究其对气道炎症的影响机制,以期为罗氟司特在BA领域的应用提供理论依据。
1 资料和方法
1.1 实验材料
1.1.1 动物: SPF级健康雄性C57BL/6J小鼠,体质量20~22 g, 6~7周龄,购自于北京医科大学实验动物科学部[SCXK(京) 2018-0003], 所有小鼠于动物房中饲养(12 h光照及12 h黑暗交替照明,温度25 ℃, 湿度50%)。本试验经伦理委员会批准(ICAU-202004032651), 试验动物符合3R原则。
1.1.2 主要试剂及仪器: 罗氟司特(货号YJ-23180R, 上海雅吉生物科技有限公司); 雷帕霉素(货号R8140-25, 北京索莱宝科技有限公司); 自噬抑制剂(3-甲基腺嘌呤, 3MA)(货号YT66820, 北京伊塔生物科技有限公司); γ-干扰素(INF-γ)、肿瘤坏死因子-α(TNF-α)酶联免疫吸附试验(ELISA)试剂盒(货号ZN2638-ADL、ZN2764-XRL,北京百奥莱博科技有限公司); 磷酸化mTOR(p-mTOR)、白细胞介素-33(IL-33)、Atg13、mTOR、ULK1特定位点Ser757蛋白(ULK1 Ser757)、自噬标记蛋白微管相关蛋白轻链3B(LC3B)、Beclin1、B细胞淋巴瘤-2(Bcl-2)、IL-33, 黏液高分泌性标志蛋白(黏蛋白MUC5AC)抗体(美国abcam公司); 磷酸化Atg13(p-Atg13)(货号13007, 美国Signalway Antibody公司)、磷酸化ULK1 Ser757蛋白(p-ULKl Ser757)[货号6888T, 赛信通(上海)生物试剂有限公司)];动物肺功能仪(型号FinePointeTMPFT, 美国Buxco公司)等。
1.2 方法
1.2.1 小鼠BA模型建立及分组给药: 取小鼠,参照文献[7]用卵清蛋白(OVA)50 μg于1、5、8 d腹腔注射致敏,并于22~28 d用1% OVA生理盐水溶液雾化吸入建立小鼠BA模型,若小鼠出现呼吸喘促、哮鸣音、搔鼻、打喷嚏、口鼻处有白色黏性分泌物增多现象,表明造模成功。共造模成功50只小鼠,随机分为模型组、罗氟司特组、自噬激活剂-mTOR抑制剂(雷帕霉素)组,罗氟司特+雷帕霉素组,自噬抑制剂(3MA)组,每组10只。另取10只正常小鼠,于相同时间以相同方法给予等量生理盐水,作为正常对照组。各组小鼠均于造模成功后开始给药,罗氟司特参照文献[8]设置剂量1.0 mg/kg(生理盐水稀释至0.10 mg/mL, 按10 mL/kg体积灌胃给药, 1次/d); 雷帕霉素(1.0 mg/kg)及3MA (10 mg/kg)参照文献[9-10]设置剂量并经腹腔注射给药, 2次/周; 罗氟司特+雷帕霉素组灌胃给予罗氟司特(1.0 mg/kg)的同时,腹腔注射雷帕霉素溶液(1.0 mg/kg); 模型组及正常对照组灌胃给予10 mL/kg生理盐水,各组小鼠连续给药4周。
1.2.2 小鼠肺功能检测: 给药期间,观察小鼠呼吸及皮毛状态、口鼻等部位分泌物形成情况,咳嗽(或气喘)等肺系疾病特异性症状变化。给药结束后,用4%戊巴比妥钠溶液1 mL/kg腹腔注射麻醉小鼠后,于颈部正中处剪开皮肤,剥离周围组织分离气管,行气管插管术,用动物肺功能测定仪测定小鼠吸气阻力、呼气阻力、肺通气顺应性等肺功能变化。
1.2.3 支气管肺泡灌洗液(BALF)中嗜酸粒细胞及中性粒细胞计数及炎症因子检测: 检测完小鼠肺功能后,麻醉、暴露气管,结扎主支气管,输液针气管插管并固定,经气管注入4 ℃含酚红缓冲液5 mL, 轻轻按摩胸部20~30 s后,回收BALF, 共3次(回收率>90%), 将回收后的BALF于4 ℃、1 500转/min(5 cm有效离心半径)离心10 min, 取上清液, 1 mL磷酸缓冲溶液重悬细胞后,取10 μL于光学显微镜下进行细胞总数计数[(4个大格细胞总数/4)×104/mL]。取100 μL细胞重悬液,快速迪夫染色后,封片置于20倍光学显微镜下观察并分类计数,计数公式=(χ/200)×细胞总数,χ=5个视野中细胞所占百分比相加再除以5。取上清液,按ELISA试剂盒说明书检测INF-γ、TNF-α水平。
1.2.4 透射电镜检测及标本采集: 处死小鼠,沿支气管束走行方向,剪下约0.3 cm×0.3 cm组织块,浸入2.5%戊二醛后,送入电镜室检查自噬泡形成情况。取左肺组织,置于-80 ℃保存,取完整右肺组织迅速置于4%多聚甲醛中固定24 h,常规透明、浸蜡、包埋后,切成5 μm切片。
1.2.5 小鼠肺组织苏木精-伊红(HE)、过碘酸-雪夫(PAS)染色及TUNEL染色观察: 取右肺相同部位切片,按HE及PAS染色试剂盒说明书方法进行染色、封片后,置于光学显微镜下观察组织病理变化及杯状细胞化生状况。取肺组织切片,按TUNEL染色试剂盒说明书方法染色、封片后,在光学显微镜下观察细胞凋亡情况,用Image-pro plus软件系统检测棕黄色凋亡细胞数目,细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.2.6 蛋白质印迹法(Western blot)检测肺组织Atg13、p-Atg13、mTOR、p-mTOR、ULK1 Ser757、p-ULKl Ser757、LC3B、Beclin1、Bcl-2、IL-33、MUC5AC蛋白相对表达水平。取1.2.4中冰冻肺组织, 4 ℃解冻后,冰上均浆、离心提取蛋白,二喹啉甲酸(BCA)法测蛋白总浓度后,取100 μg蛋白上样,并进行电泳及转膜反应,加入一抗[Atg13、p-Atg13、mTOR、p-mTOR、ULK1 Ser757、p-ULKl Ser757、LC3B、Beclin1、Bcl-2、IL-33、MUC5AC, 1∶800; β-actin(内参), 1∶1 000]抗体, 4 ℃摇床孵育过夜,加入辣根过氧化物酶(HRP)羊抗兔二抗(1∶2 000), 37 ℃摇床孵育2 h, 增强化学发光法显色,以化学发光仪观察条带并拍照,以Image-J软件分析各组蛋白相对表达。
1.3 统计学分析
2 结 果
2.1 罗氟司特对小鼠一般行为的影响
正常对照组小鼠呼吸均匀正常,口唇鼻等部位无异常分泌物出现。模型组及罗氟司特+雷帕霉素组小鼠呼吸急促,搔鼻、打喷嚏,口鼻处白色黏性分泌物增多。雷帕霉素组小鼠呼吸减慢、俯伏不动、口鼻处白色黏性分泌物增多现象进一步加重。罗氟司特组及3MA组小鼠呼吸及节律渐复平稳、均匀,口鼻处白色黏性分泌物减少,搔鼻、打喷嚏现象减少或消失。
2.2 罗氟司特对小鼠肺功能的影响
与正常对照组相比,模型组小鼠吸气阻力、呼气阻力升高,肺通气顺应性降低,差异有统计学意义(P<0.05), 预示肺功能下降; 与模型组相比,罗氟司特组及3MA组小鼠吸气阻力、呼气阻力降低,肺通气顺应性升高,差异有统计学意义(P<0.05), 肺功能改善;与模型组相比,雷帕霉素组肺功能进一步降低,差异有统计学意义(P<0.05)。与罗氟司特组比较,罗氟司特+雷帕霉素组小鼠吸气阻力、呼气阻力升高,肺通气顺应性降低,差异有统计学意义(P<0.05)。见表1。

表1 各组小鼠肺功能比较
2.3 罗氟司特对小鼠BALF中性粒细胞及嗜酸粒细胞数目及炎性因子 INF-γ、TNF-α水平的影响
与正常对照组相比,模型组小鼠BALF中性粒细胞、嗜酸粒细胞数目增多, INF-γ、TNF-α水平升高,差异有统计学意义(P<0.05)。与模型组相比,罗氟司特组及3MA组小鼠中性粒细胞、嗜酸粒细胞数目减少, INF-γ、TNF-α水平降低,差异有统计学意义(P<0.05); 与模型组比较,雷帕霉素组中性粒细胞、嗜酸粒细胞数目增多,INF-γ、TNF-α水平升高(P<0.05)。与罗氟司特组相比,罗氟司特+雷帕霉素组小鼠中性粒细胞、嗜酸粒细胞数目增多, INF-γ、TNF-α水平升高,差异有统计学意义(P<0.05)。见表2。

表2 小鼠BALF中性粒细胞、嗜酸粒细胞数目及INF-γ、TNF-α水平比较
2.4 罗氟司特对小鼠肺组织结构变化及杯状细胞化生的影响
正常对照组小鼠肺组织结构完整,染色均匀; HE染色显示模型组及罗氟司特+雷帕霉素组小鼠气道、血管周围、肺间质等部位炎症细胞浸润、支气管管壁增厚等病理损伤严重; PAS染色可见气道上皮有大量呈紫红色的杯状细胞增生,黏液分泌增多。罗氟司特组及3MA组小鼠肺组织炎症细胞浸润、支气管壁增厚、杯状细胞化生等病理损伤缓解; 雷帕霉素组显示肺组织炎症细胞浸润、支气管壁增厚、杯状细胞化生等病理损伤进一步加重。见图1。

A: 正常对照组HE染色; B: 正常对照组PAS染色; C: 模型组HE染色; D: 模型组PAS染色; E: 罗氟司特组HE染色; F: 罗氟司特组PAS染色; G: 3MA组HE染色; H: 3MA组PAS染色; I: 雷帕霉素组HE染色; J: 雷帕霉素组PAS染色; K: 罗氟司特+雷帕霉素组HE染色; L: 罗氟司特+雷帕霉素组PAS染色。图1 各组小鼠肺组织HE染色及PAS染色图(放大200倍)
2.5 罗氟司特对小鼠肺组织气道上皮细胞自噬及凋亡的影响
正常对照组小鼠肺组织支气管上皮细胞结构正常,上皮细胞胞浆中几乎未见自噬泡形成及凋亡。电镜观察可见模型组小鼠支气管上皮细胞中,双层膜结构的细胞自噬泡聚集较多,部分自噬泡中可见吞噬物形成,TUNEL染色可见肺组织支气管上皮细胞棕黄色颗粒物质沉积增多,相较正常对照组凋亡率增高,差异有统计学意义(P<0.05)。与模型组相比,罗氟司特组及3MA组小鼠肺组织支气管上皮细胞自噬泡形成减少,上皮细胞凋亡率降低,差异有统计学意义(P<0.05); 与模型组相比,雷帕霉素组小鼠肺组织支气管上皮细胞自噬泡形成进一步增加,细胞凋亡率进一步升高,差异有统计学意义(P<0.05)。与罗氟司特组相比,罗氟司特+雷帕霉素组小鼠肺组织支气管上皮细胞自噬泡形成增多,上皮细胞凋亡率增高,差异有统计学意义(P<0.05)。见表3、图2。

表3 各组细胞凋亡率比较

A: 正常对照组电镜图; B: 正常对照组TUNEL染色图; C: 模型组电镜图; D: 模型组TUNEL染色图; E: 罗氟司特组电镜图; F: 罗氟司特组TUNEL染色图; G: 3MA组电镜图; H: 3MA组TUNEL染色图; I: 雷帕霉素组电镜图; J: 雷帕霉素组TUNEL染色图; K: 罗氟司特+雷帕霉素组电镜图; L: 罗氟司特+雷帕霉素组TUNEL染色图。图2 各组小鼠肺组织支气管上皮细胞电镜图(放大50 000倍)及TUNEL染色图(放大400倍)
2.6 罗氟司特对小鼠mTOR、p-mTOR、Atg13、p-Atg13、ULK1 Ser757、p-ULKl Ser757、LC3B蛋白表达的影响
与正常对照组相比,模型组小鼠肺组织p-mTOR/mTOR、p-Atg13/Atg13、p-ULKl Ser757/ULK1 Ser757表达降低, LC3B表达升高,差异有统计学意义(P<0.05)。与模型组相比,罗氟司特组及3MA组小鼠肺组织p-mTOR/mTOR、p-Atg13/Atg13、p-ULKl Ser757/ULK1 Ser757表达升高,LC3B表达降低,雷帕霉素组小鼠p-mTOR/mTOR、p-Atg13/Atg13、p-ULKl Ser757/ULK1 Ser757表达进一步降低, LC3B表达进一步升高,差异有统计学意义(P<0.05)。与罗氟司特组相比,罗氟司特+雷帕霉素组小鼠p-mTOR/mTOR、p-Atg13/Atg13、p-ULKl Ser757/ULK1 Ser757表达降低, LC3B表达升高,差异有统计学意义(P<0.05)。见图3、表4。
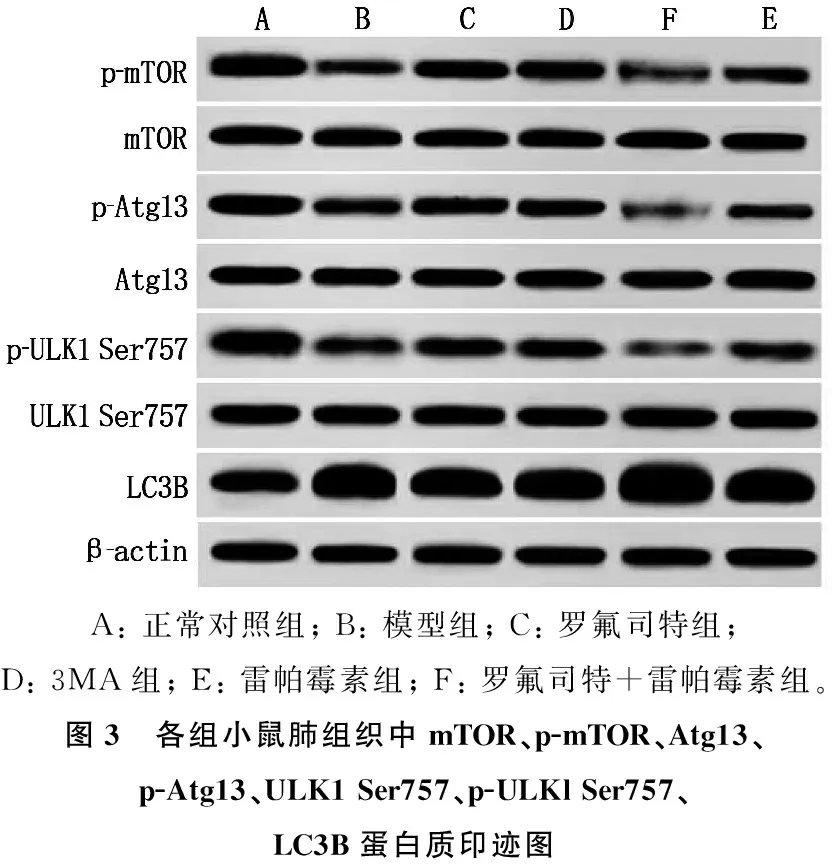
A: 正常对照组; B: 模型组; C: 罗氟司特组; D: 3MA组; E: 雷帕霉素组; F: 罗氟司特+雷帕霉素组。图3 各组小鼠肺组织中mTOR、p-mTOR、Atg13、p-Atg13、ULK1 Ser757、p-ULKl Ser757、LC3B蛋白质印迹图

表4 各组小鼠肺组织mTOR、p-mTOR、Atg13、p-Atg13、ULK1 Ser757、p-ULKl Ser757、LC3B蛋白表达
2.7 罗氟司特对小鼠Bcl-2、Beclin1、IL-33、MUC5AC蛋白表达的影响
与正常对照组相比,模型组小鼠肺组织Bcl-2蛋白表达降低, Beclin1、IL-33、MUC5AC蛋白表达升高,差异有统计学意义(P<0.05)。与模型组相比,罗氟司特组及3MA组小鼠肺组织Bcl-2蛋白表达升高, Beclin1、IL-33、MUC5AC表达降低,雷帕霉素组小鼠Bcl-2蛋白表达进一步降低, Beclin1、IL-33、MUC5AC蛋白表达进一步升高,差异有统计学意义(P<0.05); 与罗氟司特组相比,罗氟司特+雷帕霉素组小鼠织Bcl-2蛋白表达降低, Beclin1、IL-33、MUC5AC表达升高(P<0.05)。见表5、图4。

表5 各组小鼠肺组织Bcl-2、Beclin1、IL-33、MUC5AC蛋白表达比较
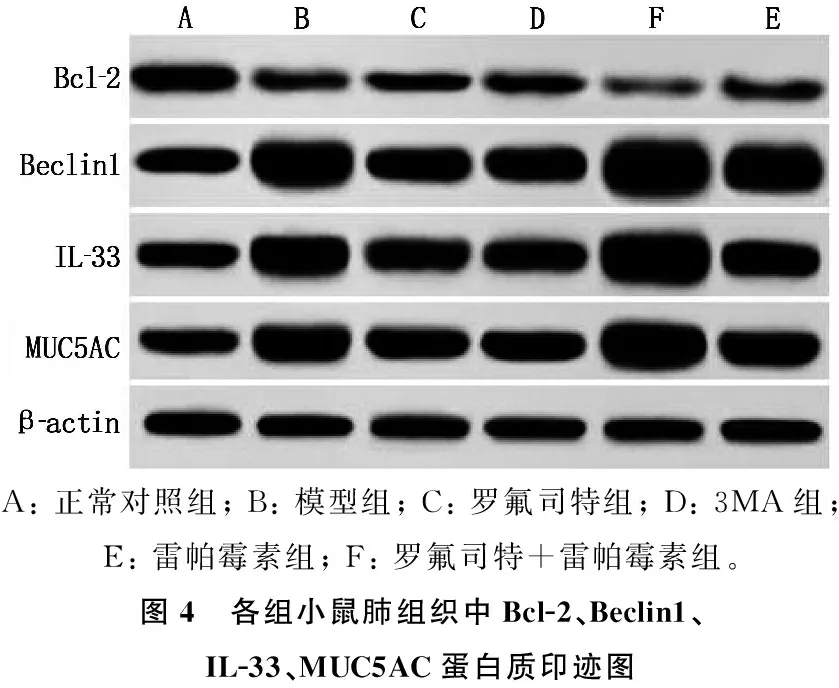
A: 正常对照组; B: 模型组; C: 罗氟司特组; D: 3MA组; E: 雷帕霉素组; F: 罗氟司特+雷帕霉素组。图4 各组小鼠肺组织中Bcl-2、Beclin1、IL-33、MUC5AC蛋白质印迹图
3 讨 论
气道慢性炎症、气道高黏液分泌可阻塞气流,导致BA患者呼吸困难[11]。MUC5AC是气道黏液高分泌标志蛋白,其表达升高,可反映BA气道黏液高反应状态[12]。本研究建立小鼠BA模型后,发现小鼠气道中嗜酸性粒细胞、中性粒细胞等炎症细胞聚集增多,支气管肺组织炎症浸润及杯状细胞化生增多, MUC5AC表达升高,肺功能下降严重,提示小鼠BA造模成功。吸入性糖皮质激素对大部分急性加重期BA患者治疗效果不甚显著,寻找特异性有效的治疗药物,一直是临床研究的热点之一[13]。临床报道[14]发现,罗氟司特对急性加重期BA患者气道重塑及肺功能损伤的改善效果优于糖皮质激素药物布地奈德,预示其在BA领域的应用具有广阔前景。本研究结果显示,罗氟司特干预组可显著缓解BA小鼠肺通气下降,抑制MUC5AC表达,并对支气管肺组织炎症浸润及杯状细胞化生有明显缓解作用,证实了罗氟司特在BA方面的应用价值,但其具体分子生物学机制还需进一步探究。
细胞自噬与BA的发生发展关系密切,并逐渐成为BA机制研究的热点之一[15]。研究[16-17]发现,哮喘患者及模型大鼠支气管组织中存在自噬激活现象,并认为LC3B表达与BA气道上皮细胞自噬有关[18]。本研究结果显示,模型组大鼠气道上皮细胞自噬泡数量及气道组织中自噬标记蛋白LC3B、Beclin1表达均升高的同时,气道上皮细胞凋亡率也显著增加,用自噬抑制剂3MA抑制自噬后,气道上皮细胞凋亡率显著降低,小鼠BA症状也显著缓解。罗氟司特干预组出现与3MA组相同的自噬及气道上皮细胞凋亡率降低现象,提示罗氟司特治疗BA的作用可能是通过抑制自噬、缓解BA气道上皮细胞凋亡而实现的。
mTOR/ULK1/Atg13通路是参与自噬、炎症、凋亡调节的关键通路。研究[19]发现, mTOR磷酸化活化水平增加,可促进Atg13-FIP200及ULK1 Ser757位点磷酸化,来阻断自噬复合物的形成,从而抑制自噬小体形成,阻断自噬启动; 另外mTOR也可直接调控抗凋亡因子Bcl-2表达,使Bcl-2能通过竞争性调节BH3受体域作用,抑制Beclin1依赖的自噬形成[20]。研究[21]发现,炎症信号因子IL-33是刺激气道炎症应激反应、促进气道上皮细胞凋亡及自噬标记蛋白LC3B异常表达升高的主要原因。本研究结果显示,模型组小鼠肺组织中mTOR/ULKl Ser757/Atg13通路磷酸化水平、Bcl-2抗凋亡蛋白异常降低,而Beclin1、LC3B自噬蛋白及炎症因子IL-33蛋白异常升高,提示mTOR/ULK1/Atg13通路磷酸化活化水平降低,可能参与BA小鼠肺组织炎症、自噬、凋亡过程。雷帕霉素可抑制p-mTOR水平, ULK1/Atg13通路磷酸化活化水平降低的同时,小鼠气道上皮细胞炎症、自噬、凋亡反应进一步加重, BA小鼠病理症状也进一步加重,但这与金华良等[22]报道的雷帕霉素促进自噬,缓解BA病理症状的机制相反,推测可能是雷帕霉素用量不一致及疾病程度不一致有关。罗氟司特与3MA干预组显示, mTOR/ULK1/Atg13通路磷酸化活化水平增高,肺组织炎症、自噬、凋亡反应降低。但雷帕霉素在促进自噬,加重BA症状的同时,还可减弱罗氟司特发挥的促进mTOR/ULK1/Atg13通路磷酸化活化、阻断自噬、抑制肺组织炎症及气道上皮细胞凋亡等作用。
综上所述,罗氟司特可通过促进mTOR/ULK1/Atg13通路磷酸化活化,阻断自噬,抑制肺组织炎症及气道上皮细胞凋亡,缓解BA病理症状。这为罗氟司特在BA领域的开发应用提供了一定参考。但BA自噬调控机制复杂,涉及多条途径、调控网络,罗氟司特调控自噬、缓解BA病理症状的其他调控机制还有待进一步研究。
