直肠癌术前放疗危及器官与临床靶区自动勾画的可行性研究
2022-07-26薛涛吴迪刘双童卢晓岩张恒秦浩人李海鹏孙婉君王辉
薛涛,吴迪,刘双童,卢晓岩,张恒,秦浩人,李海鹏,孙婉君,王辉
1.天津市人民医院放疗科,天津 300121;2.天津市人民医院肿瘤科,天津 300121;3.天津中医药大学中西医结合学院,天津 300193
前言
结直肠癌是常见的消化道恶性肿瘤之一,其发病率及死亡率呈逐年上升趋势[1]。据2020年国际癌症研究机构统计,结直肠癌位居全球癌症发病率第3位、死亡率第2 位[2]。直肠癌位置低、相邻器官解剖关系复杂,导致手术清除不彻底,术后易出现复发[3]。放射治疗在直肠癌综合治疗中有着重要的地位,可以为部分直肠癌患者降低肿瘤分期,提供手术机会,提高保肛率,改善患者的生活质量,降低局部复发率,延长生存期,术前同步放、化疗是局部晚期不可手术切除直肠癌的首选治疗方案[4-5]。
精确放疗技术要求放疗医师严格准确定义临床靶区(Clinical Target Volume,CTV)和危及器官(Organ at Risk,OAR)轮廓并逐层精准勾画,以保证在肿瘤靶区精确照射前提下,最大限度保护OAR[6-7]。然而手动勾画不仅复杂繁琐、耗时耗力,还受到医生对肿瘤学、解剖学的掌握程度和临床经验、影像质量等主、客观因素的影响,且同一勾画者在不同勾画中也会有偏差[8]。自动勾画软件可以提高勾画效率,减少人工勾画之间的个体差异[9]。本研究使用AccuLearning平台构建并训练自动勾画模型,配合使用AccuContour软件,对直肠癌术前容积旋转调强放疗患者的CTV与OAR进行自动勾画,通过比较自动勾画与手工勾画的几何轮廓和剂量学各项参数精度,来探讨其应用于临床的可行性。
1 资料与方法
1.1 临床资料
回顾性选取自2019年3月至2020年11月于天津市人民医院放疗科治疗的133 例直肠癌术前患者容积旋转调强放疗计划,其中,男99 例,女34 例;年龄24~85岁,平均(60.49±10.60)岁。
1.2 定位设备及方法
所有患者CT 定位前1 h 均排空大、小便,饮用加入泛影葡胺20 mL 的1 000 mL 水,然后等待1 h 后再行CT 扫描,以充盈膀胱,显影小肠。扫描时患者仰卧位,双手抱肘置于额头,热塑体膜固定。采用美国GE 公司16排大孔径CT 模拟机定位,由激光灯系统、螺旋CT和各种模拟软件构成。扫描参数:电压150 kV,电流300 mAs。扫描范围:上界自膈顶水平,下界至股骨中段水平;重建层厚:3.75 mm,完成后将图像传至飞利浦Pinnacle39.10治疗计划系统。
1.3 自动勾画系统
本研究应用厦门Manteia 公司开发的放疗图像处理软件AccuContour 以及自主训练平台AccuLearning构建自动勾画系统[10]。AccuContour 软件本身内置了多种常见的OAR和靶区的自动勾画[11],同时也可导入由AccuLearning 平台训练出的自动勾画模型。AccuLearning 是深度学习自主训练平台,它支持由用户导入的数据集来训练定制化的自动勾画模型。数据集的预处理分为以下3 个步骤:(1)ROI命名映射。DICOM 结构文件中的ROI名称可能包含有拼写错误或多种命名方式,ROI命名映射是指自动统计ROI名称并按照莱文斯坦距离进行排序,将其映射到统一的ROI目标命名;(2)Z-Score 标准化。深度学习的模型性能会受到数据集内数值变化的影响,Z-Score标准化以每个病例为单位,统计其图像的均值和标准差,将图像减去均值后再除以方差,达到数值范围统一同时不损失原始分布的目的;(3)体素间距重采样。出于特定的临床考虑,对于不同的病例会使用不同的重建方案以及不同的切片厚度和体素间距,本研究中将体素间距统一重采样为1.0 mm×1.0 mm,以减小不同病例间的空间尺度差异性。
本研究中,模型需要进行100 轮训练,每轮训练包含200 次迭代,一次完整的迭代流程包括数据增强、窗口采样、网络前向传播和损失函数优化。数据增强是指以一定的概率对数据进行随机变换,包含0.80 至1.25 倍数的缩放、-30°至30°的旋转等空间变换、图像直方图非线性变换、高斯噪声变换等。窗口采样是指以固定大小320×320像素的窗口,随机选择窗口中心点对图像进行裁剪。模型的网络结构采用U-Net,损失函数采用交叉熵和Dice 损失以1:1 的权重进行融合。
AccuLearning 训练产出的模型被导入至AccuContour 进行使用,AccuContour 对图像的自动勾画分为以下3 个步骤:(1)图像预处理。执行与AccuLearning 相同的Z-Score标准化及体素间距重采样;(2)模型预测。使用导入的自动勾画模型进行预测,得到初步勾画结果;(3)勾画后处理。过滤勾画中存在的体积偏小的碎块,并基于B样条插值技术对轮廓进行平滑处理,生成最终的DICOM结构文件。
1.4 自动、手动勾画CTV与OAR的几何轮廓评价
在飞利浦Pinnacle39.10 治疗计划系统中,133 例直肠癌患者的CTV 和OAR 均在定位CT 图像上,由同一放疗医师对照核磁共振影像资料,参考相关标准手动勾画,OAR 包括膀胱、小肠、左股骨头、右股骨头等,并经两名副主任医师进行器官勾画核对校准[12-13]。随机分组,训练集65 例,验证集16 例,测试集52 例,其中,训练集和验证集传入AccuLearning 平台用于训练自动勾画模型,测试集则传入AccuContour软件进行自动勾画。
以医生手工勾画轮廓为“金标准”,采用体积差异(ΔV)、Dice 相似性系数(DSC)、Jaccard 系数(JAC)、敏感性指数(SI)、包容性系数(lncl)、质心偏差(DC)、Hausdorff 距离(HD)等参数,来评估AccuContour 软件自动勾画CTV、OAR 轮廓的准确性。
1.5 评价参数
ΔV:自动与手动勾画在轮廓体积上的差异,越接近于0,表明两者体积上差异越小,其中,Vref为参考勾画的体积,Vauto为自动勾画的体积,公式如下所示:

DSC:自动与手动勾画在轮廓体积上的重合度,DSC 值为0~1,DSC 值为0 时表示两个轮廓完全不重合,DSC 值为1 时表示两个轮廓体积完全重合,公式如下所示:

JAC:自动与手动勾画轮廓的交集与两者并集的比值,用以比较两组勾画轮廓间的相似性与差异性。JAC 的范围为0~1,JAC 为0 时表示自动勾画的结果与人工勾画完全不相符,JAC 为1 时表明自动勾画的结果与人工勾画完全一致,公式如下所示:

SI:自动与手动勾画轮廓的交集与手工勾画轮廓中的比值。SI值的范围为0~1,SI为0 时表明自动勾画结果与手动勾画无交集,SI为1时表明自动勾画的轮廓完全包含手动勾画,公式如下所示:

Incl:自动与手动勾画轮廓的交集与自动勾画轮廓中的比值。IncI值的范围为0~1,IncI为0时表示两组勾画轮廓无交集,Incl 为1 时表明人工勾画轮廓完全包含自动勾画轮廓,公式如下所示:

DC:自动与手动勾画轮廓质心之间的距离(单位mm),用来评价两组轮廓之间的总体位置偏差。DC数值越大,说明两组勾画轮廓之间在位置上偏差越远。公式如下所示:

HD:自动与手动勾画轮廓两组点集在三维空间上的最大距离(单位mm),公式如下所示:
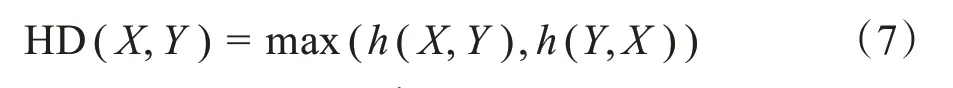
1.6 自动勾画、手动勾画CTV和OAR剂量学评价
采用飞利浦Pinnacle39.10 治疗计划系统,133 例直肠癌患者容积旋转调强计划均采用射线能量6 MV X 线,单、双弧SmartArc 优化方式,机架角180°~181°,靶区处方剂量1.8 Gy/25 f,剂量覆盖95%以上;OAR 限量要求:膀胱V35<50%、V40<40%、平均剂量(Dmean)<35 Gy;左、右股骨头V40<5%、Dmean<30 Gy;小肠最大剂量(Dmax)<50 Gy,Dmean<25 Gy。Vx表示接受xGy照射的体积占整个器官照射体积的百分比[14]。
将52例自动勾画CTV 和OAR后的测试病例,应用上述限定条件,进行计划优化及计算,生成对照计划,与人工勾画CTV 和OAR 的原始计划对比,通过剂量分布图、剂量-体积直方图(DVH),按照国际辐射单位和测量委员会(ICRU)83 号报告要求,进行两组计划临床剂量学比对[15]。
1.7 统计学方法
采用Graph Pad 9.0 软件对数据进行统计学分析。采用Kolmogorov-Smirnov 法检验数据的正态分布,符合正态分布的计量资料以均数±标准差表示,采用配对t检验;不符合正态分布的数据以M(Q1,Q3)表示,采用秩和检验进行组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 几何轮廓参数对比
几何轮廓参数比较见表1,DSC、JAC、SI、IncI、ΔV、DC、HD 对比,优劣顺序依次为:右股骨头、左股骨头、膀胱、CTV、小肠。CTV、OAR图像比较见图1、图2。图内蓝色轮廓为自动勾画结果,红色轮廓为手动勾画结果。
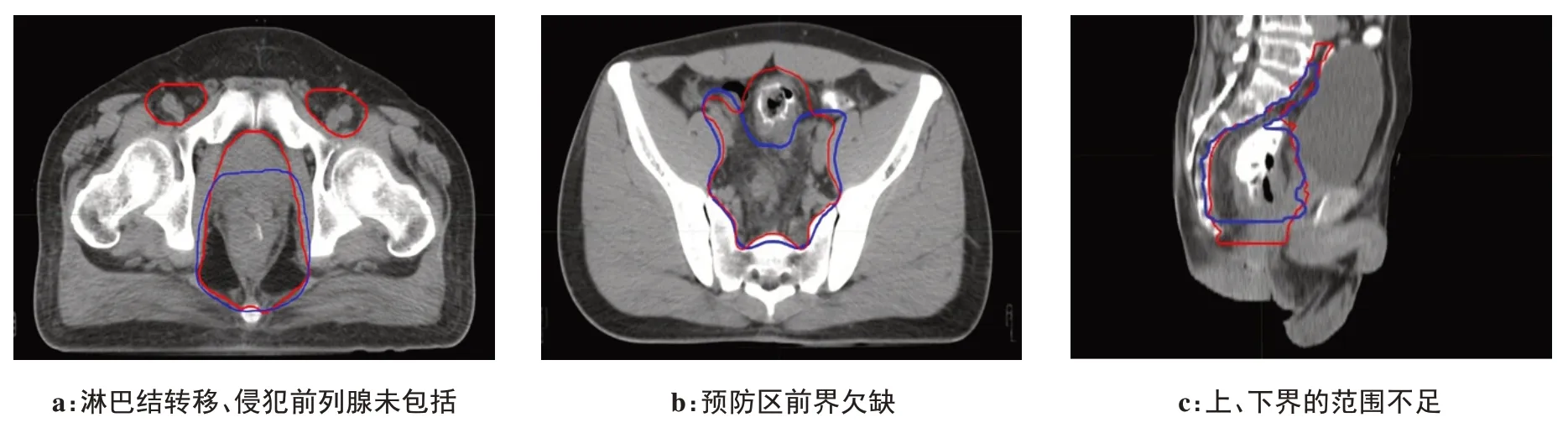
图1 自动勾画与手动勾画CTV 几何轮廓比较Figure 1 Comparison of automatic and manual segmentations of CTV
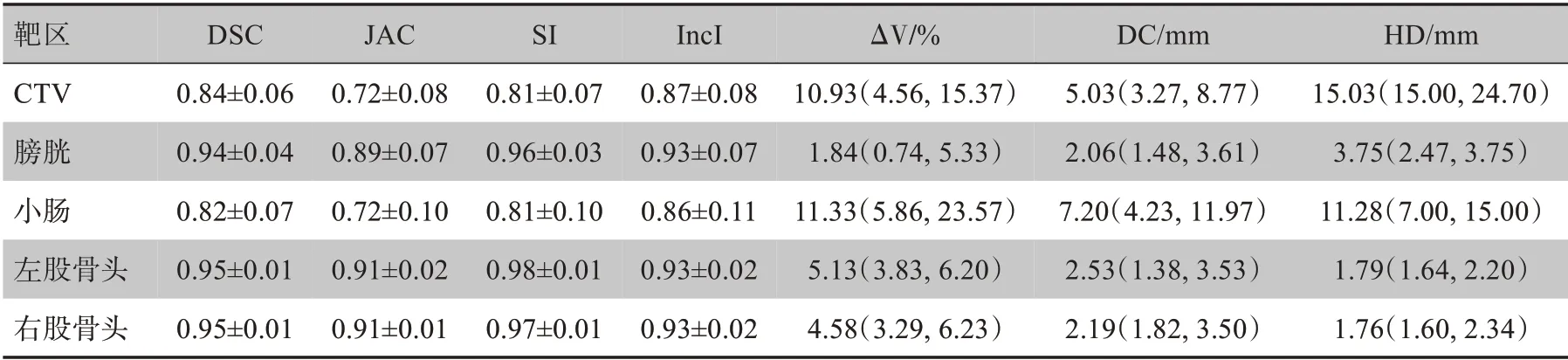
表1 AccuContour 软件自动勾画52例直肠癌术前调强治疗患者CTV、OAR与手工勾画几何轮廓参数比较Table 1 Comparison of manual segmentation results and AccuContour automatic segmentation results of CTV and OAR for preoperative VMAT for 52 cases of rectal cancer
2.2 剂量学参数对比
自动勾画与手工勾画的剂量学参数比较见表2。CTV D95、膀胱V30、小肠Dmean比较差异有统计学意义(P<0.05),其余均无无统计学意义(P>0.05)。
表2 自动勾画与手工勾画的剂量学参数比较(±s)Table 2 Comparison of dosimetric parameters between automatic and manual segmentations(Mean±SD)

表2 自动勾画与手工勾画的剂量学参数比较(±s)Table 2 Comparison of dosimetric parameters between automatic and manual segmentations(Mean±SD)
参数CTV D95/Gy膀胱Dmean/Gy V30/%V40/%小肠Dmean/Gy Dmax/Gy左股骨头Dmean/Gy V40/%右股骨头Dmean/Gy V40/%手动46.89±0.47自动44.67±5.53 t值2.820 P值0.007 32.46±3.64 53.00±8.00 30.00±6.70 32.65±2.02 52.00±8.00 30.00±6.20 0.410 2.670 0.692 0.697 0.012 0.492 25.30±2.63 49.23±0.98 23.71±4.35 49.28±1.11 3.132 0.413 0.003 0.681 23.67±4.57 1.00±0.32 23.56±4.59 1.00±0.26 1.689 0.255 0.094 0.786 24.46±4.68 1.00±0.34 24.57±4.74 1.00±0.33 1.657 0.240 0.104 0.811
3 讨论
近年来,随着人工智能应用于肿瘤放疗,基于图谱、深度学习和神经网络的自动勾画技术在国内外相继开发,其准确度也随之得到重视,并且逐渐成为学者们的研究热点[16-17]。有学者认为影响自动勾画效果不仅包括几何准确性还应包括剂量学的准确性[18]。鲜利勋等[19]对食管癌放疗的剂量学参数研究几何指标评价自动勾画轮廓准确度的可行性研究,提出对于自动勾画系统不仅要评价几何指标还要加入剂量学参数。本研究应用AccuContour 软件及定制化自动勾画模型在直肠癌术前容积旋转调强放疗中CTV 和OAR 的勾画,进行几何轮廓和剂量学参数评价。
有学者认为DSC>0.7,表示自动与手动勾画重合度高[20]。在本研究中,几何轮廓的DSC 值均大于0.8,综合JAC、ΔV%、HD、DC 等各项指标,评估优劣顺序为:右股骨头、左股骨头、膀胱、小肠、CTV。因为股骨头电子密度高,CT 值与周围组织形成较为鲜明的差异[21],所以自动勾画效果好。左、右股骨头的剂量学参数Dmean、V40无统计学差异(P>0.05)。
膀胱在勾画体积上的差异,未影响其剂量学参数Dmean及V40,但在V30上出现差异(P<0.05),研究结果发现膀胱自动勾画结果与其充盈程度有关,充盈越好,膀胱与周围的脂肪组织密度差异越大[22],自动勾画越容易识别,而充盈不足,膀胱顶部容积减小,局部增厚的膀胱壁被肠管阻隔,则自动勾画欠佳(图2膀胱a~d)。
小肠的剂量学参数Dmax比较无统计学差异(P>0.05),而Dmean存在统计学差异(P<0.05),推断是由于自动勾画与人工勾画的小肠体积不同所致,小肠与周围相邻组织密度近似[23],自动勾画对小肠邻近的其它正常组织鉴别差,如男性患者的精索(图2小肠a)、女性患者的附件(图2小肠d)、髂总动脉(图2小肠b)都包含在小肠勾画中,有的在同一层面内勾画范围欠缺(图2小肠c),自动勾画在计划靶区上下3层范围内的小肠包含不完整(图2小肠e)。

图2 自动勾画与手动勾画OAR比较Figure 2 Comparison of automatic and manual segmentations of OAR
在CTV 自动勾画中,未包括腹股沟淋巴结转移、肿瘤侵犯前列腺的部分(图1a);高位直肠癌患者预防区前界勾画范围不足(图1b);CTV 上、下界的勾画范围欠缺(图1c)。分析其原因是由于训练集未根据患者直肠病变位置细化分组,而导致自动勾画对CTV 界定范围不清,始末层识别准确性差,加上CT图像对直肠癌软组织、淋巴结转移、肿瘤侵犯周围的组织识别效果欠佳[24],而导致CTV 自动勾画范围不够,体现在剂量学参数上D95与手动勾画有偏差。
综上所述,研究发现自动勾画的几何精度越高,其剂量学参数越接近于手动勾画,总体上正常组织的勾画要好于肿瘤靶区。因患者肿瘤的部位、生物学行为及定位扫描时膀胱充盈状态、正常组织密度不同等因素影响软件对CT 图像的识别,使得自动勾画的CTV 和OAR 几何轮廓与手动勾画有偏差,从而导致某些部位在相关剂量学参数上产生差异。自动勾画应用于临床时,医生还要依据肿瘤分期不同、大小、位置、周围侵袭范围及淋巴结转移的部位等大量临床资料,采用MR、PET-CT 等多模态影像融合技术,对自动勾画的器官轮廓进行检查手工修改后才能用于计划设计,以确保患者放疗剂量的精准[25]。
本研究存在的局限性:因133 例患者资料随机分为65 例训练集、16 例验证集、52 例测试集,在训练集中,未根据患者直肠病变位置进行高、中、低位再细化分组,采取分别训练,而导致自动勾画对CTV 界定范围不清,始末层识别准确性差,后续将收集更多患者资料,设定肿瘤高位、中位、低位3 个不同训练组,对照相应位置的病例做测试,以提高自动勾画系统准确性。
在直肠癌术前容积旋转调强放疗中,本研究所采用的自动勾画系统,对于CTV 和OAR 的自动勾画有一定准确性,为临床医生节省大量时间,提高了工作效率。
