亚低温治疗重型颅脑损伤的效果及其Calpain基因和蛋白表达研究
2022-07-25马欢王运刚
马欢 王运刚
·临床研究·
亚低温治疗重型颅脑损伤的效果及其Calpain基因和蛋白表达研究
马欢*王运刚
(新乡市中心医院/新乡医学院第四临床学院神经外科,河南 新乡 453000)
研究重型颅脑损伤亚低温治疗效果及其Calpain基因和蛋白表达。回顾性选取2019年1月至2020年12月新乡市中心医院重型颅脑损伤患者80例,依据方法分为常规性治疗基础上亚低温治疗组(亚低温治疗组,n=40)和常规性治疗组(n=40)两组,统计分析两组患者的生命体征、Calpain基因和蛋白表达、临床疗效。亚低温治疗组患者治疗后较治疗前的体温、呼吸频率、脉搏降低幅度均高于常规性治疗组(P<0.05)。亚低温治疗组患者伤后6 h、12 h、1 d、3 d的Calpain基因转录均低于常规性治疗组(P<0.05),Calpain蛋白表达均低于常规性治疗组(P<0.05)。亚低温治疗组患者的恢复良好率高于常规性治疗组(P<0.05),轻度残疾率、中度残疾率、重度残疾率、植物状态率、死亡率均低于常规性治疗组(P<0.05)。重型颅脑损伤亚低温治疗效果良好,能够抑制Calpain基因和蛋白表达。
重型颅脑损伤;亚低温治疗;Calpain
颅脑外伤是指头部受到严重外力作用而导致的意外伤害。重型颅脑损伤易引发中枢性高热,通常采用物理降温和药物降温进行治疗,但治疗效果不理想[1]。国际上分低温为超深度、深度、中度、轻度低温4类,其温度范围分别在12℃~16℃、17℃~27℃、28℃~32℃、33℃~35℃之间[2]。相关研究表明[3],维持体温在亚低温状态(28℃~34℃)能够在极大程度上降低重型颅脑外伤患者的死亡率,同时对重型颅脑损伤患者的神经功能进行改善,促进治疗成效的提升,且不会引发严重并发症。
现阶段,临床广泛应用了亚低温治疗仪,相关医学研究均表明[4],亚低温治疗仪能够以较快的速度对患者的体温进行调节,对患者脑内缺氧缺血状况进行改善。Calpain归属于中枢神经半胱氨酸蛋白酶家族,钙离子在脑缺血、脑外伤等疾病引发的病理生理损伤中激活Calpain后,经蛋白水解机制在神经微丝等一系列底物上作用,从而在继发性脑损伤中参与[5]。
现阶段,还较少有相关医学研究报道颅脑外伤Calpain基因或蛋白表达受到亚低温脑保护干预的影响。本文统计分析了2019年1月至2020年12月新乡市中心医院重型颅脑损伤患者80例的临床资料,研究了重型颅脑损伤亚低温治疗效果及其Calpain基因和蛋白表达。
1 资料与方法
1.1 一般资料
回顾性选取2019年1月至2020年12月新乡市中心医院颅脑外伤患者80例作为研究对象。纳入标准:1)存在明确外伤史并符合颅脑损伤标准; 2)格拉斯哥昏迷评分(GCS)≤8分;3)均具有正常的肝肾功能;4)符合亚低温治疗条件。排除标准:1)有精神疾病;2)有恶性肿瘤;3)有脏器功能障碍。
依据是否经历亚低温治疗分组,其中亚低温治疗组(n=40)和常规性治疗组(n=40)。亚低温治疗组患者中男性31例(77.5%),女性9例(22.5%),年龄31~57岁,平均(43.3±7.5)岁。常规性治疗组患者中男性30例(75.0%),女性10例(25.0%),年龄32~58岁,平均(44.1±7.6)岁。两组患者的一般资料比较差异均不显著(P>0.05),具有可比性。
1.2 方法
1.2.1 常规性治疗组
常规性治疗组采用常规性治疗。用冰袋对患者进行物理降温,同时给予患者肌肉注射25 mg氯丙嗪(规格:25 mg,上海禾丰制药有限公司,国药准字H31022775)+25 mg异丙嗪进行药物降温持续7天。
1.2.2 亚低温治疗组
亚低温治疗组在常规性治疗的基础上同时采用亚低温治疗。采用亚低温治疗仪将降温速度、目标体温、水温分别设定为0.5~1.0℃•h-1、36℃~37℃、25℃~35℃。在达到目标温度后,停机观察12 h,如果患者仍然有发热症状,则继续给予其亚低温治疗。治疗过程中对患者的头顶部、枕部、耳廓进行保护,向患者直肠置入温度探测仪,采用自然升温方法复温,先将治疗仪停用,持续五天。
1.3 观察指标
1.3.1 生命体征
采用中科康馨CCS-103监护仪对两组患者进行心电监护,记录对比两组的基本生命体征。包括体温、呼吸频率、脉搏。
1.3.2 Calpain基因和蛋白表达
伤后6 h、12 h、1 d、3 d分别运用荧光PCR对Calpain基因转录进行定量测定,引物序列为CATTGCCTCGCTCACTCTCA,运用Western blot对Calpain蛋白表达进行定量测定。
1.3.3 治疗效果
分析对比两组的治疗疗效。疗效评定标准[6]为恢复良好:能够自理家庭生活;轻度残疾:部分自理家庭生活;中度残疾:具有清晰的神志,需要卧床休息;重度残疾:无法自理家庭生活;植物状态;死亡。
1.4 统计学分析
2 结果
2.1 亚低温治疗改善基本生命体征
亚低温治疗组患者治疗后较治疗前的体温、呼吸频率、脉搏降低幅度均高于常规性治疗组(P<0.05)。见表1。
2.2 亚低温治疗抑制Calpain基因和蛋白的表达
亚低温治疗组患者伤后6 h、12 h、1 d、3 d的Calpain基因转录均低于常规性治疗组(P<0.05),Calpain蛋白表达均低于常规性治疗组(P<0.05)。见表2。
2.3 亚低温治疗提升临床疗效
亚低温治疗组患者的恢复良好率高于常规性治疗组(P<0.05),轻度残疾率、中度残疾率、重度残疾率、植物状态率、死亡率均低于常规性治疗组(P<0.05)。见表3。
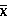
表1 两组患者治疗前后的生命体征比较(±SD,n=40)
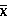
表2 两组患者伤后6h、12h、1d、3d的Calpain基因表达比较(±SD,n=40)
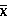
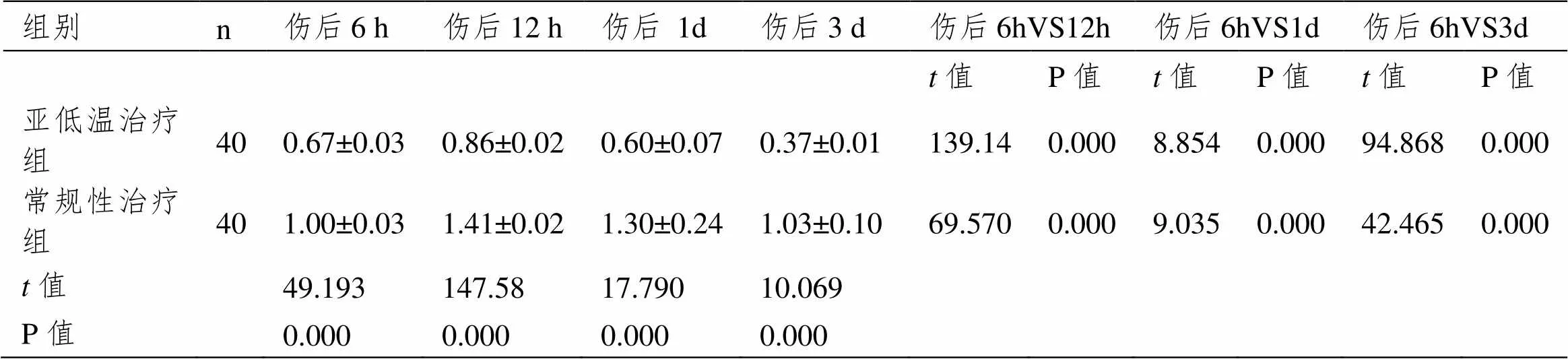
组别n伤后6 h伤后12 h伤后1d伤后3 d伤后6hVS12h伤后6hVS1d伤后6hVS3d t值P值t值P值t值P值 亚低温治疗组400.67±0.030.86±0.020.60±0.070.37±0.01139.140.0008.8540.00094.8680.000 常规性治疗组401.00±0.031.41±0.021.30±0.241.03±0.1069.5700.0009.0350.00042.4650.000 t值 49.193147.5817.79010.069 P值 0.0000.0000.0000.000
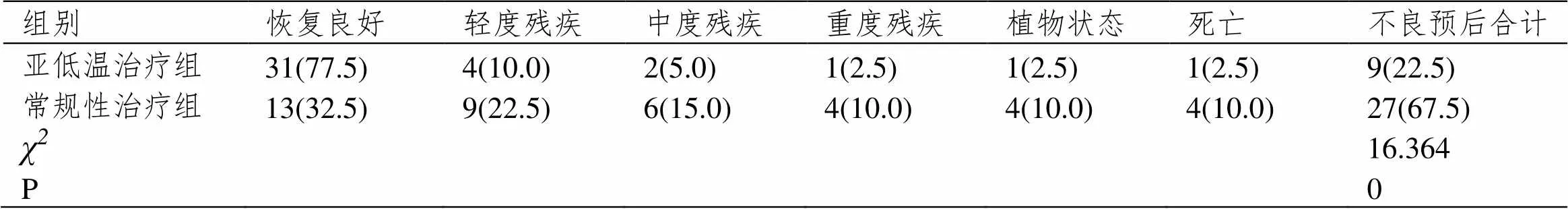
表3 两组患者的临床疗效比较[例(%),n=40]
3 讨论
亚低温治疗仪的组成成分为带冷水回路的降温毯、降温帽、温度传感器、主机,现阶段在临床相关治疗中已经得到了广泛应用。相关医学研究表明[7],在重型颅脑损伤的治疗中,亚低温治疗能够将良好的成效获取过来,在极大程度上促进患者预后成效的提升,治疗效果较高,同时具有较高的可靠性与安全性。本研究结果表明,亚低温治疗组患者治疗后较治疗前的体温、呼吸频率、脉搏降低幅度均高于常规性治疗组。亚低温治疗组患者的恢复良好率高于常规性治疗组,轻度残疾率、中度残疾率、重度残疾率、植物状态率、死亡率均低于常规性治疗组,和上述研究结果一致。发生这一现象的原因为亚低温治疗仪治疗重型颅脑损伤中枢性高热患者能够有效改善患者脑内缺氧缺血现象,同时还能够有效降低患者脑细胞代谢问题,对患者脑水肿进行有效缓解,因此具有明显的效果[8]。
虽然导致 TBI 的确切物理机制仍存在争议,但应变引起的神经元件剪切和拉伸被认为是病理学的主要因素。然而,损伤应变阈值以及可识别病理的最早机制仍不清楚。树突棘是沿着树突发生神经元之间通信的部位。这些棘的形态是动态的,根据环境和发生的信号,在粗短、细长、丝状伪足和蘑菇状之间不断变化。已显示树突棘会对撞击发生后发生的兴奋性毒性条件作出反应,并转变为兴奋性蘑菇表型。释放到突触间隙中的谷氨酸与NMDA和AMPA受体结合,导致Ca2+进入导致兴奋毒性级联,激活Calpain。
本研究结果表明,亚低温治疗组患者伤后6 h、12 h、1 d、3 d的Calpain基因转录均低于常规性治疗组,Calpain蛋白表达均低于常规性治疗组,说明Calpain蛋白表达受到亚低温的影响在转录后的层面发生,亚低温治疗能够在极大程度上对Calpain蛋白表达进行抑制,发生这一现象的原因可能为亚低温治疗能够增加某种降解Calpain蛋白酶的活性或表达,从而减少Calpain分子。同时,亚低温治疗能够在极大程度上抑制Calpain合成的某一环节,造成其能够成比例合成自身核糖体RNA数量。此外,亚低温治疗还可能通过某种内源性途径,在自身基因上负反馈,增加其转录,从而抑制Calpain蛋白水平[9]。从这里我们可以看出,亚低温治疗的脑保护机制可能为对细胞中Calpain蛋白水解作用进行抑制,途径为对Calpain蛋白表达进行抑制[10]。
综上所述,重型颅脑损伤亚低温治疗效果良好,能够改善患者的基本生命体征,抑制Calpain基因和蛋白表达,值得推广。
1 D. James Cooper, Alistair D. Nichol, Michael Bailey, et al. Effect of Early Sustained Prophylactic Hypothermia on Neurologic Outcomes Among Patients With Severe Traumatic Brain Injury: The POLAR Randomized Clinical Trial[J]. JAMA. 2018; 320(21): 2211–2220.
2 Enping Meng, Yi Duan, Xinjun Wang. Therapeutic mechanism of intracranial infection in patients with hydrocephalus after craniocerebral injury based on decompressive craniectomy[J]. Saudi J Biol Sci. 2020; 27(3): 873–880.
3 袁烁. 亚低温治疗重度颅脑损伤术后患者的临床疗效分析[J]. 中国临床医生杂志. 2019, 47(12): 1466-1468.
4 Chuan‐Fang Wang, Cheng‐Cheng Zhao, Yi He, et al. Mild hypothermia reduces endoplasmic reticulum stress‐induced apoptosis and improves neuronal functions after severe traumatic brain injury[J]. Brain Behav. 2019; 9(4): 1248.
5 W. Dalton Dietrich, Helen M. Bramlett. Therapeutic Hypothermia and Targeted Temperature Management in Traumatic Brain Injury: Clinical Challenges for Successful Translation[J]. Brain Res. 2016; 1640(Pt A): 94–103.
6 Eko PRASETYO, Andi ASADUL ISLAM, Mochammad HATTA, et al. The Profile of MMP-9, MMP-9 mRNA Expression, -1562 C/T Polymorphism and Outcome in High-risk Traumatic Brain Injury: The Effect of Therapeutic Mild Hypothermia[J]. Neurol Med Chir (Tokyo) 2017; 57(11): 612–619.
7 Yue Tu, Xiao-mei Miao, Tai-long Yi, et al. Neuroprotective effects of bloodletting at Jing points combined with mild induced hypothermia in acute severe traumatic brain injury[J]. Neural Regen Res. 2016; 11(6): 931–936.
8 冯良应,钟元冠,林宗保. 探讨不同复温速度对重症颅脑外伤患者亚低温治疗愈后的研究[J]. 中国医学创新, 2021, 18(11): 105-109.
9 Jun-Hui Chen, Yi-Nong Xu, Meng Ji, et al. Multimodal monitoring combined with hypothermia for the management of severe traumatic brain injury: A case report[J]. Exp Ther Med. 2018; 15(5): 4253–4258.
10 王松凡, 阎婷婷, 范波. 长短期亚低温治疗重型颅脑损伤的疗效评价[J]. 医学研究杂志. 2019, 48(08): 166-170.
(2022-4-28)
马欢,男,主治医师,主要从事颅脑外伤诊治,Email:dongbi753775@163.com。
