银胶菊内酯调控JAK/STAT信号通路对LPS诱导的肺泡上皮细胞损伤的影响
2022-07-25李海峰林一春陈岸东林姝君冯永锋
李海峰 林一春 陈岸东 林姝君 冯永锋
(1海南省临高县中医院内科,海南 临高 571800;2海口市中医院急诊科)
银胶菊内酯(PTN)是从菊科植物中分离出来的一种倍半萜类化合物,是一种很有发展前途的天然化合物,随着研究的深入,目前已发现了该化合物有较好的抗炎作用,还可诱导肿瘤细胞凋亡,将在治疗各种炎症、肿瘤等疾病方面发挥作用。肺泡上皮细胞具有屏障保护功能,肺组织损伤发生时,参与肺组织修复过程,该细胞凋亡是引发肺炎的重要原因之一〔1〕。既往研究表明,PTN常被作为一种治疗炎症性疾病的药物〔2〕。本研究采用LPS诱导肺泡上皮细胞建立炎症模型,探讨PTN通过调控Janus激酶(JAK)/信号转导转录激活因子(STAT)信号通路对LPS诱导肺泡上皮细胞损伤的影响。
1 材料与方法
1.1材料 BEAS-2B细胞(购于上海酶研生物科技有限公司,货号:Y-00805);试剂:脂多糖(LPS 上海恒斐生物科技有限公司,货号:L8880);DMEM培养基(北京伊塔生物科技有限公司,货号:YT8229);胎牛血清(FBS 上海爱必信生物科技有限公司,货号:abs9*);CCK-8试剂盒(上海弗元生物科技有限公司,货号:FY600001);磷酸盐缓冲溶液(PBS 北京伊塔生物科技有限公司,货号:SY0950);白细胞介素(IL)-6酶联免疫吸附试验(ELISA)试剂盒(北京索莱宝科技有限公司,货号:SEKH-0013);IL-10 ELISA试剂盒(北京索莱宝科技有限公司,货号:SEKR-0006)Annexin V-FITC/PI 双染细胞凋亡检测试剂盒(上海弗元生物科技有限公司,货号FY600003-20T);Bcl-2多克隆抗、酶切Caspase-3多克隆抗体、Bax多克隆抗体(武汉亚科因生物技术有限公司,货号:ABP57867/ABP0021/ABM0074);p-JAK1多克隆抗体、p-JAK2多克隆抗体、p-STAT1多克隆抗体、p-STAT3多克隆抗体(武汉亚科因生物技术有限公司,货号:ABP57569/ABP0190);电化学发光(ECL)显色剂(北京伊塔生物科技有限公司,货号:SY4918)。
1.2实验分组 采用含10% FBS的DMEM培养基常规培养BEAS-2B细胞,进行传代培养。取对数期细胞接种到6孔板,进行实验分组。对照组:除正常培养外,不做其他处理的BEAS-2B细胞;LPS组:采用终浓度为1 μg/ml的LPS处理正常培养的BEAS-2B细胞24 h;PTN低剂量组、PTN中剂量组、PTN高剂量组:分别采用终浓度为1、5、10 μmol/L PTN处理2 h后,给予1 μg/ml LPS刺激24 h。
1.3CCK-8法检测细胞存活率 使用 CCK-8法分析各组BEAS-2B细胞存活率。将各组BEAS-2B细胞接种在96孔板中,每组 6个平行,每个孔加入 100 μl PBS洗涤细胞并重复3次,加入 10 μl CCK-8检测溶液到每个孔中,继续孵育2 h。酶标仪设置 490 nm,测量每个孔的吸光度来计算细胞存活率〔3〕。
1.4流式细胞仪检测细胞凋亡 各组细胞培养在6孔板内,至长满孔底部面积80%后,吸出多余培养液,PBS洗涤细胞3次。加入1 ml胰酶消化液消化,几分钟后吸出消化液,加入细胞培养液轻轻吹打细胞,将混合液转移到离心管内,离心后弃去上清,收集细胞。加入PBS重悬细胞,取一定数量细胞转移至离心管,离心后弃去上清,按照试剂盒说明书分别加入5 μl Annexin V-FITC和5 μl PI,室温条件避光孵育15 min,随后使用流式细胞仪检测细胞凋亡情况〔4〕。
1.5Western印迹检测细胞凋亡相关蛋白表达 从培养皿中吸去培养基,使用PBS冲洗细胞,加入RIPA细胞裂解液0.2 ml,置冰上裂解30 min,收集上清液,即为细胞总蛋白。将收集的蛋白样品100℃沸水加热 10 min,使蛋白充分变性,等样品冷却至常温,在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中分离。电泳结束后进行转膜,转膜装置从下至上排列,依次按阴极板、3层滤纸、凝胶、聚偏氟乙烯(PVDF)膜、3 层滤纸、阳极板的顺序放好。滤纸、凝胶、PVDF膜精确对齐,且每一层的气泡都要排尽。接通电源,转膜2 h。将转膜完毕的PVDF膜取出,浸泡于5%脱脂奶粉配制的封闭液中,37℃封闭1 h后洗膜,加入适宜浓度的Bcl-2、酶切Caspase-3、Bax、p-JAK1、p-JAK2、p-STAT1、p-STAT3多克隆抗体,清洗后加入二抗,封闭液中浸泡 2 h。参考相关说明书,使用 ECL 超敏发光试剂盒检测蛋白水平〔5〕。
1.6ELISA试剂盒检测炎症因子含量 取细胞培养上清液500 μl,离心5~10 min,取上清。利用 ELISA试剂盒检测细胞中IL-6、IL-10水平,使用前将所有试剂充分混匀,在测试孔中,加入待测标本和不同浓度的标准品,每个样品做两组平行实验。随后立即加入50 μl生物素标记的抗体,盖上膜板,轻轻振荡混匀,37℃孵育1 h,之后甩去孔内液体,每孔加满洗涤液,振荡30 s,甩去洗涤液,用吸水纸拍干,重复此操作4次。每孔加入底物50 μl,轻轻震荡,37℃孵育15 min后,加入终止液,轻摇酶标板使之混匀,用酶标仪在450 nm波长下测得吸光度〔6〕。
1.7统计学分析 采用SPSS26.0软件进行单因素方差分析、LSD-t检验。
2 结果
2.1各组细胞存活率比较 LPS组〔(35.38±4.60)%〕细胞存活率显著低于对照组〔(100.00±0.76)%〕,说明构建细胞炎症模型成功;PTN低、中、高剂量组〔(41.68±1.14)%、(59.56±4.13)%、(75.03±6.66)%〕显著低于LPS组(P<0.05)。
2.2各组细胞凋亡率比较 流式细胞术结果发现,对照组、LPS组、PTN低、中、高剂量组细胞凋亡率分别为(4.11±0.59)%、(21.20±1.36)%、(16.07±1.26)%、(11.38±1.22)%、(7.31±1.03)%。LPS组与对照组差异显著(P<0.05);PTN低、中、高剂量组分别与LPS组差异显著(P<0.05)。见图1。
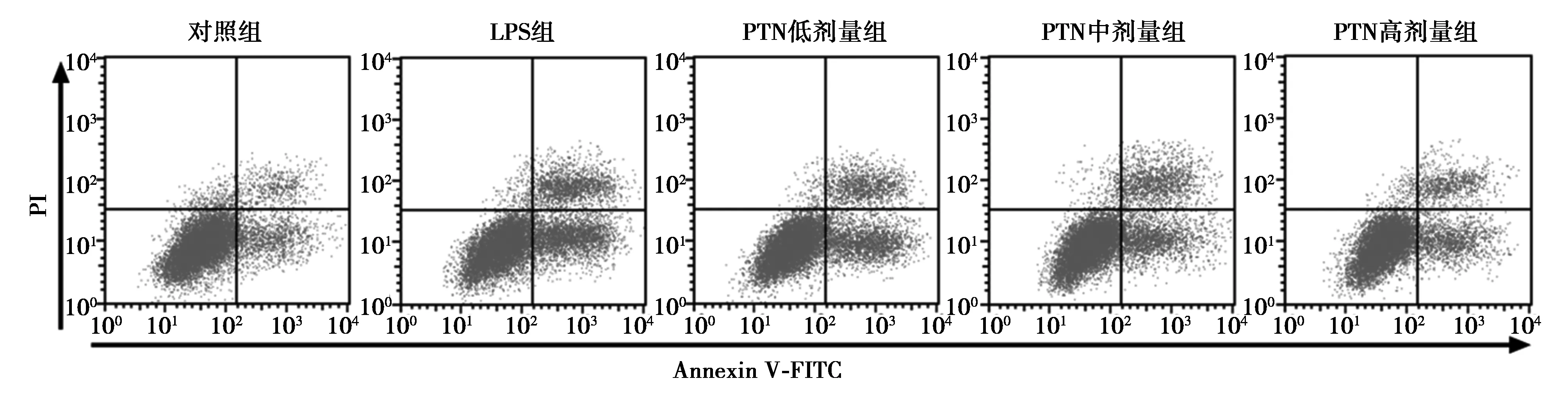
图1 各组细胞凋亡率的比较
2.3各组凋亡相关蛋白表达比较 LPS组Bcl-2蛋白水平显著低于对照组,酶切Caspase-3和Bax蛋白表达量显著高于对照组(P<0.05)。PTN 低、中、高剂量组Bcl-2蛋白水平显著高于LPS组,酶切Caspase-3和Bax蛋白表达量显著低于LPS组(P<0.05),见图2,表1。
2.4各组IL-6、IL-10水平比较 LPS组与对照组相比,IL-6含量升高,IL-10含量降低,差异有统计学意义(P<0.05); PTN低、中、高剂量组与LPS组相比,IL-6含量降低,IL-10含量升高,差异显著(P<0.05),见表2。
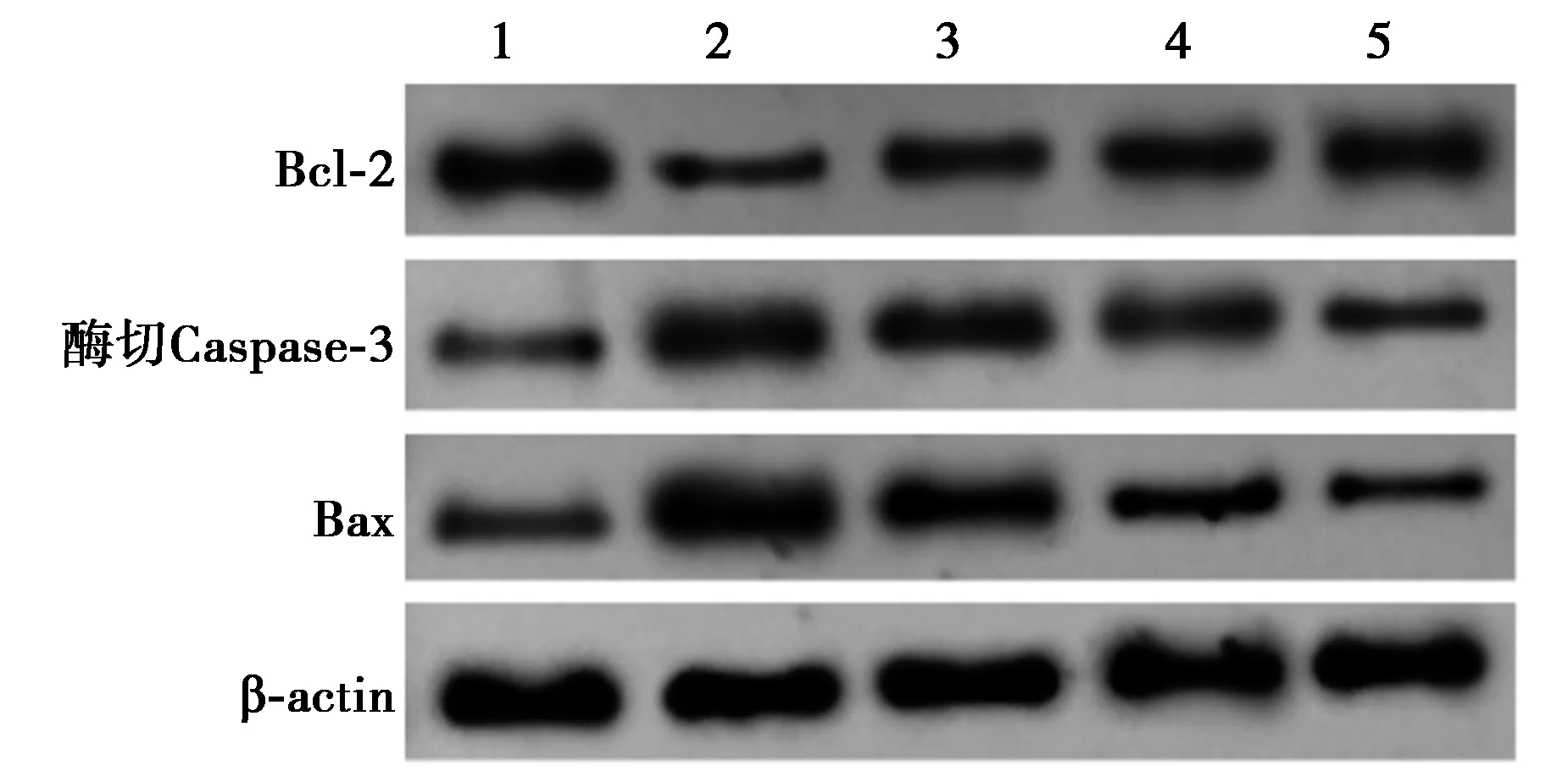
1~5:对照组,LPS组,PTN低剂量组,PTN中剂量组,PTN高剂量组;下图同图2 各组细胞凋亡相关蛋白表达的比较
表1 各组细胞凋亡相关蛋白表达的比较
表2 各组细胞中炎症因子含量比较
2.5各组JAK/STAT信号通路相关蛋白表达比较 LPS组与对照组相比,JAK/STAT信号通路相关蛋白表达均显著升高(P<0.05);LPS组较PTN低、中、高剂量组显著降低(P<0.05),见图3,表3。
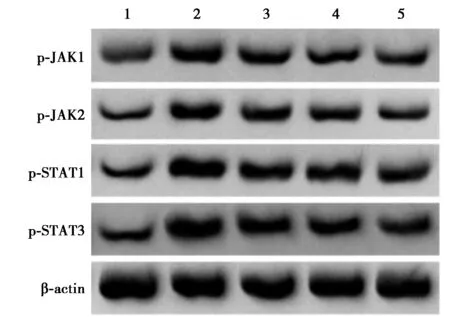
图3 各组细胞中JAK/STAT信号通路相关蛋白表达比较
表3 各组细胞中JAK/STAT信号通路相关蛋白表达比较
3 讨 论
JAK/STAT信号通路是一类重要的细胞内信号转导通路家族〔7〕,此信号通路的激活与抑制炎症反应、氧化应激、细胞损伤、凋亡等有密切相关性〔8〕。有研究表明〔9〕,抑制JAK2/STAT3通路激活,可延迟肝脏、肺内高迁移率族蛋白-1的释放高峰,缓解肺泡上皮细胞损伤引起的致死性损伤,为早期诊疗提供广阔的时间窗,与本研究结果相符 。
IL-6是炎症形成的介质,是重要的非特异性炎性因子,参与全身炎症反应。IL-10是一种有效的抗炎性因子,通过阻断促炎性细胞因子、炎性趋化因子等发挥抗炎作用〔10〕。IL-10在防止宿主的损伤和维持组织内环境稳定方面起重要作用〔11〕。刘早阳等〔12〕研究结果说明IL-6作为一种促炎因子,其水平升高可促进肺损伤,而高水平IL-10 可减轻肺损伤。本研究结果提示炎症反应得到缓解,说明PTN可抑制LPS诱导的炎症反应。细胞凋亡由多种凋亡基因调控,其中促细胞凋亡蛋白Bax、Caspase-3和抗细胞凋亡基因 Bcl-2 是调控细胞凋亡的重要因子,在细胞凋亡的执行过程中具有关键作用〔13〕,Bax 和Bcl-2的比例决定了细胞是否凋亡〔14〕。免疫印迹结果说明PTN可抑制LPS诱导后的BEAS-2B细胞凋亡。
综上,PTN可通过调控JAK/STAT信号通路,提高LPS诱导后肺泡上皮细胞的存活率,抑制细胞凋亡,减轻炎症反应。
