体外膜肺氧合技术在持续肺动脉高压新生儿救治中的临床应用
2022-07-25陈玉兰杨秀芳陈简施尚文朱侨伟廖小卒张明光
陈玉兰 杨秀芳 陈简 施尚文 朱侨伟 廖小卒 张明光
(广东省中山市人民医院 1.新生儿科;2.体外膜肺氧合技术小组;3.血管外科,广东中山 528400)
体外膜肺氧合技术(extracorporeal membrane oxygenation,ECMO)起源于19世纪50年代[1],是一种中短期替代危重患者心肺功能的体外生命支持技术[2],能明显提高生存率。Bartlett 等[3]于1977年首次为1例胎粪吸入综合征合并重症肺炎和新生儿持续肺动脉高压(persistent pulmonary hypertension of the newborn,PPHN)的新生儿成功进行ECMO 治疗。根据Extracorporeal Life Support Organization(ELSO)2021 年数据显示[4],新生儿呼吸系统疾病ECMO 支持治疗的存活率可达73%,新生儿心脏疾病存活率为44%。我国新生儿开展ECMO治疗起步较晚,近几年随着ECMO技术不断成熟与在新生儿重症监护室的广泛推广,该技术应用于新生儿疾病的例数有所增多,但总量仍不多。结合新生儿的特殊性,ECMO治疗存在多种并发症风险,应用时尤需特殊关注。因此患儿的选择、ECMO 启动时机、建立有效的血管通路、ECMO的有效管理及并发症的防治是应用ECMO技术救治危重新生儿成败的关键。本文就近7 年ECMO 技术在我院患有PPHN 的新生儿中的临床应用进行回顾分析,总结临床应用经验,为进一步提高ECMO技术应用于危重症新生儿提供参考。
1 资料与方法
1.1 研究对象
回顾性选取2015 年1 月至2021 年12 月在广东省中山市人民医院新生儿科收治的接受了ECMO治疗的11 例新生儿为研究对象,其中男7 例,女4例,年龄≤3 d,平均年龄(32±27)h,出生体重2.13~3.58 kg。有3例为早产儿,其余为足月儿。病种分布为:胎粪吸入综合征6例,新生儿呼吸窘迫综合征4 例,肺泡毛细血管发育不良(alveolar capillary dysplasia,ACD)1 例。11 例患儿均在生后出现不同程度的肺动脉高压,并引起心房和/或动脉导管水平血液的右向左分流,出现严重低氧血症,诊断PPHN。PPHN 指患儿生后肺血管助力持续性增高,引起的心房和/或动脉导管水平血液的右向左分流,出现严重的低氧血症等症状[5]。采集患儿ECMO 治疗前后的氧合指数(oxygenation index,OI)、乳酸(lactic acid,Lac)、肺动脉压及ECMO 治疗后的并发症等资料。OI=[平均气道压(mm Hg)×吸入氧浓度(%)×100]/动脉氧分压(mm Hg)(导管后)[5]。11 例患儿均有不同程度的高Lac血症,均已行血及尿串联质谱检查,均未见异常,结合患儿ECMO技术支持后血Lac水平有下降,考虑为患儿在ECMO 技术支持前出现缺氧所致。患儿监护人均已签署书面知情同意使用ECMO。患儿的基本资料见表1。
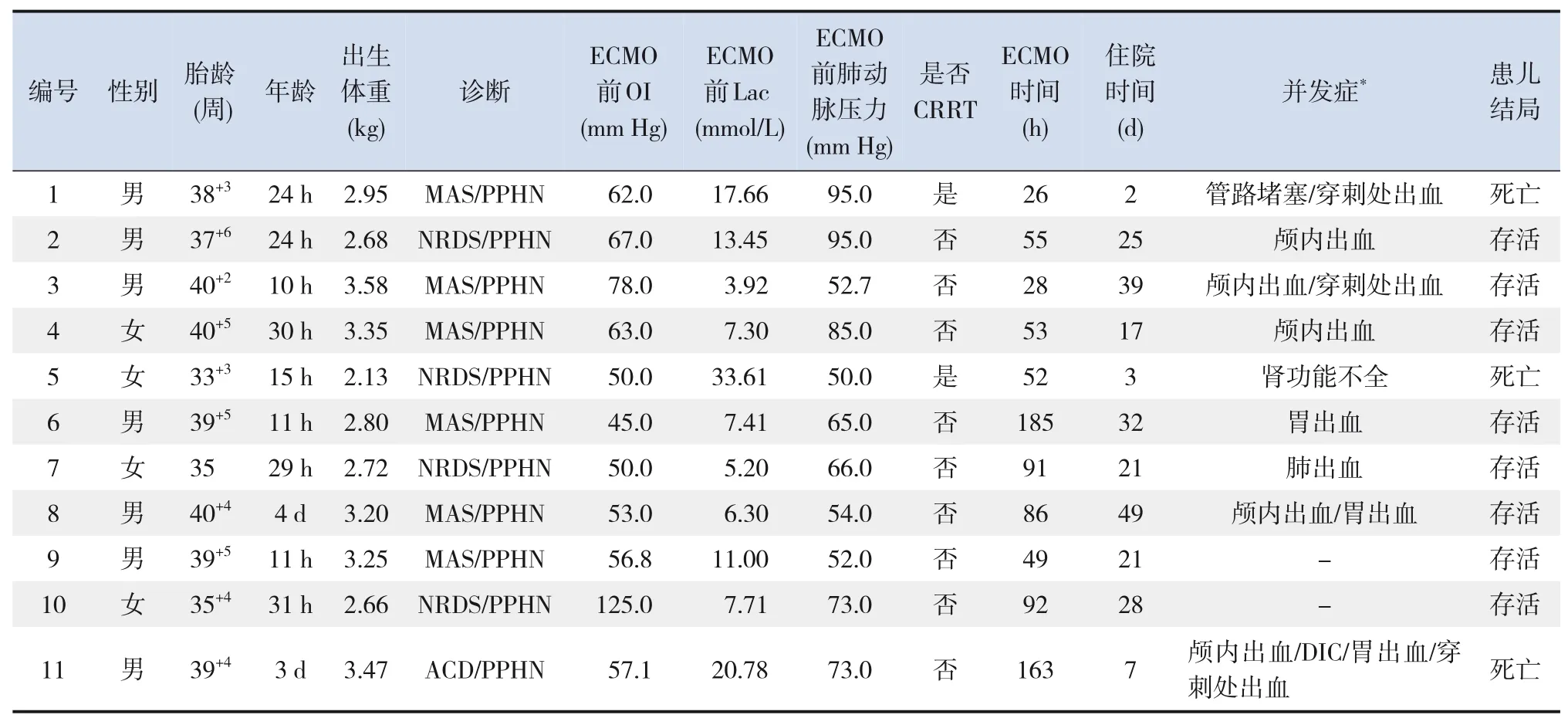
表1 11例ECMO患儿基本资料
1.2 ECMO的适应证及禁忌证
根据我国《新生儿呼吸衰竭体外膜肺氧合支持专家共识》、ELSO 最新发布的新生儿呼吸衰竭及儿童心脏衰竭指南[6-8],我院选择应用ECMO 的适应证为:(1) 导致心肺衰竭的病因可逆;(2)肺动脉高压导致右心室功能障碍,需正性肌力药物评分>40 分;(3)呼吸衰竭患儿:OI>40 超过40 h;OI>20 超过20 h,且呼吸困难持续恶化;严重低氧血症(PaO2<40 mm Hg,经积极呼吸支持,病情仍继续恶化);血pH<7.15,血Lac 水平≥5 mmol/L,无尿持续12~24 h。禁忌证[6]:(1)已发现致死性的出生缺陷;(2)Ⅲ级或Ⅲ级以上脑室内出血;(3)不可逆的脑损害;(4)难控制的出血。
1.3 ECMO设备
ECMO 由Medtronic 离心泵、氧合器、肝素涂层ECMO套装、动静脉插管、变温系统及活化凝血时间(activated clotting time,ACT) 检测仪等组成。若患儿在ECMO治疗同时肺动脉压力持续居高不下,给予一氧化氮气体流量控制仪治疗。若患儿在ECMO 治疗同时出现无尿、肌酐和尿素氮>2倍正常值或难救治的高钾等情况,在ECMO循环管道中接连续肾脏替代治疗(continuous renal replacement therapy,CRRT)系统。
1.4 患儿管理
1.4.1 ECMO 前检查 患儿ECMO 前行血常规、凝血功能、肝肾功能、电解质、血气分析、颅脑B超、心脏彩超、胸部X线检查,并提前抽1管血备用(为基因检测备用)。
1.4.2 通路建立及管路预充 11 例患儿均应用静脉-动脉通路进行ECMO 治疗,其中1 例建立股动静脉的血管通路,另10例均建立右侧颈总动脉-右侧颈内静脉的血管通路。插管型号动脉选择8~10 F,静脉选择10~12 F。采用0.9%氯化钠溶液预充管路排气,然后用1单位悬浮红细胞(加入肝素1 mg/单位红细胞)排出管路晶体液,加入5%碳酸氢钠5 mL,最后加入10%葡萄糖酸钙3 mL。
1.4.3 抗凝管理 插管前给予肝素0.5~1 mg/kg抗凝,5 min 后查ACT 在220~250 s 之间即可插管。在ECMO治疗期间持续泵入肝素5~50 U/(kg·h),每2 h 监测ACT,每4 h 监测血小板计数、凝血功能(凝血酶原时间、部分凝血活酶时间、纤维蛋白原、D‐二聚体),维持ACT在160~220 s,纤维蛋白原>1.5 g/L,活化部分凝血活酶时间在50~80 s,血小板计数>50×109/L。每4 h 检查ECMO 管路有无血栓。
1.4.4 循环管理 持续监测患儿动脉压,使其维持在40~65 mm Hg。由于大多数ECMO治疗患儿容易出现液体超载,应根据患儿出量选择入量,必要时可使用利尿剂或CRRT。
1.4.5 呼吸机管理 ECMO治疗期间,为使患儿肺部得到休息,选择低机械通气参数,压力控制+同步间歇指令通气模式:吸入氧浓度21%~30%,气道峰压<20 cm H2O,吸气末正压5~10 cm H2O,呼吸频率20~25 次/min,吸气时间0.4~0.5 s,潮气量4~6 mL/kg。
1.4.6 ECMO流量及气体管理 ECMO流量设定在100~150 mL/(kg·min),根据血流动力学监测情况、导管后血气分析、血Lac 水平、血氧饱和度、尿量等调整ECMO流量、氧流量及氧浓度。
1.4.7 ECMO治疗期间的其他管理 ECMO治疗期间患儿需镇静、镇痛。期间患儿肺动脉压力持续居高不下,可应用降低肺动脉压的药物和吸入一氧化氮治疗。若患儿出现液体超载、肾功能衰竭等情况,在循环稳定的情况下给予利尿、CRRT。在整个操作过程中需注意无菌原则,预防发生院内感染。由于此类患儿通常病情极危重,ECMO治疗前胃肠道已存在缺血缺氧,因此肠内营养需根据患儿病情而定。由于在ECMO治疗期间一直抗凝治疗,患儿比较容易出现各脏器出血,期间密切观察患儿病情、定期监测各项凝血功能指标,每日行颅脑B 超观察是否有脑室内出血及脑梗死。
1.4.8 ECMO 撤离 每日监测患儿胸片、心脏彩超、颅脑B超,评估患儿心肺脑情况。患儿症状改善,胸片提示透亮度下降,心脏彩超提示肺动脉压下降,可逐渐下调ECMO参数,同时上调呼吸机参数,ECMO 流量以每小时20 mL 逐渐下调,当流量下降至50 mL/min,呼吸机通气调整至完全支持状态,即可考虑夹管撤离ECMO。
1.5 统计学分析
采用SPSS 21.0 软件对数据进行统计学分析,正态分布的计量资料采用均数±标准差(±s)表示,两组间比较采用两样本t检验;非正态分布的计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用Mann‐WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
11例合并PPHN患儿在应用ECMO技术支持前均行机械通气呼吸支持、维持体循环压力、西地那非、前列地尔等治疗;由于条件所限,仅1 例ACD 患儿应用吸入一氧化氮治疗。11 例患儿中有10 例撤机成功,撤机成功率91%(10/11);存活8例,死亡3例(1例因ECMO堵管,2例因发生并发症后,监护人放弃治疗),存活率73%(8/11)。11例患儿ECMO 治疗时间26~185 h,平均治疗时间(81±50)h;呼吸机治疗时间57~392 h,平均治疗时间(198±105)h;住院时间2~49 d,平均住院时间(22±15)d。
2.2 ECMO治疗前后临床指标比较
11例患儿ECMO治疗24 h后OI值、血Lac水平较ECMO 治疗前均显著改善(P<0.05);其中10 例患儿ECMO治疗24 h后肺动脉压力较ECMO治疗前均显著下降(P<0.05),1例患儿在EMCO治疗期间肺动脉压力呈进行性升高,监护人签字放弃治疗后死亡,最后确诊为ACD。见表2。
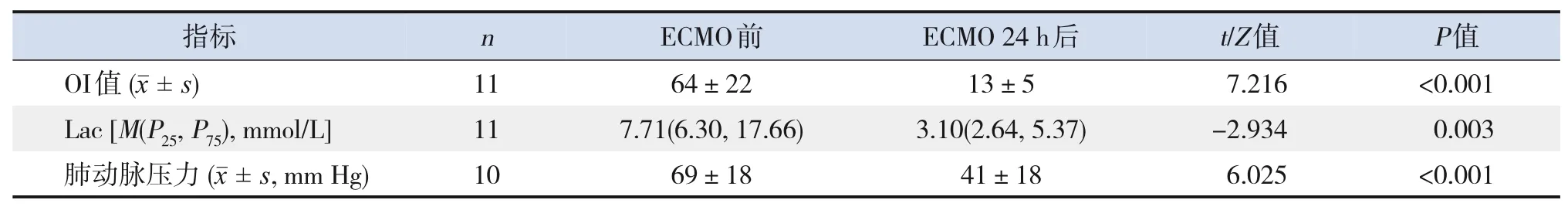
表2 ECMO治疗前后临床指标比较
2.3 并发症
1例患儿在ECMO 治疗期间出现管路堵塞,建议重新置管,但患儿监护人签字拒绝,紧急撤离ECMO后,患儿出现严重低氧血症,经积极抢救无效死亡。11例患儿均出现血小板减少症,有5例发生颅内出血,其中3例为Ⅰ级(脑室管膜下出血),1例为Ⅱ级(无脑室扩张脑室内出血),1例为Ⅳ级(脑室内及脑实质出血);出现弥散性血管内凝血(disseminated intravascular coagulation,DIC)1 例,胃出血1 例,肺出血2 例,肾功能不全1 例,穿刺处出血3例。其中有1例患儿因在外院出现低氧血症时间超过24 h,且有心脏骤停1 次,缺氧时间长,我院ECMO团队紧急到当地医院给予ECMO支持后转运至我院,出现胃出血、DIC,48 h 后出现Ⅳ级颅内出血,患儿虽然OI 值、血Lac 水平有下降,但肺动脉压力呈进行性升高,考虑到患儿在EMCO支持期间出现Ⅲ级以上颅内出血及难控制的出血,是EMCO支持的禁忌证,经ECMO支持治疗163 h后,建议监护人放弃ECMO支持,最终死亡。尸检肺组织病理提示肺泡扩张欠佳,肺泡间隔增宽,小的薄壁血管增生伴不规则扩张,符合ACD(图1);全外显子测序显示chr16:86544330 染色体上FOXF1基因存在变异,为NM_001451.3:c.155C>A(p.Ser52Tyr)新变异,父母亲均为野生型(图2)。该变异目前未见文献及大规模人群变异频率数据库(如Genome Aggregation Database)报道。有文献报道与该变异同一密码子的其他变异在ACD 患者中检出,并且为新变异[9];相关的动物实验证明其能够影响蛋白功能[10]。结合该患儿临床表现、尸检肺组织病理结果及全外显子测序结果,该患儿确诊为ACD。
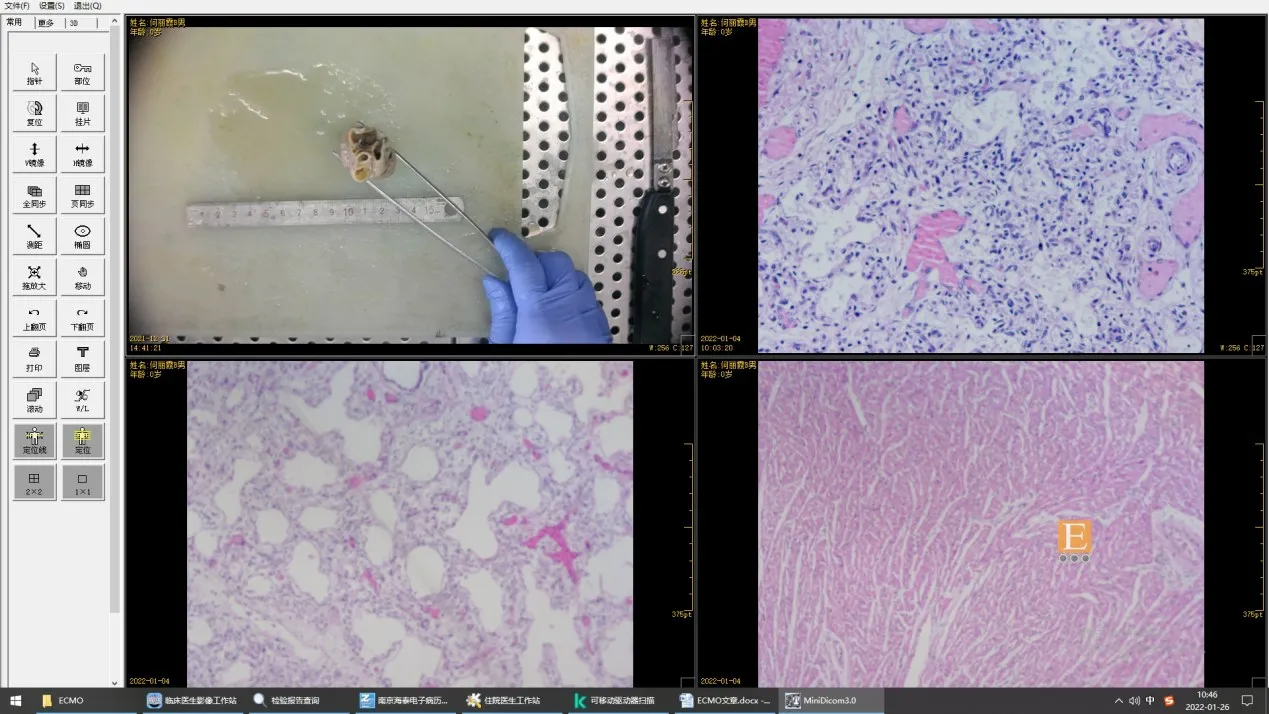
图1 第11 例患儿肺组织病理结果(苏木精-伊红染色,×200) 肺泡扩张欠佳,肺泡间隔增宽,小的薄壁血管增生伴不规则扩张。
3 讨论
ECMO技术应用的目的是保障机体循环和气体交换,为衰竭的心脏和/或肺脏的恢复、心肺移植及供体捐献赢得时间[11]。国外ECMO 技术主要应用于呼吸病例,尤其是新生儿呼吸衰竭病例[12]。然而我国新生儿开展ECMO治疗起步较晚,新生儿病例的数量及ECMO管理技术,均落后于国外先进中心。2008 年,我国才有报道ECMO 技术应用于儿科领域,在新生儿中的应用甚少[13]。
PPHN是指生后肺血管阻力持续性增高,并引起心房和/或动脉导管水平血液的右向左分流,出现严重低氧血症,病死率相对较高。PPHN的常规治疗包括机械通气呼吸支持、维持正常体循环压力、给予血管扩张剂等,而对于严重的PPHN,在常规治疗后病情仍不改善,且符合ECMO应用适应证的患儿,可接受EMCO支持[14]。
国外有学者研究[15]显示行ECMO 支持治疗的1 569 例PPHN 患儿存活率为81%,发现其存活率与接受ECMO 支持治疗的时间长短有关,7 d 能撤机的患儿存活率达88%,ECMO治疗时间越长其存活率越低,主要与支气管肺发育不良的发生相关。本研究患儿存活率为73%,较国外学者报道[15]存活率稍低,可能与本研究样本量少及我院ECMO技术早期应用于新生儿治疗期间管理欠成熟有关。其中有1例患儿在接受ECMO支持治疗8 d后撤机,其余10 例患儿均在接受ECMO 支持治疗7 d 内撤机。ECMO支持治疗后的临床指标较治疗前有明显改善。
本研究中有1例患儿在接受ECMO支持治疗期间肺动脉压力呈进行性升高,无法撤机,最后监护人签字放弃,结合全外显子测序结果及尸检肺组织病理结果,确诊为ACD。ACD 呈常染色体显性遗传,是一种严重的发育性肺病,肺泡毛细血管发育不全导致其无法与肺泡上皮细胞接触,生后出现持续性低氧血症和严重PPHN,病死率为100%,目前无存活病例报道[16]。ACD病理学特点包括肺泡及小叶发育异常,肺泡单位缩小、数量减少,肺毛细血管密度减少,肺泡间质增厚,部分肺静脉位置异常、附着于肺小动脉,肺动脉管壁中层增厚,其中,肺动脉管壁增厚和肺毛细血管密度低及肺静脉位置异常,是最突出的组织学特征[17]。ACD 的病因尚未明确,有报道40%ACD与FOX 转录因子基因簇缺乏有关[17]。国外有报道[18],对诊断为致死性肺部疾病的173 例新生儿进行尸检,发现超过一半为ACD。国内报道ACD病例甚少, 到目前为止国内报道过2 例ACD[16-17,19]。ACD 的诊断主要依靠肺部活检及尸检结果。然而,由于国内患儿家属思想观念的限制导致新生儿肺部活检及尸检较难开展,从而导致ACD确诊率不高。
ECMO支持治疗期间相关临床指标及并发症可直接影响患儿的结局及预后。一项多中心研究显示[20],新生儿及儿科患儿在ECMO支持治疗期间,出现肾损害的高达60%~70%,且肾损伤与ECMO治疗时间延长及病死率增加相关。ECMO治疗由于血流动力学的改变,出现血流停滞和形成湍流,膜氧合器的压力差及血液泵支持下的高剪切力,导致溶血、血小板减少和出血。有文献报道在ECMO治疗15 min内就会发生血小板损伤,且持续ECMO 治疗的整个过程,直到停止[21]。本研究中最常见的并发症是血小板减少症,高达100%,同国内李小兵等[13]及国外Thomas等[22]的报道相似,在ECMO治疗期间应密切监测及时补充血小板。本研究中发生肾功能不全只有1 例,发生率为9%,明显少于Fleming等[20]的报道,可能与本研究样本量少有关。ECMO 期间凝血功能的管理尤为重要,本研究中有5例发生颅内出血(45%),3例发生胃出血(27%),1 例发生肺出血(9%),1 例发生DIC(9%),3 例发生穿刺处出血。提高ECMO 治疗期间管理技术,减少并发症及改善ECMO期间患儿临床指标是提高患儿生存率的关健因素。
ECMO 技术目前已成为PPHN 患儿最后且有效的生命支持措施,但并发症发生率较高,需严格掌握适应证、把握时机、提高ECMO管理水平,减少并发症及改善ECMO期间患儿临床指标可提高患儿的撤机率及存活率。对于在ECMO治疗下难逆转的肺动脉高压等情况,应及时与监护人沟通尽早行基因检查及肺活检,或在患儿死亡后尸检,进一步明确诊断。
