缺铁调控植物开花时间机制的初步研究
2022-07-23梁晶晶夏子怡
梁晶晶,夏子怡,彭 镶,秦 诚
(杭州师范大学生命与环境科学学院植物RNA信号传导中心,浙江 杭州 311121)
植物的生长发育需要多种矿质元素,包括大量元素和微量元素,它们以离子或盐的形式被植物吸收利用[1].铁作为需求量最大的微量元素,对生物体的生长发育起重要作用[2].铁的主要化学性质之一是氧化还原特性,这一特性使铁成为植物体中多种蛋白和酶不可缺少的成分[3],如铁氧还蛋白、细胞色素氧化酶复合体、过氧化物酶、豆血红蛋白等.由于这些蛋白的活性与铁的含量有关,因此铁在植物体的光合作用、呼吸作用、氮素代谢、有机酸代谢等多项生理活动中都发挥着重要作用[4].
土壤中的总铁含量较高,但主要以三价铁的形式存在,在碱性土壤中溶解度低,限制了植物根系对铁元素的吸收,降低了土壤中的有效铁含量.虽然植物在长期的进化过程中逐步形成了从土壤中吸收利用铁的有效机制,但是铁在植株中的移动性较差,难以从成熟组织向幼嫩组织转移,必须依赖木质部的转运.为满足植株对铁元素的需求,在植物生长发育的每个阶段都要保证铁的不断供应.因此,缺铁成为常见的营养胁迫因素之一,轻则导致叶片黄化、产量降低,重则导致植株衰亡[5-6].
在自然环境中,营养逆境等胁迫是植物生长发育过程中常见的不利条件,为了最大程度地保存后代,许多植物可以通过响应胁迫因素来诱导开花[7].开花是植物从营养阶段到生殖阶段的重要转折点,对植物的生存繁衍与生态适应过程起到重要作用[8].通过对模式植物拟南芥的开花调控研究发现,拟南芥中超过180个基因与开花的调控是相关的,其中调控开花的关键基因包括开花促进基因CONSTANS(CO)、FLOWERINGLOCUST(FT)、SUPPRESSOROFOVEREXPRESSIONOFCONSTANS1(SOC1)和开花抑制基因FLOWERINGLOCUSC(FLC)、SHORTVEGETATIVEPHASE(SVP)等[9-10].研究表明,这些基因通过整合各条开花途径的信号,共同作用调控植物开花.其中FLC整合了来自自主途径和春化途径的信号,SVP主要联系温度途径和赤霉素途径,CO是光周期途径的关键基因,这些基因调控着下游基因FT、SOC1的表达,精准调控植物开花[11-13].
虽然缺铁影响植物生长发育的研究有很多,但涉及缺铁与开花时间二者之间调控的研究较少,其作用机制尚不完全清楚.本研究通过对野生型拟南芥进行不同浓度的缺铁处理后发现,与正常营养条件下生长的拟南芥相比,0.25 μM Fe3+条件下生长的拟南芥早花.通过定量PCR检测后发现,0.25 μM Fe3+条件下生长的拟南芥中FT基因的表达量上升,SVP基因的表达量下降.进一步研究发现,相应的开花突变体ft-10、svp-41在0.25 μM Fe3+条件下生长与正常营养条件下生长开花时间没有明显差异.这些研究结果表明,FT、SVP可能参与调控缺铁诱导的植物早花.本研究旨在探索缺铁对植物开花时间的影响,丰富植物开花调控的分子机制,并为指导育种实践提供重要的理论基础.
1 材料与方法
1.1 植物材料
本研究使用的拟南芥材料为野生型(Col)和开花关键基因突变体(ft-10、co-9、soc1-2、flc-3、svp-41).
1.2 实验方法
1.2.1 生长条件
将消毒后的拟南芥种子铺在湿润的滤纸上,置于4 ℃冰箱破休眠2—3 d.取种子点于0.5 mL离心管盖的琼脂糖表面,转入营养液中培养.拟南芥的生长在人工气候室中进行,人工气候室条件为:恒温23 ℃,光照时间/黑暗时间为16 h / 8 h,光照强度为12 000 Lux.
本研究采用水培系统,营养液以1/2 Hoagland配方为基础,并略加修改[14].以铁元素含量为12.5 μM的营养液配方为参照,设置3个缺铁浓度:1.25 μM、0.625 μM和0.25 μM.
1.2.2 缺铁处理
本研究采用的缺铁处理方法如下:破休眠后的野生型拟南芥种子点种完毕后分别培养于不同浓度梯度的缺铁营养液中.培养期间每周更换一次营养液.
1.2.3 开花表型
统计拟南芥开第一朵花时的莲座叶数量.
1.2.4 基因表达量分析
野生型拟南芥幼苗培养至第9天时,剪取各处理条件下5株生长状况一致的幼苗放入1.5 mL离心管中,液氮中冷却后保存至-80℃冰箱.利用植物总RNA提取试剂盒(TIANGEN)提取叶片总RNA,随后根据FastKing gDNA Dispelling RT SuperMix的反转录试剂盒将提取的RNA反转录合成cDNA第一条链.选取开花关键基因FT、CO、SOC1、FLC、SVP和内参基因Tubulin的特异性引物,利用Ultra SYBR Mixture(中国北京康为)进行CFX96实时聚合酶链反应,设置3个生物学重复.以Tubulin的表达量为参照,分析各基因的相对表达量.
1.2.5 开花关键基因突变体的表型观察
将野生型拟南芥(Col)和开花关键基因突变体(ft-10、co-9、soc1-2、flc-3、svp-41)的种子破休眠后点种,均分为两份,分别转入正常营养条件和缺铁营养条件中生长,观察开花表型.
1.2.6 统计分析
各数据的处理与作图采用Microsoft Excel软件.数据差异检测采用Microsoft Excel中的t-test检测.P<0.05时表示差异显著.
2 结果与分析
2.1 不同缺铁条件下野生型拟南芥的开花表型观察
将野生型拟南芥分别培养于正常营养条件(CK,12.5 μM Fe3+)和不同浓度梯度的缺铁营养条件(1.25 μM Fe3+、0.625 μM Fe3+和0.25 μM Fe3+)下,结果如图1所示.在正常营养条件下,野生型拟南芥开花时的莲座叶为11片左右.3种浓度的缺铁处理中,1.25 μM Fe3+、0.625 μM Fe3+条件下的拟南芥开花表型与正常营养条件下培养的拟南芥相比没有明显差异,而0.25 μM Fe3+营养条件下的拟南芥开花提前,开花时的莲座叶为8片左右(图1).
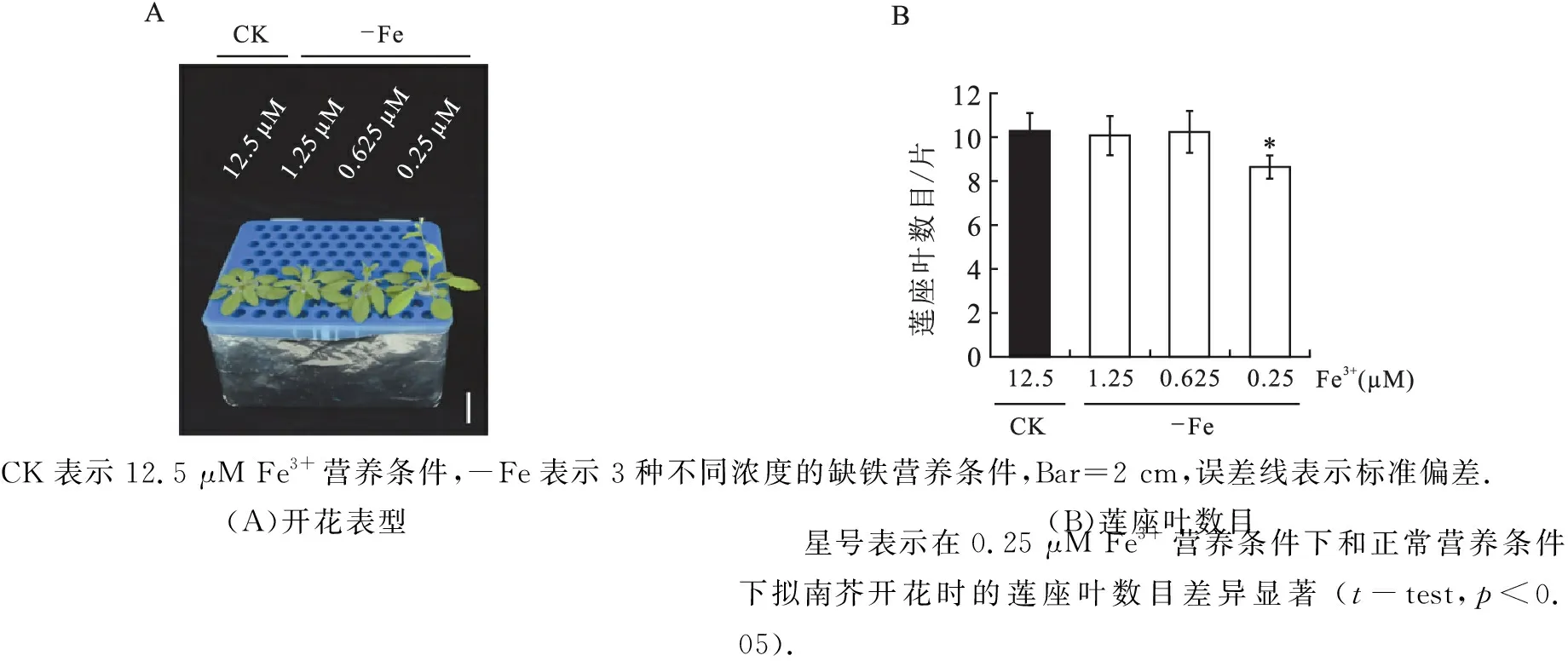
CK表示12.5 μM Fe3+营养条件,-Fe表示3种不同浓度的缺铁营养条件,Bar=2 cm,误差线表示标准偏差.(A)开花表型(B)莲座叶数目 星号表示在0.25 μM Fe3+营养条件下和正常营养条件下拟南芥开花时的莲座叶数目差异显著 (t-test,p<0.05).图1 不同浓度缺铁处理的野生型拟南芥开花表型分析Fig.1 Flowering phenotype of wild-type under different concentrations of iron solution
2.2 缺铁条件下野生型拟南芥开花相关基因的表达检测
植物在营养逆境条件下调节开花时间以完成生命周期并繁衍后代,而这些调控方式最终都由基因完成.因此,我们在3种缺铁浓度中选择开花表型有明显差异的浓度(0.25 μM Fe3+)进行下一步研究.以正常营养条件下的野生型拟南芥各基因表达量为参照,分析0.25 μM Fe3+营养条件下拟南芥开花关键基因的表达变化.
我们首先检测在0.25 μM Fe3+条件下缺铁响应关键基因的表达.结果显示,FRO2和IRT1基因表达上升(图2 A-B),进一步说明0.25 μM Fe3+条件是缺铁条件.随后我们检测拟南芥开花关键基因的表达变化,结果显示,缺铁影响野生型拟南芥相关开花关键基因的表达(图2).与正常营养条件下培养的野生型拟南芥相比,在0.25 μM Fe3+营养条件下,野生型拟南芥中FT基因表达量上升,而SVP基因表达量明显下降,CO、SOC1与FLC基因表达量无明显差异.
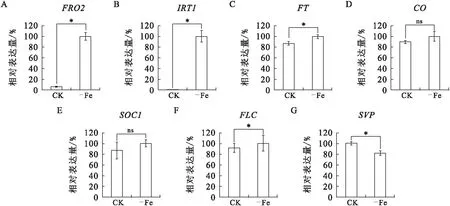
CK表示12.5 μM Fe3+营养条件,-Fe表示0.25 μM Fe3+营养条件,误差线表示标准偏差,星号表示显著差异(t-test,p<0.05),ns表示无显著差异,3组生物学重复结果一致.图2 缺铁营养条件下野生型拟南芥开花关键基因表达分析Fig.2 Expression analysis of key flowering genes under iron deficient condition
2.3 缺铁条件下开花关键基因突变体的表型观察
前期研究结果表明,0.25 μM Fe3+营养条件下野生型拟南芥开花时间提前,并且开花关键基因FT、SVP表达发生明显变化.为进一步验证缺铁是否通过影响FT、SVP基因的表达从而诱导拟南芥早花,我们分别在正常营养条件和缺铁营养条件下,观察开花关键基因突变体ft-10、co-9、soc1-2、flc-3、svp-41的开花表型.
结果显示,在0.25 μM Fe3+营养条件下,co-9、soc1-2、flc-3突变体的开花时间与正常营养条件下相比提前(图3D—F,图4D—F),这些突变体的表型变化与野生型的表型变化一致(图3A,图4A).而ft-10、svp-41突变体的开花时间与正常营养条件下相比无明显变化(图3B—C,图4B—C).
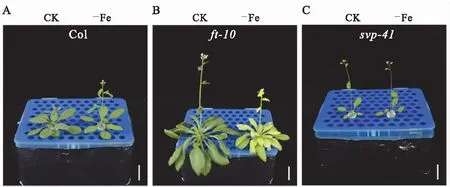
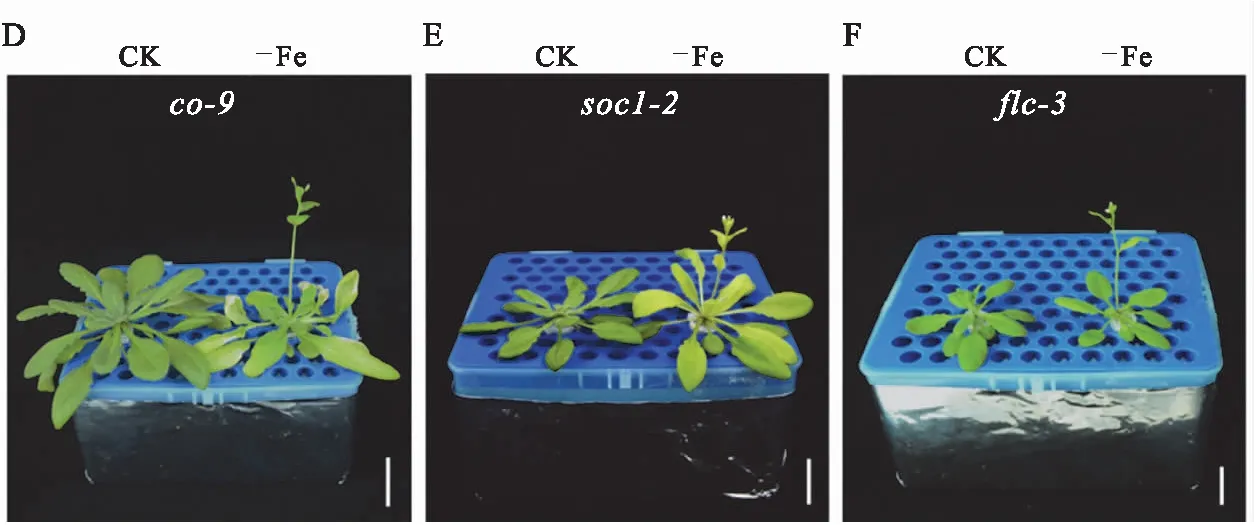
CK表示12.5 μM Fe3+营养条件,-Fe表示0.25 μM Fe3+营养条件,Bar=2 cm.图3 缺铁营养条件下拟南芥开花基因突变体开花表型Fig.3 Flowering phenotype of flowering-related mutants under iron deficient condition
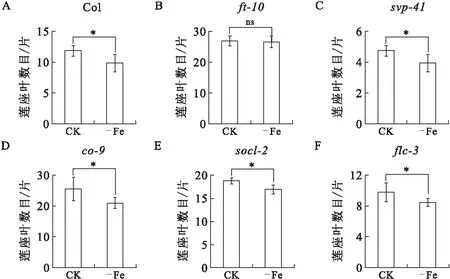
Col(A)、ft-10(B)、svp-41(C)、co-9(D)、soc1-2(E)、flc-3(F)开花时的莲座叶数量.CK表示12.5 μM Fe3+营养条件,-Fe表示0.25 μM Fe3+营养条件,误差线表示标准偏差,星号表示显著差异(t-test,p<0.05),ns表示无显著差异.图4 缺铁营养条件下拟南芥开花基因突变体开花时间Fig.4 Flowering time of flowering-related mutants under iron deficient condition
3 讨论
高等植物由营养生长向生殖生长转变的过程被称为成花转变,这一过程受到遗传因素和环境因素的共同影响[15].目前已知涉及植物开花的关键基因包括FT、CO、SOC1、FLC、SVP等,这些开花基因通过光周期、春化、赤霉素、温度、自主和年龄等遗传途径精准调控开花时间[8].各条开花调控途径既相互独立又彼此联系,其中存在一些开花整合因子,它们汇集多条遗传途径,协同调控开花[13].
铁作为植物生长发育过程中不可或缺的微量元素,参与叶绿素合成、呼吸作用、生物固氮等过程[16].由于铁在土壤中主要以氧化物或氢氧化物的形式存在,植物难以直接利用,因此植物可吸收并利用的铁含量往往不足,这使得缺铁成为继缺氮和缺磷后阻碍植物开花育种的又一大营养逆境因素[17].研究表明,在营养逆境处理下,为成功完成繁衍后代的使命,植物会提早开花,提前结束生命周期,出现“逆境诱导的开花”现象[18].本研究中,与12.5 μM Fe3+条件下培养的拟南芥相比,0.25 μM Fe3+条件下培养的野生型拟南芥莲座叶数目减少,开花提前(图1),由此可见一定程度的缺铁会诱导拟南芥提早开花.
检测野生型拟南芥开花关键基因的表达量发现,在0.25 μM Fe3+营养条件下,开花促进基因FT表达量上升(图2),开花抑制基因SVP表达量下降(图2).FT是成花诱导途径中的开花促进基因,在茎尖通过FT蛋白与FLOWERING LOCUS D(FD)蛋白的相互作用,调控花分生组织特征基因APETALA1(AP1)的转录激活,从而促进花的发育[19].SVP作为开花抑制因子,受光周期途径和温度途径等调控,调节开花时间.研究表明,SVP编码的蛋白可以与FT的启动子CArG片段相结合以阻碍FT表达[20].缺铁处理后,SVP表达受到抑制,使得下游靶基因FT表达水平上升,促进植物开花.
缺铁处理后,野生型拟南芥中FT和SVP基因的表达量出现明显变化,而FLC、CO、SOC1的表达无显著差异.随后在缺铁条件下观察开花关键基因突变体后发现,FT、SVP基因突变后,其相应突变体植株ft-10、svp-41在0.25 μM Fe3+营养条件下均无早花现象,这与0.25 μM Fe3+营养条件下野生型拟南芥开花提前的表型不同,这表明FT和SVP可能参与0.25 μM Fe3+诱导野生型拟南芥早花这一过程.因此在0.25 μM Fe3+营养条件下,突变体ft-10和svp-41无法感知并响应缺铁诱导产生的信号,植株就不发生早花应答.而FLC、CO、SOC1相关突变体flc-3、co-9和soc1-2在缺铁处理后提早开花,与野生型开花表型相同,说明FLC、CO、SOC1可能不参与缺铁诱导植物早花.上述结果与开花基因表达变化结果一致,进一步证明了缺铁可能是通过调控FT和SVP基因表达,从而诱导植物早花.
本研究表明,一定程度的缺铁诱导植物早花,可能是通过调控FT和SVP基因的表达实现的.这为揭示缺铁调控植物开花时间的机制提供新的研究方向,为后期进一步研究植物开花时间的机制奠定了基础.
