新型邻菲啰啉钌配合物的合成、聚集诱导发光性质及细胞成像
2022-07-23郑苗苗赵振鹏
郑苗苗,赵振鹏,王 慧
(皖南医学院药学院,安徽 芜湖 241002)
0 引言
一般情况下,有机配体和金属配合物可在稀的非水溶液中发出明亮荧光,但在浓溶液或聚集态下因聚集引起猝灭(ACQ)现象而发出极微的荧光.2001年,唐本忠教授研究组报道了一种称为“聚集诱导荧光增强”(AIE)效应的新现象,正好与ACQ相反,即在良性溶剂中大多不发光,在聚集态或固态下发出强烈的荧光而广受研究者的关注[1-3].近年来,有不少的发光金属配合物被研究出来,但大多都是发蓝绿光,发红光的金属配合物十分有限.在OLED中,红光带隙较蓝绿光窄,激子极其容易发生非辐射跃迁而猝灭;在生物医学领域,因细胞自身易存在蓝绿色自荧光干扰,导致实验难以进行[4-5].因此,对具有穿透能力强、激发能量低、背景荧光干扰小等优势的红光AIE材料进行研究有着重要的科学意义.
金属钌(Ⅱ)配合物因具有较大的斯托克斯位移、优秀的光稳定性、长的荧光寿命等优势,在光电转化材料、生物细胞成像、生物分子及离子荧光探针、抗癌药物、靶向检测与给药等应用中脱颖而出[6-7],逐渐成为诸多领域研究的热门.
本文以邻菲啰啉为母体,设计合成了一种具有AIE性质的钌配合物1(图1).结合理论计算,研究了配合物1的光学性质及AIE性质,初步探索了配合物1在活细胞和固定细胞中的细胞成像.
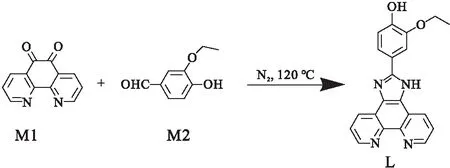
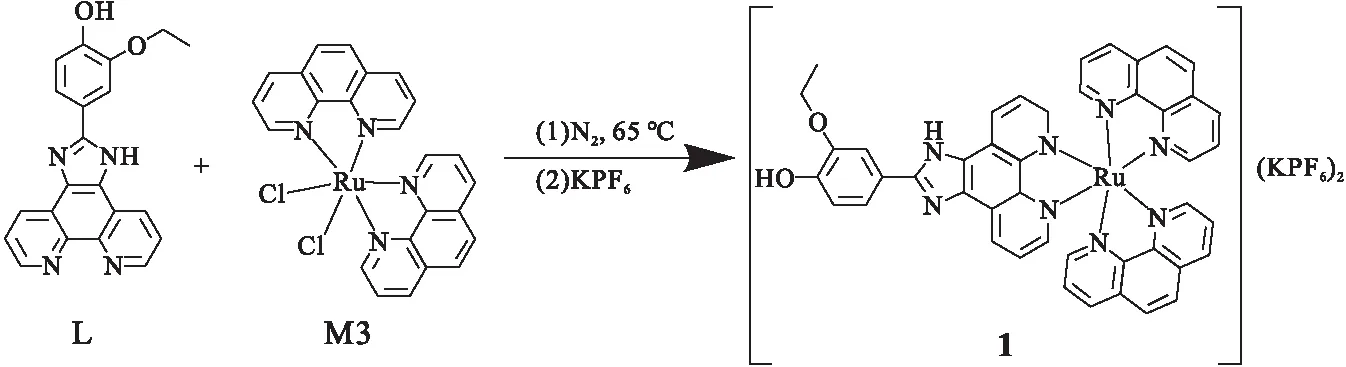
图1 配合物1的合成路线图Fig.1 The synthetic route of complex 1
1 实验部分
1.1 试剂与仪器试剂:邻菲啰啉(99 %),乙基香兰素(98 %),三氯化钌水合物(35.0%—42.0 % Ru basis),六氟磷酸钾(99 %),其他试剂和药品皆为分析纯,购于上海阿拉丁试剂有限公司,实验用水为超纯水.仪器:Bruker Avance 400 型核磁共振仪;TCS SP 8 型共聚焦显微成像系统;Nicolet FT-IR-is5 型傅里叶变换红外光谱仪;UV-5900 PC型紫外光谱仪;Finnigan LCQ 型质谱仪(ESI源);HITACHI F-4600 型荧光光谱仪;Infinite 200 pro 型酶标仪.
1.2 配合物1的合成配体L合成见参考文献[8].氮气保护下,称取M3(0.17g,0.35 mmol),L(0.11g,0.33 mmol),50 mL甲醇和10 mL二氯甲烷置于三口烧瓶中,65℃下反应24 h后,向烧瓶中加入六氟磷酸钾 (0.92g,5 mmol),继续反应4 h.反应结束后,减压蒸馏除去溶剂,所得固体用20 mL二氯甲烷溶解,减压抽滤除去无机盐,所得滤液经硅胶柱层析分离,洗脱剂为二氯甲烷∶甲醇=50∶1,得红色固体 0.12 g.IR (KBr, cm-1): 3473,2924,2852,2361,1976,1600,1524,1366,1196,1144,1038,838,719,556.1H NMR (400 MHz, DMSO-d6) δ 14.07 (s,1 H),9.72 (s,1 H),9.06 (d,J=8.1 Hz,2 H),8.78 (d,J=8.1 Hz,4 H),8.40 (s,4 H),8.19—7.96 (m,7 H),7.86—7.74 (m,8 H),7.05 (d,J=8.2 Hz,1 H),5.77 (s,1 H),4.20 (q,J=6.8 Hz,2 H),1.44 (t,J=6.9 Hz,3 H). ESI-MS: 计算值1109.82;实验值819.1581[M-2PF6-]+.
1.3 光学性质测试以二甲基亚砜作溶剂,将配合物1配制浓度为1.0 mmol /L的母液.移取50 μL母液,置于5 mL容量瓶中,分别用苯、四氢呋喃(THF)、乙酸乙酯(EA)、乙醇(EtOH)、乙腈、二甲基亚砜(DMSO)、PBS缓冲溶液定容至5 mL.在紫外可见吸收和荧光光谱测试中配制的配合物1浓度均为10 μmol /L.荧光光谱测试条件激发波长为 456 nm,狭缝宽度均为 10.0 nm,电压为 500 V.
1.4 细胞成像测试将可传代的人肝癌细胞(HepG2细胞)接种于激光共聚焦小皿中,待细胞密度涨至50%—60%时,进行如下两组实验:1) 将配合物1与HepG2细胞共培养 30 min,用PBS缓冲溶液洗涤3遍;2) 移去孔中培养基,用PBS缓冲溶液洗涤2遍,加入1 mL4%的多聚甲醛溶液室温下培养20 min,移去多聚甲醛,用PBS洗涤2遍,然后加入含有配合物1的新鲜培养基,共孵育30 min后,用PBS洗涤2遍.其中配合物1的浓度为10 μmol/L.
2 结果与讨论
2.1 光学性质
图2是配合物1在7种不同极性溶剂中紫外可见吸收光谱和荧光光谱.从图2A可以看出,随着溶剂极性的增加,配合物1吸收峰位置和吸光度均没有发生明显的变化.配合物1的最大吸收峰在456 nm左右,有可能是配体和金属之间的电荷转移混有配体内的电荷转移跃迁[9].为了进一步佐证吸收峰的电子跃迁归属,采用密度泛函理论(B3LYP)对配合物1的跃迁过程进行计算,计算采用G09程序包,6-31G对C、H、N、O原子及LANL2DZ对Ru原子.如图3所示,理论计算得出配合物1的最大吸收峰在449 nm左右,是HOMO到LUMO的跃迁,其中HOMO轨道的电子云主要集中在配体L上,LUMO轨道上的电子云主要集中在邻菲啰啉配体、钌原子及配体L上,可归属于LMCT(配体到金属的跃迁)、ICT(分子内电荷转移跃迁)及L1L2CT(配体到配体之间的电荷转移跃迁,L1为配体L,L2为邻菲啰啉)跃迁的混合.
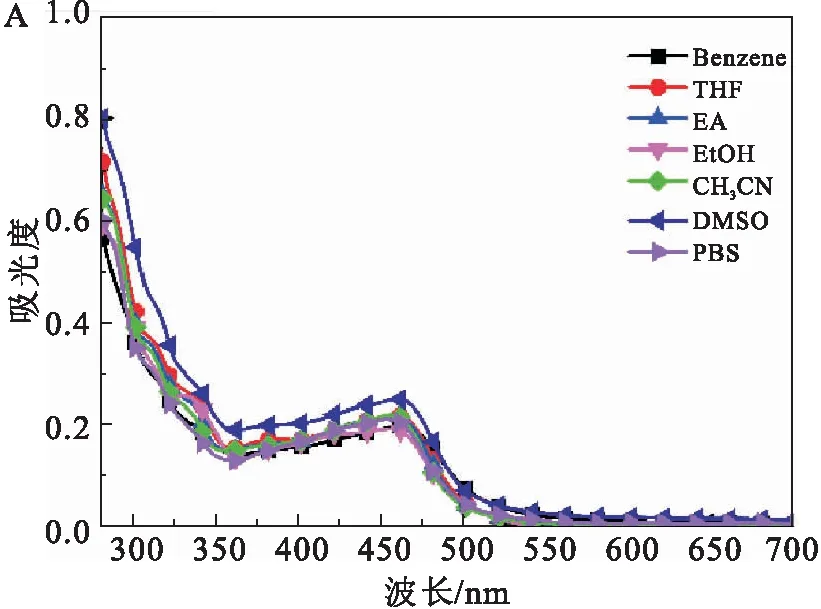
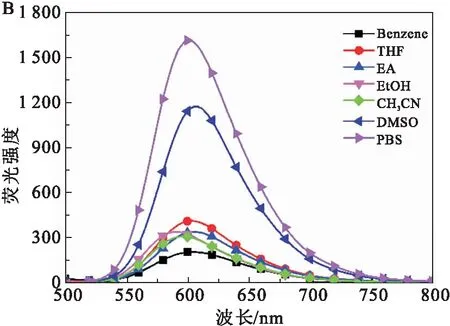
图2 配合物1在7种不同极性溶剂中的紫外可见吸收光谱(A)和荧光光谱(B)Fig.2 UV-vis absorption (A) and fluorescence spectra (B) of complex 1 in seven different solvents
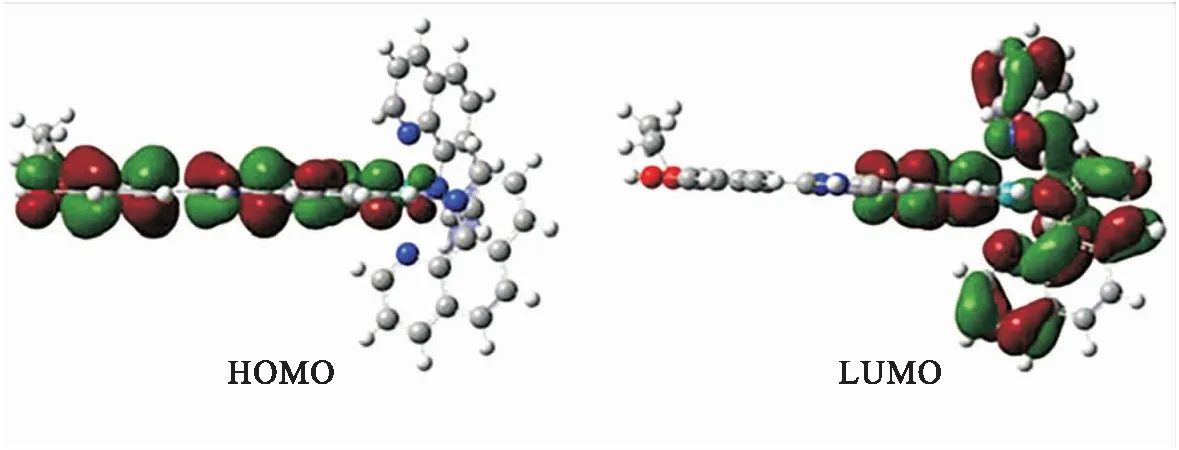
图3 配合物1的分子轨道能级图Fig.3 The molecular orbital energy diagram for complex1
从图2B可以看出,配合物1的最大荧光发射峰位置随溶剂极性增加变化不大,其最大荧光发射峰在600 nm,属于红光区.相较于其他溶剂,配合物1在PBS中的荧光强度最强,约是乙醇的5倍.
2.2 聚集诱导荧光性质
从上述结果可以看出,配合物1在水中的荧光强度高于其他溶剂,这可能是由于聚集诱导荧光导致的.为了进一步验证配合物1是否具有AIE性质,我们选择配合物1的良性溶剂乙醇和不良溶剂水,作为测试的混合溶剂.用移液枪移取配合物1的母液50 μL,置于5 mL的容量瓶中,用不同体积分数的乙醇/水定容至5 mL,配成一系列不同含水量(fw=0%,10%,20%,30%,40%,50%,60%,70%,80%,90%,99%)的混合溶液,测试配合物1的荧光光谱(见图4).如图5所示,随着含水量的增加,配合物1的荧光强度表现出先降低后增强再降低的现象.当含水量小于10 %时,配合物1的荧光强度逐渐降低,造成这种现象的原因可能是由于水含量增加,使得溶剂极性增大,从而诱导了ICT过程[10].当含水量大于10 %时,配合物1的荧光强度逐渐增强,当含水量达到80 %时,其荧光强度达到最大,约是纯乙醇的5.2 倍,这种现象可解释为当向整个体系中加入大量水时,配合物分子可快速聚集成团,内部的分子与外界环境隔离,形成了一种非极性的环境,使得分子内扭转的电荷转移被抑制,因而荧光重新增强[11].当含水量超过80 %时,配合物1的荧光强度出现降低的现象,可能是由于当含水量增加到一定程度时,溶液中的配合物迅速聚集并沉淀下来,使得溶液中的发光物质减少,最终导致荧光强度降低,这种现象其他课题组也有报道[12-13].
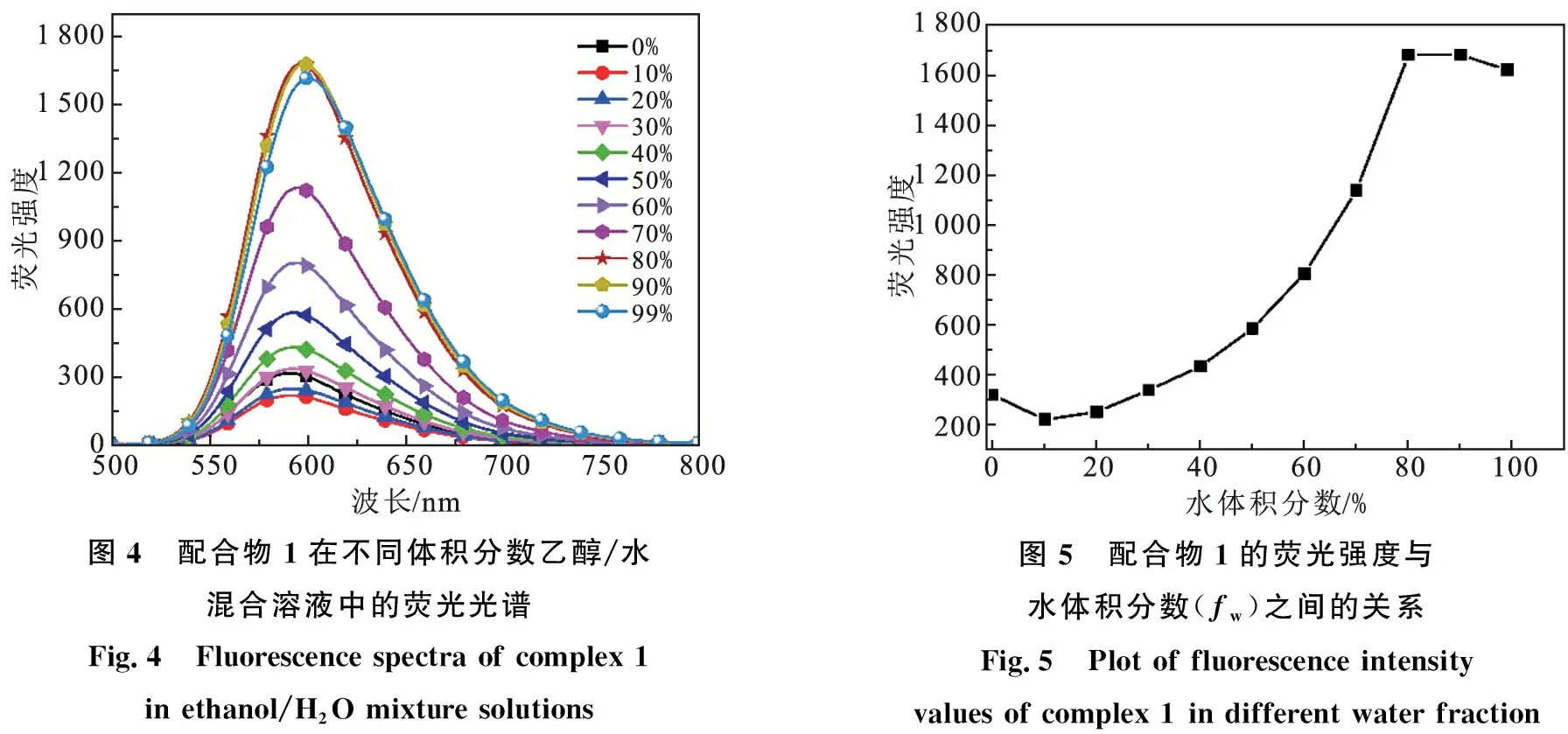
图4 配合物1在不同体积分数乙醇/水混合溶液中的荧光光谱Fig.4 Fluorescence spectra of complex 1 in ethanol/H2O mixture solutions图5 配合物1的荧光强度与水体积分数(fw)之间的关系Fig.5 Plot of fluorescence intensity values of complex 1 in different water fraction
2.3 细胞毒性及细胞成像实验
为了进一步探索配合物1作为生物荧光探针的可能性,首先采用MTT法测试了配合物1的细胞毒性,具体的测试条件见参考文献[14].从图6中得知,当配合物1与HepG2细胞共培养24 h后,在浓度为4—25 μmol/L范围内下,细胞存活率均达到85%以上,表明配合物1具有较低的生物毒性,可进一步应用于细胞成像研究.
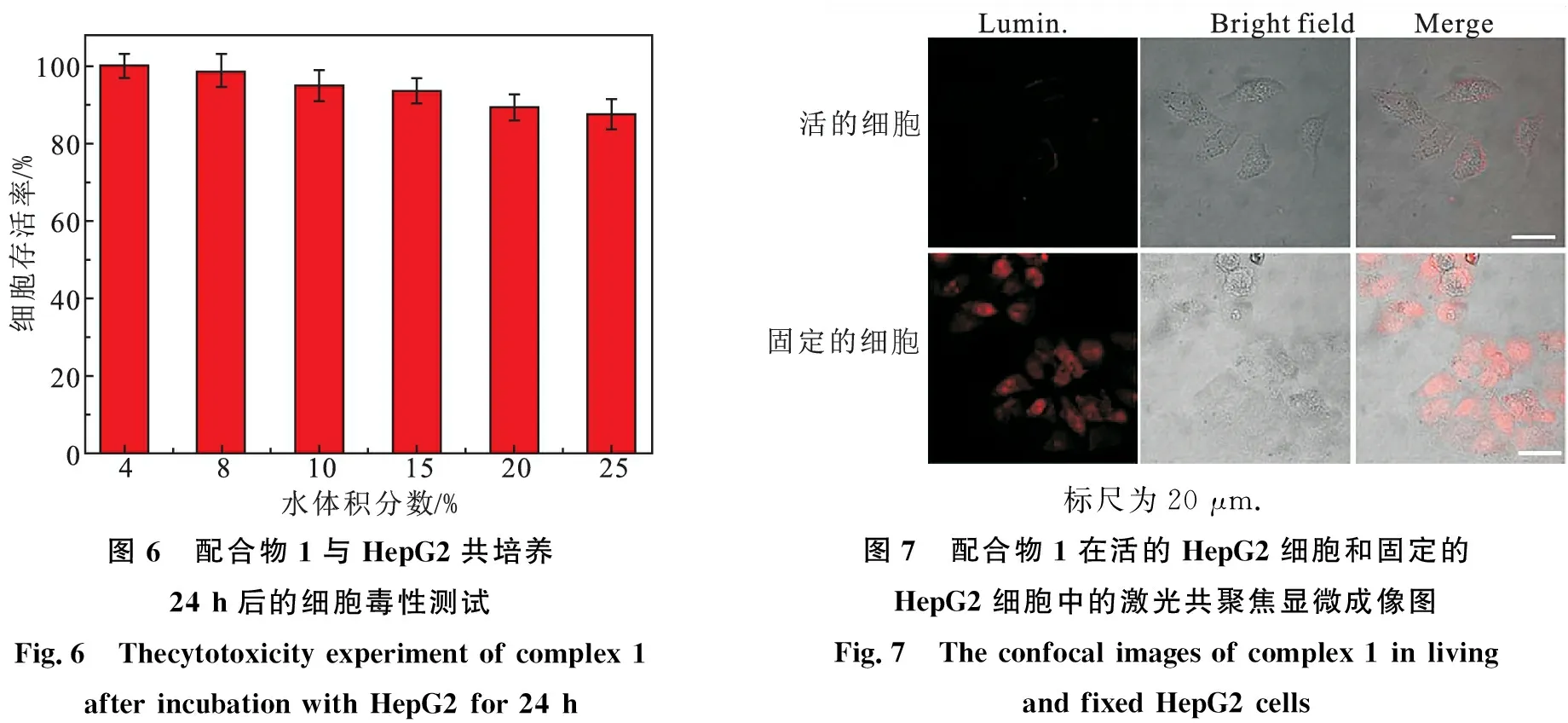
图6 配合物1与HepG2共培养24 h后的细胞毒性测试Fig.6 Thecytotoxicity experiment of complex 1 after incubation with HepG2 for 24 h标尺为20 μm.图7 配合物1在活的HepG2细胞和固定的HepG2细胞中的激光共聚焦显微成像图Fig.7 The confocal images of complex 1 in living and fixed HepG2 cells
图7是配合物1与活的HepG2细胞和固定的HepG2细胞共同培养30 min后共聚焦显微成像图.由图可知,配合物1在活的HepG2细胞中仅表现出微弱荧光,从叠加图中可以看出,荧光来源主要集中在细胞膜区域,可能是由于配合物分子较大,不利于其进入活体细胞.将配合物1作用于固定的HepG2细胞中,发现其在细胞中展现出较强的荧光,而且可全部着色细胞,可能是由于细胞被多聚甲醛固定后,细胞膜的通透性发生改变,有利于配合物进入细胞.此结果表明配合物1可对固定后的细胞进行显影.
3 结论
本文设计合成了一种新型的邻菲啰啉钌配合物1,借助紫外可见吸收光谱、荧光光谱和理论计算,研究了配合物1的光学性质及AIE性质.结果表明,配合物1展现出明显的AIE性质,当含水量达到80%时,荧光强度最强,其发射波长在600 nm,属于红光区.细胞实验结果表明配合物1具有较低的细胞毒性,可在固定细胞中全部着色.本研究为设计合成具有AIE性质的钌配合物提供了实验基础.
