锐顶镰孢菌Fusarium acuminatum小RNA的鉴定与分析
2022-07-23夏旋燕赖童飞
李 冉,夏旋燕,孙 苗,周 婷,赖童飞
(杭州师范大学生命与环境科学学院,浙江 杭州 311121)
0 引言
锐顶镰孢菌(Fusariumacuminatum)属于半知类真菌,是一种无性型子囊菌,其分生孢子呈镰刀形,顶细胞为喙状,基细胞足跟明显,广泛分布在植物和土壤中.作为一种重要的病原菌,它是人参、玉米、谷物、豆类等作物根腐病[1-3]和大蒜、马铃薯等作物茎腐病的主要致病菌[4-5],还能够侵染越橘、猕猴桃、南瓜等果实[6-8],造成寄主产量损失和品质下降,严重危害我国的农业生产.同时F.acuminatum能够产生多种单端孢霉烯类毒素,如T-2毒素、脱氧雪腐镰刀菌烯醇(deoxynivalenol)和4-乙酰雪腐镰刀菌烯醇(4-acetylnivalenol),直接损伤肾脏、肝脏及消化道黏膜,引起胃肠出血或炎症、坏死性皮炎、白细胞数量降低、免疫下降及流产等症状,对人、畜健康产生巨大威胁[9-11].此外,F.acuminatum还具有冰核活性,可诱发植物霜冻[12-14].目前,除了精选抗病品种、做好田间消毒及管理工作,使用有机硫类和唑类杀菌剂可获得一定的防治效果[15].
小RNA(sRNA)是一大类长度约为18~30 nt的非编码RNA分子,广泛存在于人类、动物、植物和微生物体内,主要包括微RNA(miRNA)、小干扰RNA(siRNA)、小非编码RNA(sncRNA)、核小RNA(snRNA)、核仁小RNA(snoRNA)、Piwi互作RNA(piRNA)及重复相关小干扰RNA(rasiRNA)等.小RNA通常与蛋白质组成复合物,在表观遗传、转录及转录后水平发挥调控作用,其主要功能包括靶向降解mRNA、抑制翻译、编辑DNA以及促进异染色质形成等,在基因表达、细胞分化、发育与衰老、物质及能量代谢等细胞生命活动中发挥重要作用[16-18].因此,本研究以具有重大危害的病原菌F.acuminatum为研究对象,采用高通量小RNA测序技术,获得F.acuminatum全基因组水平小RNA图谱,利用大数据的覆盖率和深度,发掘F.acuminatum特有或新的小RNA,并对小RNA的表达水平和作用靶标进行预测与注释.研究结果有助于加深对F.acuminatum生活周期、发病规律及致病机制的了解,为阐明F.acuminatum特定生理过程的分子调控机制提供理论基础.
1 材料与方法
1.1 实验材料
病原菌Fusariumacuminatum为本实验室自有菌种,红富士苹果(MalusdomesticaBorkh. Cv. Red Fuji)购自当地市场.PDA培养基(potato dextrose agar)购自美国BD公司(Becton, Dickinson and Company),PDB培养基(potato dextrose broth)购自北京索莱宝科技有限公司,其他常规试剂购自生工生物工程(上海)股份有限公司.
1.2 菌种活化及测序样品准备
挑选生理成熟、无机械损伤及病虫害的苹果果实,经75%乙醇表面消毒,在超净台中风干后,利用接种针在果实赤道部位形成0.3 cm深的伤口,挑取少量菌丝体覆于伤口上,在25 ℃及90%湿度条件下培养,每日观察、拍照并测量病斑直径.在发病果实病斑边缘剥去果皮,利用无菌镊子夹取0.2 cm × 0.2 cm左右果肉置于PDA培养基上,25 ℃恒温培养箱中培养,每日统计菌落直径.在培养一周的培养基上,利用打孔器获取直径为1 cm的菌饼,加入到含有100 mL PDB的三角瓶中,在200 r/min、25 ℃的摇床中振荡培养36 h,离心收集菌丝,无菌水漂洗两次后液氮速冻,-80 ℃超低温冰箱保存.整个实验重复两次,两次样品等质量混匀后用于小RNA测序.
1.3 小RNA的分离、文库制备及测序
小RNA测序由BGI华大基因提供技术服务,严格按照华大基因标准项目流程进行,主要过程简述如下:提取样品总RNA,利用聚丙烯酰胺凝胶电泳(PAGE)分离18~30 nt的RNA,在3’端连接5-腺苷酸化的单链DNA接头,加入逆转录引物与3’端接头杂交后,连接5’接头,通过逆转录延伸,合成一链cDNA.使用高敏聚合酶对cDNA进行扩增,富集连接有3’接头和5’接头的cDNA,放大文库产量,利用PAGE电泳分离100~120 bp的PCR产物,进行文库定量及pooling环化,通过BGISEQ-500平台进行测序.
1.4 测序结果分析
测序获得的原始图像数据经碱基判读技术(base calling)转化为序列数据(raw data),以FASTQ格式存储,随后去除误插入片段序列、插入片段过长序列、低质量序列、polyA序列和小片段序列获得干净序列(clean tags),统计sRNA的序列种类、序列数量及长度分布.之后使用AASRA软件将clean tags与近源物种的全基因组序列(https://www.ncbi.nlm.nih.gov/genome/?term=Fusarium+oxysporum)及sRNA数据库进行比对[19].为保证每个sRNA有唯一注释,按照MiRbase、pirabank、snoRNA、Rfam以及其他RNA的优先级顺序对每个sRNA进行注释.根据miRNA前体存在发夹二级结构的特性,利用miRDeep2和miRA进行miRNA预测[20-21],利用Piano进行piRNA预测[22],结合siRNA碱基特性预测潜在的siRNA[23].结合自由能、分值等筛选条件,利用TAPIR(参数为-c 4)和TargetFinder(参数为-score 5-mfe_ratio 0.6)软件进行miRNA靶标的预测[24].利用Gene Ontology Consortium数据库(http://www.geneontology.org/)对靶标进行Gene Ontology(GO)功能注释及富集分析.利用Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库(https://www.kegg.jp/kegg/pathway.html)进行KEGG及pathway显著性富集分析.
1.5 数据分析
每个实验至少进行3次重复,数据在Microsoft Excel中进行单因素方差分析,P<0.05时表示差异显著.
2 结果与分析
2.1 F. acuminatum生理条件分析
F.acuminatum早期已经通过形态学及遗传背景鉴定,经回接活化后,菌丝粗壮且无明显间隔,营养生长旺盛,PDA培养基上不产孢(图1A),菌落整体呈现粉红色,背面呈红褐色,新生气生菌丝颜色较浅,棉絮状至绒状(图1B).苹果染病后,侵染部位塌陷腐烂,呈黄褐色(图1C),25 ℃条件下病斑扩展迅速,10 d左右即可达到3 cm以上(图1D).在PDA培养基上,菌丝扩展更为迅速,10 d左右菌落直径已经超过6 cm(图1E).由此推断,本实验中F.acuminatum处于正常的生理状态,有利于后续实验开展.
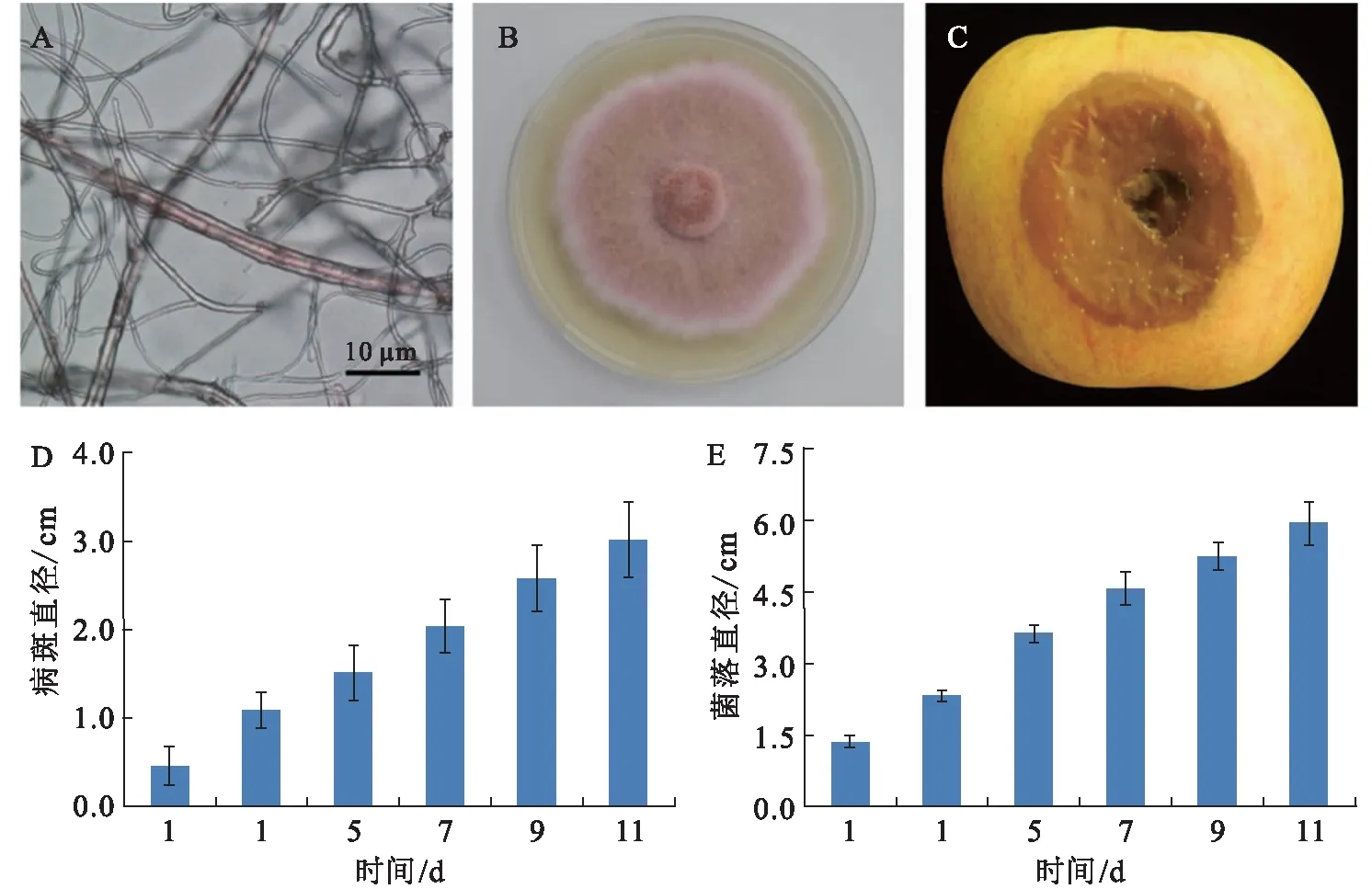
A:菌丝形态;B:菌落形态;C:侵染苹果果实表型;D:活体侵染速度;E:体外菌落扩展速度.图1 Fusarium acuminatum生理状态Fig.1 Physiological state of Fusarium acuminatum
2.2 F. acuminatum菌丝中小RNA测序分析
培养36 h的F.acuminatum菌丝经BGISEQ-500测序分析后,共获得30 000 000个原始序列,其中包含1 294 958个低质量序列、1 399 790个无效接头序列、267个PolyA序列、3 193 954个有效长度序列.有效序列中包含24 111 031个clean tag,占有效序列的80.37%,且98.8%的clean tag的质量值高于20(图2A),表明测序质量较好.通过对clean tag长度的统计发现,小RNA的长度主要分布在18~28 nt之间,其中长度在20~22 nt的小RNA数量最多(图2C).通过与已知小RNA数据库比对,共有16 540 060个小RNA(有效序列的68.60%)能够与基因组匹配.注释统计发现,位于基因间隔区域的小RNA数量最多,无注释小RNA(unmap)、其他sncRNA、核糖体RNA(rRNA)、外显子(exon)、内含子(intron)、转运RNA(tRNA)、miRNA前体(precursor)、snRNA、snoRNA以及成熟的miRNA的数量依次减少(图2B).
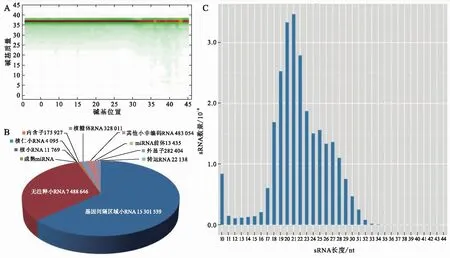
A:碱基质量分布图,每个点表示此位置达到某一质量的碱基总数,颜色越深表示数目越多;B:小RNA分类注释;C:小RNA长度分布.图2 Fusarium acuminatum中小RNA测序结果Fig.2 Small RNA sequencing result in Fusarium acuminatum
2.3 miRNA及siRNA预测分析
通过与miRbase数据库中已知miRNA成熟体比对,发现一个已知miRNA的成熟体和前体为miR-466i-5p,成熟体序列为TGTGTGTGTGTGTGTGTGTG.基于miRNA前体能够形成发夹结构,对其余未知的sRNA进行miRNA预测,共预测了11个新的miRNA,其二级结构如图3所示,序列信息如表1所示.预测的miRNA首位碱基无明显偏好性,其他位置的碱基偏好性如图4A所示.结合已经报道的siRNA碱基特性,共预测了6 503个潜在的siRNA,首位碱基为A的siRNA数量最高而为U的数量最少.其他位置的碱基偏好性如图4B所示.
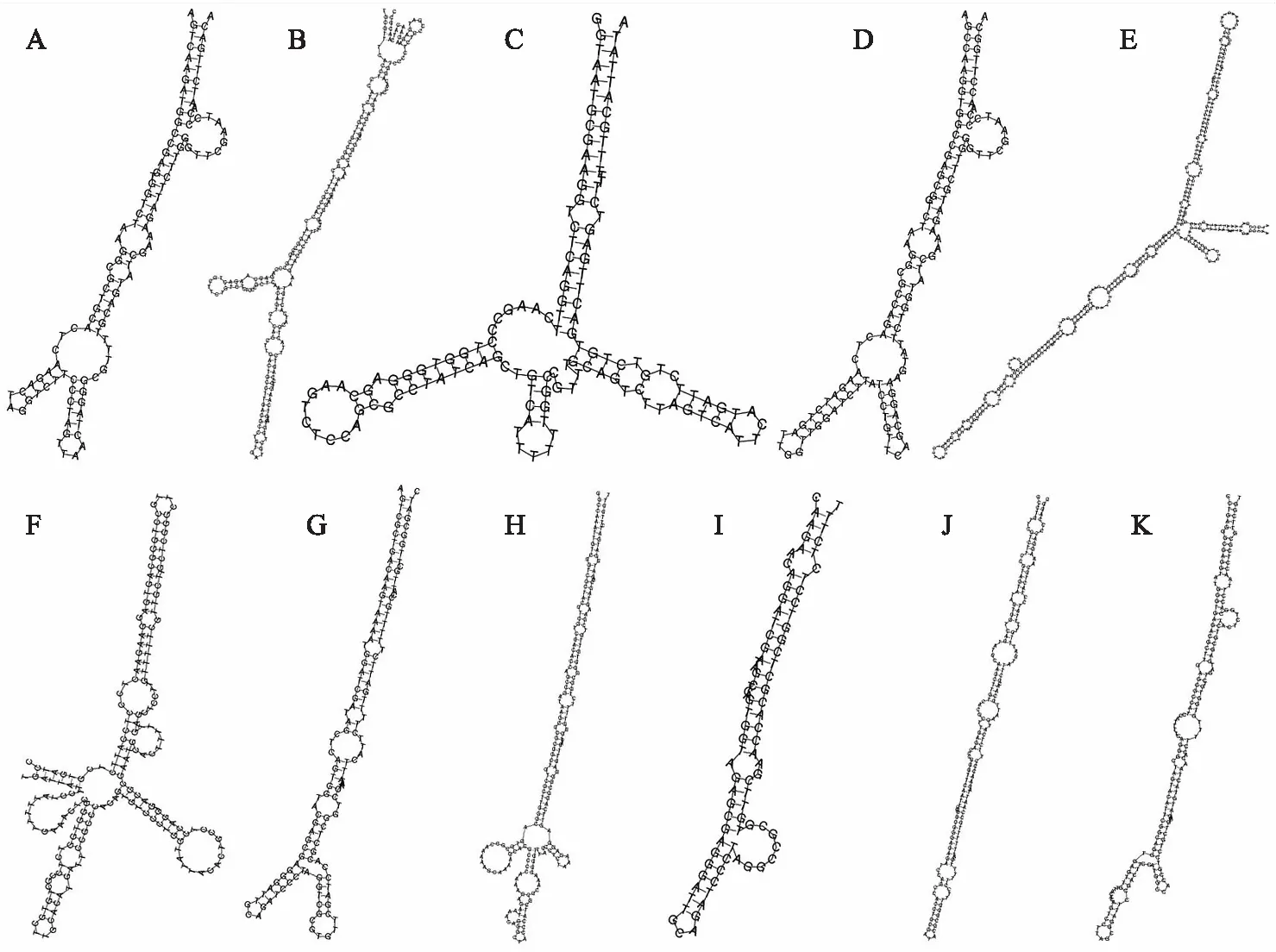
A—K表示预测的新miRNAs novel_mir1至novel_mir11.图3 预测miRNAs前体的茎环结构Fig.3 Precursor structures of predicted novel miRNAs

表1 预测新的miRNAs信息Tab.1 Information of predicted novel miRNAs
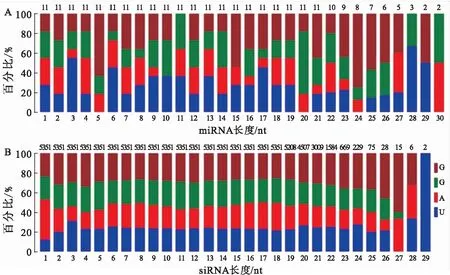
A:miRNA;B:siRNA图4 miRNA和siRNA序列中的碱基分布Fig.4 The base distribution in predicted novel miRNA and siRNA sequences
2.4 miRNA靶基因的预测及功能分析
通过TAPIR软件预测到143个靶基因,通过TargetFinder软件预测到129个靶基因,其中123个基因得到了两种软件的支持.通过GO富集分析发现,靶标基因多定位于细胞膜和细胞器,具有结合或催化活性,主要参与到细胞周期和代谢途径中(图5);Pathway富集分析发现,参与MAPK信号转导途径、自体吞噬及内质网蛋白加工的靶基因数量较多,参与类倍半萜烯及三萜生物合成以及类胡萝卜素合成的靶基因的富集因子较高(图6).
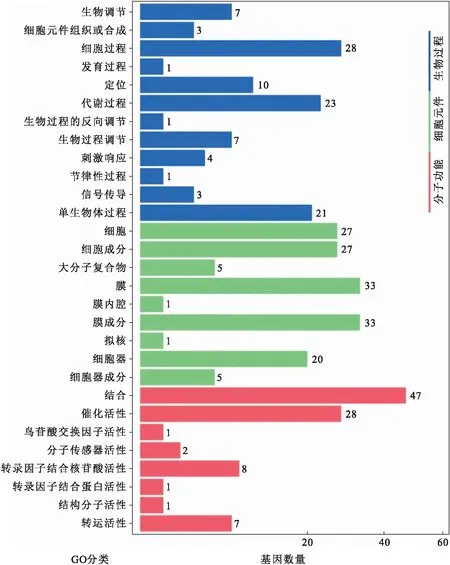
图5 miRNA靶标基因GO功能分类Fig.5 GO functional classification of miRNA targets
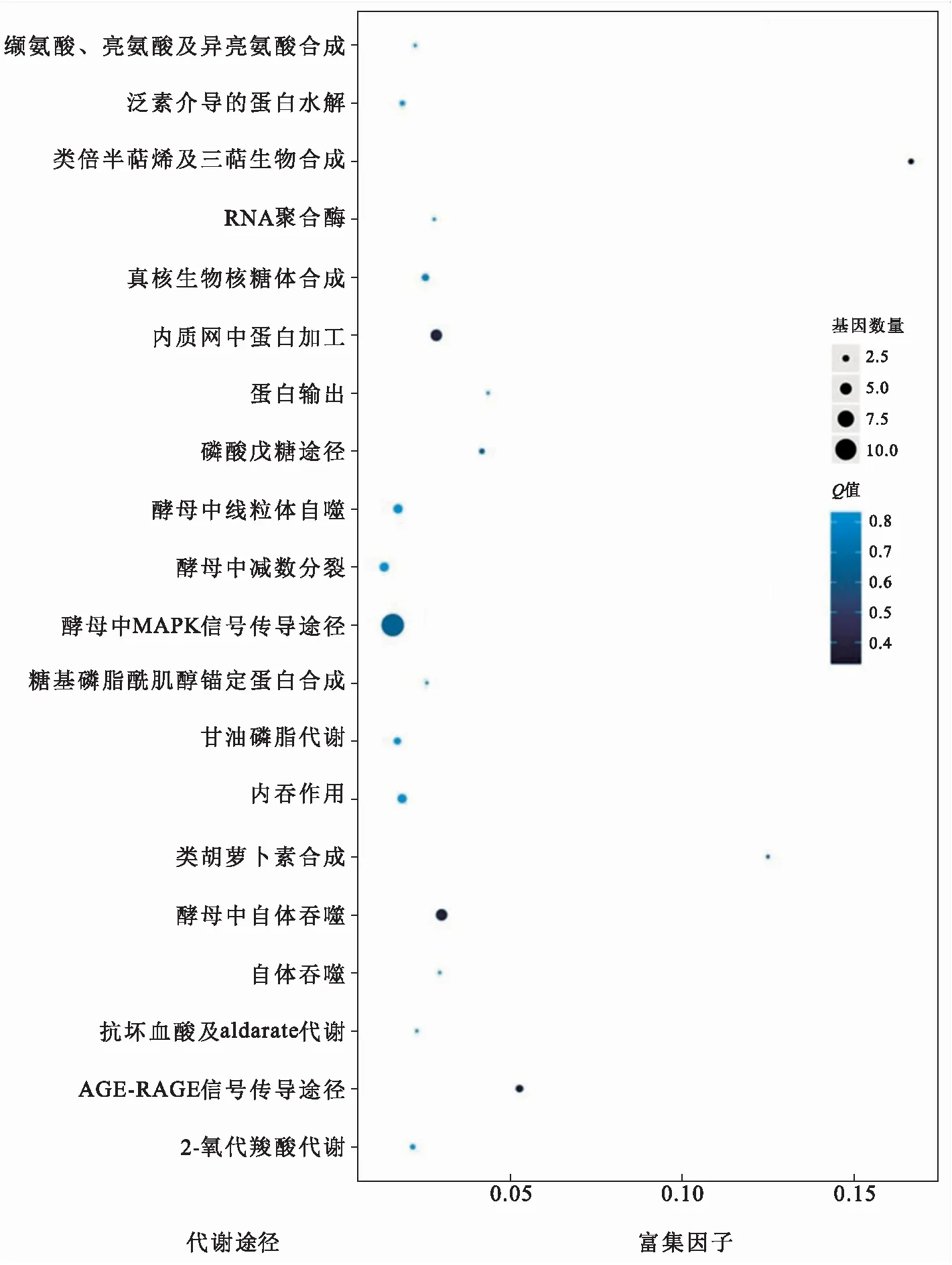
富集因子表示sRNA的靶标基因位于该代谢途径的基因数目与所有有注释基因中位于该条目基因总数的比值.富集因子值越高,表明富集程度越大.Q值是多重假设检验校正后的p值,越接近零,表示富集越显著.图6 miRNA靶标基因pathway富集统计Fig.6 Statistics of pathway enrichment of miRNA targets
3 讨论
锐顶镰孢菌作为一种常见致病菌,对农业生产具有重大的危害,早期的研究主要集中于该致病菌的生理特性、进化分类以及宿主的鉴定,而在分子水平的相关研究鲜有报道[25-27].本研究通过高通量小RNA测序,预测了11个新的miRNA和6 503个潜在的siRNA.
miRNA是一类长度在20~24 nt的小RNA,由具有发夹结构的单链RNA经Dicer酶加工而成,5’端具有磷酸基而3’端为羟基,每个miRNA可能有多个靶基因,多个miRNAs可以协同精细调节同一基因,其调控基因的主要方式有3种:第一种是与靶基因的mRNA互补结合并切割,第二种是与靶基因的mRNA部分结合阻遏靶基因的翻译,第三种是前两种方式的结合[28-30].本研究中,检测到一个已知的miRNA为miR-466i-5p,其功能主要与人类的疾病相关,在真菌中还未见该miRNA的相关报道.Liao等发现该miRNA能够与miR-466K和长链非编码RNA Kcnqlotl结合,提高调控转录因子Tead1的表达,诱发低氧引起的心肌细胞损伤[31].Wang等发现环磷酰胺处理后,SP+肺癌细胞中miR-466i-5p表达显著上升,表明该miRNA与肺癌细胞的增殖密切相关[32].本实验共预测到miR-466i-5p靶基因152个,其中29个具有明确功能,包括GTPase、transcription factor、transporter、reductase、coenzyme A、transferase、kinase、dehydrogenase、ATPase、epimerase等,涉及多种代谢途径,表明miR-466i-5p对病原菌的生长发育具有重要的意义.此外新发现的11个miRNA中,根据序列信息及结构,novel_mir2、novel_mir3、novel_mir4以及novel_mir11也预测到了潜在靶标,通过生物信息学分析,这些miRNA的靶基因多定位于细胞膜组织,具有催化或结合活性,主要与代谢相关.siRNA是一类细胞内被RNaseⅢ(Dicer)切割成长度为20~25 bp的双链RNA,具有两个突出核苷酸的羟基化3’末端和磷酸化5’末端.siRNA首先会与其他蛋白质形成RNA诱导沉默复合物(RISC),正义RNA被内切核酸酶切割,保留的反义链将与其互补的靶mRNA结合并诱导mRNA切割,导致mRNA降解进而沉默靶基因.已知的siRNA主要通过RNA干扰的方式调控目标基因的表达[33-35].本研究在F.acuminatum细胞中共预测了6 503个潜在的siRNAs,长度集中于19~24 nt,已有数据对其碱基偏好性进行了评估,但这些siRNAs的具体功能和作用机制有待进一步探讨.
本研究结合miRNA和siRNA预测结果以及大量的未注释及其他类型的sRNA,较为全面地探讨了F.acuminatum细胞内sRNA的组成、长度分布、碱基偏好性、分类和潜在的调控靶标,为今后研究F.acuminatum侵染结构形成、致病因子产生、定殖以及扩散等特定过程的时序性调控提供了理论基础,有助于农业生产中合理有效防治F.acuminatum引起的病害.

第21卷第4期2022年7月杭州师范大学学报(自然科学版)Journal of Hangzhou Normal University(Natural Science Edition)Vol.21 No.4Jul. 2022
