PDK1调控小鼠心脏流出道发育形成并协同Nkx2.5调节房室轴形成的作用
2022-07-23罗红梅杨中州单丛佳
罗红梅 杨中州 单丛佳
1.广东医科大学生理科学实验室,广东东莞 523808;2.南京大学模式动物研究所,江苏南京 210028
磷酸肌醇依赖性蛋白激酶-1(phosphoinositidedependent protein kinase-1,PDK1)为63 kD 的蛋白分子,是体内重要的激酶,调节多条信号通路蛋白磷酸化, 参与诸多细胞因子信号由细胞外向细胞内转导。PDK1结构包括C-端的PH 结构和N-端的催化结构,其第241 位的蛋白分子可自身磷酸化,其他位点例如第9、373/376 位点的蛋白分子也可以被磷酸化,磷酸化后的PDK1被激活[1-2]。PDK1被证明参与心脏发育和结构功能维持的调控, 生殖细胞水平敲除PDK1导致由神经脊细胞来源的组织发育缺陷, 例如没有前脑、鳃弓和心脏等的发育[3]。 用不同的cre 条件性地敲除小鼠心脏中的PDK1, 心脏发育表现出不同的时空差异, 也就是说在不同的时间和不同的心脏部位敲除PDK1,小鼠心脏发育出现不同的表型。 例如用Tie2-cre 敲除内皮细胞中的PDK1,小鼠在胚胎期第11.5 天死亡,小鼠心脏房室轴(artrioventricular canal,AVC)明显发育不良[4]。 用Mef2c-cre 敲除心脏中第二心场(second heart field,SHF) 的PDK1, 小鼠在胚胎期第14.5 天死亡,心脏表现为右心室很小,室间隔缺损和流出道不分割[5-6]。 同源盒转录因子Nkx2.5是调控心脏发育的关键转录因子之一,研究表明Nkx2.5可通过调控MLC2V、N-myc、Tgfb-2、Fulin 等下游基因或者协同其他心脏转录因子GATA4,TBX1等调控心脏的生长发育和功能维持[7-8],PDK1是否受Nkx2.5的调控以及该调控在心脏发育中是否起作用, 目前尚无相关报道。 本研究用Nkx2.5-cre 条件性敲除小鼠心脏中的PDK1,探索研究Nkx2.5对PDK1调控的时空差异,以及与先天性心脏病的关系。
小鼠心脏(outflow tract,OFT)、AVC 以及瓣膜的形成大致经历三个阶段,心胶组织的形成,心内膜垫的形成和瓣膜成熟[7],小鼠心胶组织从胚胎第9.5 天开始生长发育,由心管(也称第一心肠,first heart field,FHF)内、外两层之间的心内膜细胞分泌的含有丰富糖蛋白的物质形成[9-10]。 接着心胶组织内迁入大量的细胞形成心内膜垫,迁入的细胞有第二心场来源的心内膜细胞(endocardium cell,ECC)、内皮细胞(endothelial cell,EC)和神经脊细胞(neural crest cell, NCC)来源的上皮细胞间质转型(epithelial-mesenchymaltransition,EMT)细胞[11]。最后,心内膜垫进一步地重塑发育形成AVC、OFT, 在AVC 中形成二尖瓣和三尖瓣,在OFT 中形成半月瓣,这些组织的形成保证了血液在心脏中的正确流动方向。
1 材料和方法
1.1 实验材料
1.1.1 主要仪器和试剂 体视学显微镜(Nikon),组织切片机(Laica),石蜡包埋机(Laica),PCR 仪(Eppendorf),高速离心机(Eppendorf),无水乙醇(上海化学试剂厂),95%酒精(上海化学试剂厂)。
1.1.2 小鼠基因型背景 PDK1flox 小鼠,由英国Dundee大学的Alessi 实验室提供,Nkx2.5-cre 小鼠, 由美国Moses 实验室提供。
PDK1flox 小鼠在PDK1第2 个外显子后面和第5个外显子前面分别插入了一个flox 片段,野生型PDK1+/+和杂合型PDK1+/F小鼠,PDK1活性较高, 而PDK1F/F型小鼠,PDK1活性明显降低,只有野生型的10%,全敲型PDK1-/-小鼠,PDK1活性几乎为零[3]。 PDK1F/F小 鼠PDK1活性虽然较低, 但仍然能正常生长发育和存活(图1A)。 Nkx2.5-cre 小鼠在Nkx2.5的一个等位基因(Allele)的第二个外显子中敲入了一个cre 基因,因此该等位基因结构被破坏[12](图1B),此基因型小鼠也能正常生长发育和长期健康存活。

图1 PDK1、Nkx2.5-cre 小鼠基因背景示意图
1.2 实验方法
1.2.1 小鼠配繁过程 将1 只PDK1flox 雌性小鼠和1只Nkx2.5-cre 雄性小鼠进行交配,获得第一代子鼠,在小鼠出生后第7 天,剪取一段尾巴进行基因型鉴定。 等第一代子鼠长大性成熟后,用第一代PDK1F/+雌性子鼠与PDK1F/+,Nkx2.5-cre 雄性子鼠进行交配,获得第二代子鼠,对第二代子鼠进行基因型鉴定和心脏表型分析。用PCR 对PDK1flox 和Nkx2.5-cre 的基因型进行鉴定,PDK1正向引物:5′-TGTGCTTGGTGGATATTGAT-3′,反向引物:3′-AAGGAGGAGAGGAGGAATGT-5′。Nkx2.5-cre用cre 通用引物进行鉴定。
1.2.2 第二代子鼠心脏表型分析过程 在小鼠出生第1天,用断头的方式处死小鼠,并在显微镜下打开胸腔取出心脏, 取心脏操作在4℃的PBS 溶液中进行,心脏取出后将血清洗干净,在1.7 倍的显微镜下观察心脏的形态并拍照。同时剪取一段小鼠尾巴放入组织消化液中进行消化,提取消化液中的总DNA,用PCR 对小鼠进行基因型鉴定。 将拍照后的心脏放入4℃的4%多聚甲醛中固定24 h,第2 天用75%,85%,95%,100%的酒精进行梯度脱水,每个浓度各1 h,然后用酒精二甲苯混合液(1∶1)浸透30 min 2 次,最后进行石蜡包埋、切片、HE 染色,染色后在2.5 倍显微镜下观察并拍照。
1.3 观察指标
观察指标包括两个方面,①各代小鼠的基因型和例数,②第二代子鼠的心脏表型,心脏表型重点观察了心脏OFT、AVC 和四个腔室的结构。
2 结果
2.1 小鼠基因型、各基因型小鼠数量及表型
第一代子鼠分娩1 窝,共获得7 只小鼠,基因型有PDK1F/+;PDK1F/+,Nkx2.5-cre 两种。 第二代子鼠分娩4窝,共获得了35 只小鼠,基因型有PDK1F/F;PDK1F/F,Nkx2.5-cre;PDK1F/+;PDK1F/+,Nkx2.5-cre;PDK1+/+;PDK1+/+,Nkx2.5-cre 六种,小鼠存活到出生,具体基因型和只数情况见表1, 心脏表型分析显示3 只PDK1F/F,Nkx2.5-cre 小鼠均观察到肺动脉狭窄。 另外,1 只PDK1F/+,Nkx2.5-cre 小鼠观察到心脏无AVC 轴发育,OFT 只有一条永存动脉干,1 只PDK1+/+小鼠也观察到心脏无AVC 轴发育,且只有一个心室。
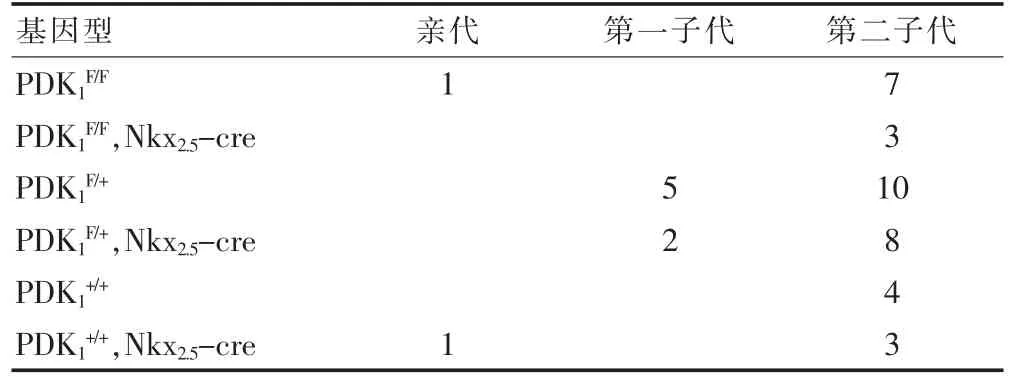
表1 各代小鼠的基因型和获取例数情况表(只)
2.2 小鼠心脏表型
2.2.1 PDK1全敲小鼠心脏表型 PDK1F/F对照鼠心脏表型正常,OFT 和AVC 轴发育正常,主动脉和肺动脉管径大小基本相同,有四个完整发育的腔室,两心房和两心室(图2A~C)。PDK1全敲小鼠PDK1F/F,Nkx2.5-cre,心脏表现为明显的肺动脉狭窄,主动脉和肺动脉管径比大约为3∶1(图2D~F、G~I),肺动脉瓣没有分割(图2I), 以及出现肺动脉瘤 (图2J~M)。 虽然PDK1F/F,Nkx2.5-cre 小鼠的OFT 发育明显异常, 但是四个腔室却发育正常。
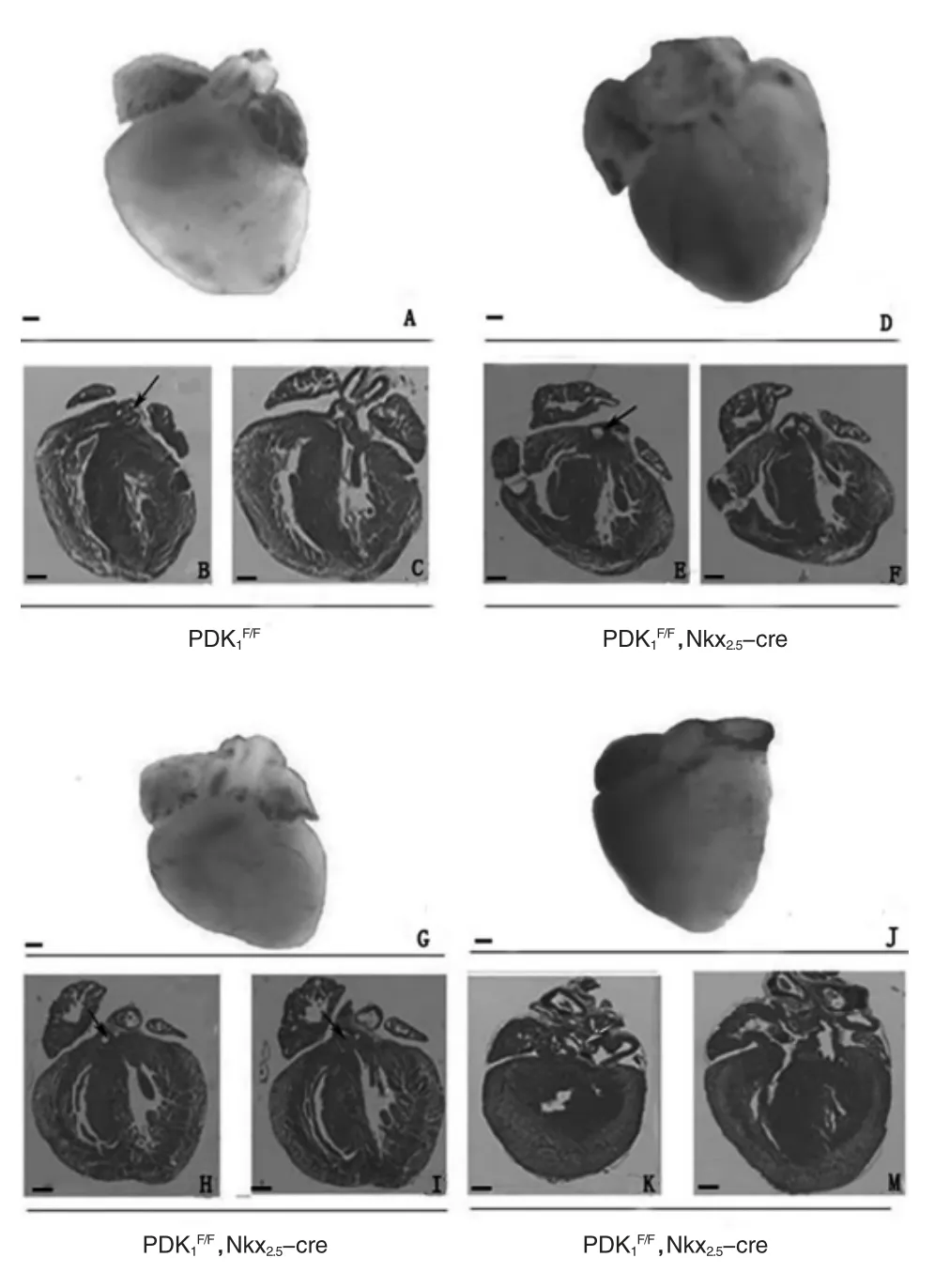
图2 Nkx2.5-cre 敲除小鼠心脏PDK1 的心脏表型
2.2.2 PDK1敲除协同Nkx2.5损伤小鼠心脏表型 PDK1F/F对照鼠心脏发育正常(图3A、B)。 PDK1F/+,Nkx2.5-cre 小鼠中观察到心脏发育成两个心房和两个心室四个腔室,但没有AVC 轴发育将其分割开,OFT 是一条永存动脉干,没有分离成主动脉干和肺动脉干(图3C、D)。 在PDK1+/+小鼠中,观察到心脏发育成两个心房和一个心室,也没有AVC 轴发育将三个腔室分隔开(图3E、F)。

图3 PDK1 敲除协同Nkx2.5 损伤的心脏表型
3 讨论
PDK1在心脏组织中高度表达, 对心脏的胚胎发育和出生后心脏结构功能的维持起重要作用,如在小鼠胚胎期将其敲除,PDK1-/-基因型小鼠心脏发育异常,而PDK1+/-、PDK1+/+基因型小鼠心脏发育正常,说明只有将两个等位基因全部敲除或者破坏,心脏表型才出现异常。本实验用PDK1flox 小鼠与Nkx2.5-cre 小鼠配繁, 在第二代子代中获得PDK1F/+;PDK1F/+,Nkx2.5-cre;PDK1+/+;PDK1+/+,Nkx2.5-cre;PDK1F/F;PDK1F/F,Nkx2.5-cre 六种基因型小鼠。 其中PDK1F/F,Nkx2.5-cre 小鼠心脏的PDK1全部被敲除, 实验中获得的三只PDK1F/F,Nkx2.5-cre 小鼠均观察到肺动脉狭窄的表型, 表现为肺动脉管腔狭小,肺动脉瓣不分割,还出现肺动脉瘤。PDK1是一个关键性的激酶, 调控PI3K-PDK1-AKT,GSK3-CATENIN,S6K-S6 等信号通路的信号转导[13-14],PDK1敲除导致这些通路中的某些因子蛋白表达水平和磷酸化水平发生变化,从而影响细胞的增殖、分化、生长和迁移,导致心脏的胚胎发育和出生后生长受到影响。Feng 等[4]证明PDK1敲除可使AKT308、GSK3β9的磷酸化水平明显降低, 这是导致细胞EMT 能力降低的主要因素,是导致心脏AVC、OFT 发育受阻的主要原因。 PDK1敲除也明显降低S6K389,S6235/236 的磷酸化水平,这是导致心脏细胞体积变小的原因[15-16],因此在出生后小鼠中敲除PDK1,小鼠心脏体积变小,心脏壁变薄[17]。 用Nkx2.5-cre 敲除PDK1,小鼠心脏主要表现为OFT 和AVC 轴发育畸形, 表明Nkx2.5对PDK1的调控主要发生在OFT、AVC,对心房、心室的发育无影响。用Nkx2.5-cre 敲除PDK1只表现为肺动脉狭窄,主动脉发育正常,应该与它们的形成成熟时间有关,主动脉形成成熟较早,在胚胎第12.5 天已经基本发育成熟,而肺动脉形成成熟较晚,到胚胎第16 天才完全成熟,Nkx2.5介导的PDK1敲除发挥作用时,主动脉已经发育成熟,而肺动脉正处在发育阶段,所以只表现为肺动脉发育缺陷[5]。
实验中观察到两个个案小鼠,其中一只PDK1+/+小鼠心脏没有AVC 轴发育,有两个心房和一个心室。另外一只PDK1F/+,Nkx2.5-cre 小鼠也没有AVC 轴发育,但有两个心房和两个心室,OFT 没有分离。 分析其原因,可能与Nkx2.5-cre 小鼠有关,因为该小鼠一条染色体上的Nkx2.5基因的外显子2 中敲入了cre,cre 基因的敲入破坏了Nkx2.5,使Nkx2.5活性受到了影响,从而导致心脏发育畸形。 如前所述,如果只是其中一个等位基因被破坏(杂合突变状态),小鼠能正常发育和长期生存(实验室长期保留有该小鼠),但如果两个等位基因都被破坏(纯合突变状态),心脏发育可能出现畸形。 Lyons 等[18]报道Nkx2.5突变小鼠有两个心房,只有一个心室,且没有AVC 轴的发育,与本研究观察到的表型相同,因此PDK1+/+个案中有可能是Nkx2.5两个等位都被破坏了。PDK1F/+,Nkx2.5-cre 个案小鼠,其心脏表型与PDK1+/+个案小鼠不一样,在这例小鼠中PDK1、Nkx2.5可能都是杂合突变状态,当它们都被部分敲降后AVC 轴和OFT 不能正常发育,PDK1可能协同Nkx2.5调节心脏AVC 轴的发育。这是从小鼠的基因背景和心脏表型推断得出的可能原因, 探究其根本原因还需要进行全基因组系列测定才能确定。鉴于以上原因,为了在第二子代中能高效稳定地获得PDK1全敲小鼠,第一子代的正确配繁方法是,用纯正的非Nkx2.5-cre 子代PDK1F/F雌性小鼠与PDK1F/+,Nkx2.5-cre雄性小鼠交配。
Nkx2.5是心脏发育中的重要调控因子,Nkx2.5通过调节下游基因的程序性表达或者协同其他转录因子调节与DNA 的结合, 调控心脏的生长发育和结构功能的维持。 动物实验和临床研究表明Nkx2.5的突变在先天性心脏病发病中起重要的作用,Nkx2.5突变对心脏发育的影响在小鼠实验和人类病例报告存在差异,通过基因突变手段得到的突变小鼠,Nkx2.5+/-杂合状态下小鼠心脏的表型是正常的,只有在Nkx2.5-/-纯合突变状态下心脏表型才出现异常,且一种突变表型基本一致[18-19]。 但是在人类中,Benson 等[20]报道Nkx2.5突变导致的心脏病属于常染色体显性遗传,在杂合状态下也出现表型,在被调查的四个家族心脏病患者中,Nkx2.5基因突变形式多样,心脏的表型也各不相同。 国内临床病例报道,有的报道Nkx2.5突变与先天性心脏病有关联[21-22],有的报道与先天性心脏病无明确相关[23-25],综合国内外病例报道,Nkx2.5突变与人类先天性心脏病应该存在关联。本研究结果推断,Nkx2.5功能的缺失可导致心脏发育畸形,PDK1可能是Nkx2.5的下游基因,Nkx2.5对PDK1的调控参与了心脏的生长发育。
综上所述,PDK1是调控小鼠心脏OFT 发育的重要因子, 参与了调控心脏流出道的胚胎发育成熟,也可能协同Nkx2.5调节心脏AVC 轴的发育。
