获能前后水牛精子的差异蛋白质组分析
2022-07-23刘润峰黄星晨杨潍菡张俊俊
刘润峰,候 振,黄星晨,肖 凯,杨潍菡,张俊俊,付 强
(广西大学 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004)
广西沼泽性水牛是南方重要役畜,具有体质强 健、耐粗饲、乳肉生产开发潜力大、适应性强、繁殖率较低等特点。哺乳动物的精子发生过程由多个因素同时调控精子成熟[1],受到各种内源或外源因素的影响,哺乳动物的生精过程停滞在任何阶段,都可能导致精卵结合异常[2]。精子获能作为精卵结合的重要前提之一,对水牛繁育率有着极大影响。精子在附睾时已经具有受精能力[3],但精子获能成熟受到了附睾中去能因子抑制[4]。当精子穿过雌性生殖道,去能因子作用被消除,经宫颈管进入子宫腔及输卵管腔时,精子头部的糖蛋白被生殖道分泌物中的α、β 淀粉酶降解,同时顶体膜结构中膜电位和脂质发生变化,降低顶体膜稳定性,精子此时具备了与卵子结合的能力,这就是精子获能[5]。精子成熟的标志之一是精子获能[6]。
近年来,基于液相色谱质谱联用技术(LC-MS/MS)对蛋白质和肽段的分离鉴定技术发展迅速,它能够解决双向电泳技术的缺陷,提高蛋白质分离范围,避免人为误差。通过串联质谱标签(Tandem mass tags,TMT)定量技术进行高通量、高精度的全蛋白质组定量分析,是多样品定量分析很好的选择[7]。蛋白质组学已被广泛应用于哺乳动物精子获能研究[8],并且发现一些蛋白质通过磷酸化去调节精子成熟过程[9]。LAVOIE-OUELLET 等[10]利用对硝基苯磷酸二钠(pNPP)检测免疫沉淀精子蛋白磷酸酶EF 手性钙结合域1(Protein phosphatase,EF-hand calcium binding domain 1,PPEF1)的磷酸酶活性,首次证明了PPEF1 在精子和睾丸生殖细胞中存在,揭示了精子获能、透明带结合和运动等生物学过程的关 系。 BAE 等[11]研 究 发 现,Ras 相 关 蛋 白(Ras-related proteins,Rab)是Ras单体G 蛋白超级家族的成员,在精子的头和尾部均表达,可以用作与生育相关的潜在生物标签,同时调节顶体外膜和质膜的连接。MALDERA 等[12]研究发现,人类附睾中半胱氨酸丰富分泌蛋白1(Cysteine-rich secretory proteins 1,CRISP1)是一种在受精过程中具有重要功能的蛋白质,通过与透明带精子结合蛋白3(Zona pellucida sperm-binding protein 3,ZP3)结合,参与精子与透明带融合的早期阶段。同时还可与介导精卵融合的结合位点分化抗原簇9(Cluster of differentiation antigen 9,CD9)相互作用,促进精卵融合,但具体机制仍需探究。
蛋白质是细胞功能和生命活动的重要载体,也是生物体内遗传信息表达的最后形式[13]。目前,在精子获能相关研究中,还有一些关键蛋白质未被发现和证实,获能前后水牛精子蛋白质组学差异的相关研究还很少。随着组学技术的快速发展,液质联用技术被越来越多应用于蛋白质的分离与鉴定中。鉴于此,采用TMT 标记结合LC-MS/MS 方法探究获能前后水牛精子的蛋白质组学差异,分析获能前后表达量差异的蛋白质,并对这些蛋白质进行信息挖掘和功能探究,为研究水牛的雄性生殖机制提供参考。
1 材料和方法
1.1 水牛精液
广西沼泽型水牛的精子样本来自广西畜禽品种改良站。
1.2 主要试剂及仪器
1.2.1 主要试剂 胰蛋白酶(Trypsin)、二硫苏糖醇(DTT)、硫脲(Thiourea)、蛋白酶抑制剂(Protease inhibitor)、CHAPS 均购自Sigma 公司;BCIP/NBT 碱性磷酸酶显色试剂盒购自碧云天生物科技有限公司 ;甲 酸(Formic acid,FA)、三 氟 乙 酸(Trifluoroaceticacid,TFA)、丙 酮(Acetone)、乙 腈(Acetonitrile,ACN)、TMT 标 记 试 剂 盒 均 购 自Thermo Fisher Scientific 公 司;VAMP4 抗 体 购 自Abcam 公司;APOC3 及β-actin 内参抗体购自Bioss公司。
1.2.2 主要仪器 液质联用仪Easy-nano LC-MS/MS(LTQ-Orbitrap Elite)购 自 Thermo Fisher Scientific公司。
1.3 精子获能处理
将水牛鲜精于4 ℃下2 000 r/min 离心10 min,PBS重悬精子沉淀制成精子悬液。Percoll离心精子悬液去除低活力精子,将精子浓度调为5×106个/mL,分为均等2份即获能组和对照组。获能组在平衡获能培养基(0.48 mg/mL 咖啡因,10 mmol/L 肝素,pH值7.5~7.8)孵育1 h。移入新的离心管,吹打混匀,计算机辅助精液分析系统(Computer aided semen analysis,CASA)计算精子活力。另取出100 μL加入钙离子载体A23187,在培养箱中继续培养30 min观察顶体反应。其余上清液于1 500 r/min离心5 min,弃去上清液备用。将获能组和对照组精子各取10 μL涂板,考马斯亮蓝染色,封片后观察。
1.4 总蛋白质提取及浓度测定
在对照组和获能组精子沉淀中加入适量的细胞裂解液,振荡重悬。冰浴超声破碎30 min(每30 s间歇1 min)。4 ℃静置2 h 后,向收集的上清液中加入4倍体积丙酮。-20 ℃沉淀蛋白质,过夜后于4 ℃下12 000 r/min离心30 min,预冷丙酮洗沉淀3次,室温自然干燥后,加裂解液复溶,SDS-PAGE检测样品蛋白质。采用Bradford 法定量复溶后的蛋白质溶液,并绘制标准曲线。将样品放于冰箱-80 ℃保存备用。
1.5 蛋白质酶切和TMT标记
取获能前后的精子蛋白质样品各100 μg,加入45 μL 100 mmol/L 的TEAB 溶液复溶,加入5 μL 200 mmol/L的TCEP,于55 ℃恒温孵育1 h还原蛋白质二硫键,再加入5 μL 375 mmol/L 的碘乙酰胺溶液,避光静置30 min。加入6倍体积预冷丙酮,-20 ℃过夜后于4 ℃下8 000 r/min 离心30 min,再加入100 μL 100 mmol/L TEAB 复溶,加入2.5 μg 胰蛋白酶,37 ℃恒温孵育16~24 h,使精子蛋白质酶切成肽段。酶解结束后,按照TMT 试剂盒的说明,将TMT 标签分别加入上述肽段中标记,其中,未获能精子(对照组)标签为TMT-112,获能精子(获能组)标签为TMT-113。将标记后样品等体积混合,真空抽干。
1.6 肽段预分离与纯化
在标记后的肽段中加入90 μL A 液(2%ACN,pH 值10.0)复溶,使用毛细管反向色谱柱(XBribge C18,Waters公司)进行肽段预分离。流速0.5 mL/min,流动相B液成分为98%ACN(pH 值10.0),洗脱梯度设置为:0~10 min,100% A 液;10~55 min,0%~35%B液;55~65 min,35%~100%B 液。将洗脱产物收集并合并成8 个馏分,用脱盐吸头(Ziptip C18,Millipore公司)对样品进行脱盐处理。
1.7 LC-MS/MS分析
上述馏分用A 液(5%ACN 溶液,0.1%FA)复溶后用于LC-MS/MS 质谱鉴定,色谱柱使用PepMap100 C18 柱(Thermo Fisher 公司),流速300 nL/min,B液(95%ACN溶液,0.1%FA)梯度设置:0~3 min,2%~15% B;3~23 min,15%~20% B;23~53 min,20%~32% B;53~57 min,32%~98% B;57~60 min,98% B。质谱方法:一级质谱分辨率设为70 000,质子数和电荷数的比值(m/z)为300~1 800;二级质谱分辨率设为17 500,归一化碰撞能量为35%,m/z 为445.120 0。采用Proteome Discoverer 2.0软件检索数据,检索使用的数据库为Bos Taurus Uniprot数据库。
1.8 数据检索与生物信息学分析
定量差异倍数阈值为≥1.2 或≤0.83 时选取为差异表达蛋白质(Differential expression proteins,DEPs),使用T检验筛选具有显著性差异(P<0.05)的蛋白质。 通过DAVID 软件进行GO(Gene ontology)分析,分别是生物学进程、细胞组分和分子功能。通过KEGG 在线数据库对DEPs 参与的信号通路进行分析,利用STRING 10.0 软件分析蛋白质互作网络,采用Cytoscape 软件绘制蛋白质互作网络。
1.9 Western blot验证
将筛选的差异蛋白质进行Western blot 验证。用SDS-PAGE 凝胶电泳分离获能和非获能精子的等量蛋白质(30 μg),用转膜仪(Bio-Rad 公司)将蛋白质转移到聚偏二氟乙烯膜上,转膜后置于脱脂牛奶中,于摇床上封闭2 h,而后分别加入VAMP4 抗体、APOC3 抗体和β-actin 内参抗体,4 ℃孵育过夜。随后,用TBST 缓冲液清洗4 次,二抗孵育,显色成像。
2 结果与分析
2.1 水牛精子获能鉴定分析
通过钙离子诱导的方法使获能组精子发生顶体反应。如图1 所示,对照组精子中的糖蛋白被考马斯亮蓝染成蓝紫色(图1A)。获能组精子由于顶体反应使顶体膜破裂,糖蛋白流失,精子头部呈现浅蓝色(图1B)。表明精子体外获能成功并发生顶体反应。
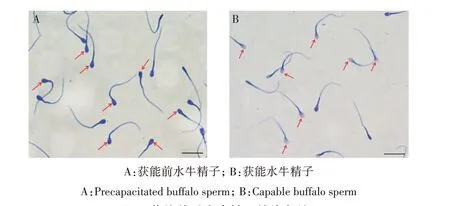
图1 获能前后水牛精子的染色结果Fig.1 Staining results of buffalo sperm before and after capacitation
2.2 获能前后水牛精子蛋白质鉴定信息
经TMT 标记后等体积混合,通过LC-MS/MS 分析,并进行2 次技术重复。结果显示,经2 次重复的韦恩分析,共采集到8 395 个Unique 肽,对应于1 461 种蛋白质。蛋白质组理化性质分析表明,水牛精子蛋白质分子质量主要分布在10~60 ku,等电点(pI)集中在5~8,主要是中性蛋白质,肽段覆盖率为14.13%,有31.10%的蛋白质含有专一性肽段(图2)。根据肽段数量统计,水牛精子中高丰度表达的蛋白质分别是外膜致密纤维蛋白2(Outer dense fiber protein 2,ODF2),激 酶 锚 定 蛋 白4(A-kinase anchor protein 4,AKAP4)、微管β4 蛋白(Tubulin beta-4B,TUBB4B)。
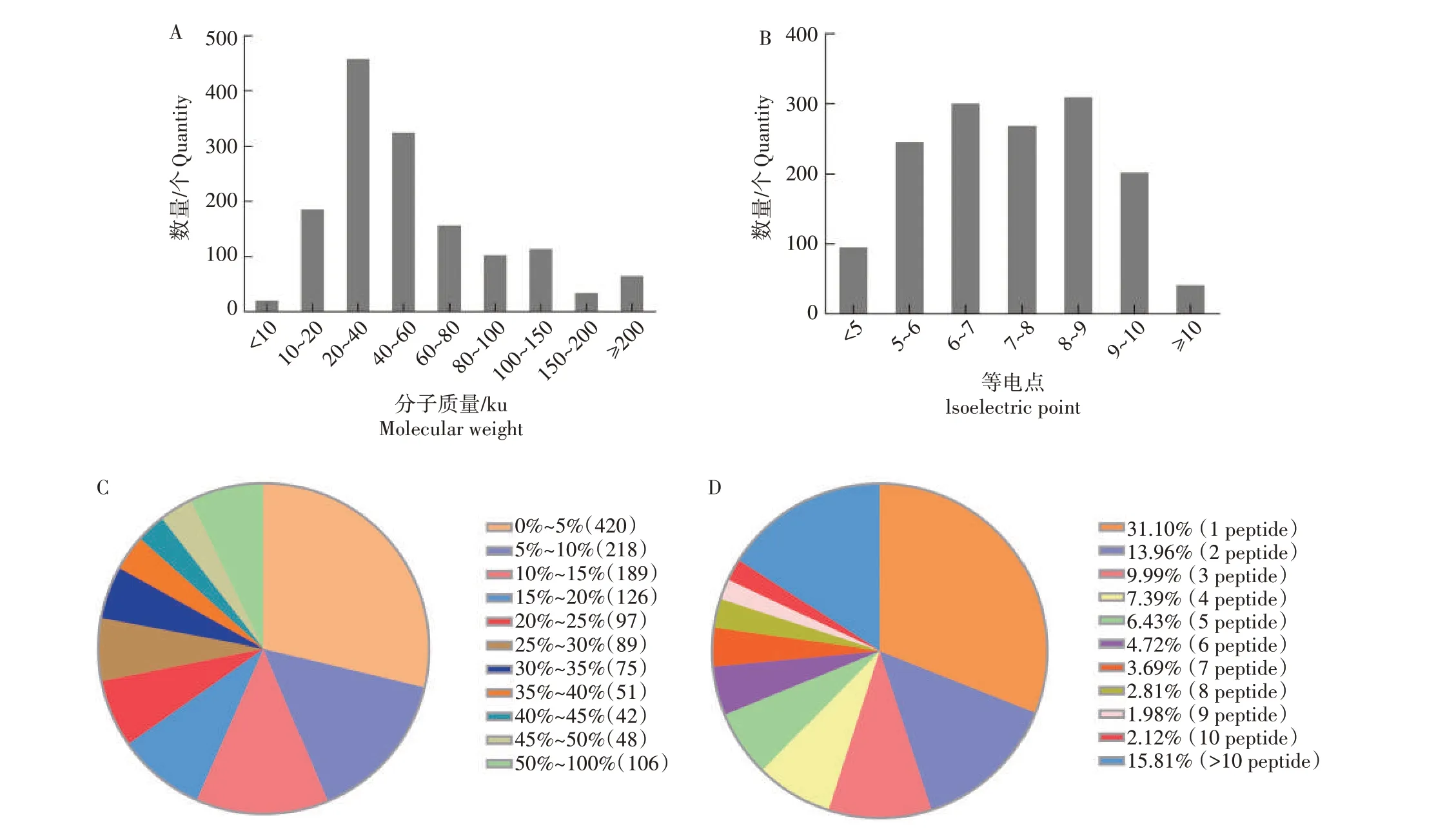
图2 获能前后水牛精子的分子质量(A)、等电点(B)、覆盖率(C)、专一性肽段比例(D)Fig.2 Molecular weight(A),isoelectric point(B),coverage rate(C)and proportion of unique peptide(D)in buffalo sperm before and after capacization
质谱共鉴定蛋白质数为1 461 个,标记效率98.6%,其中成功标记蛋白质数1 441 个。DEPs 阈值为≥1.2 或≤0.83,DEPs 数目为93 个,其中52 个显著上调,41个显著下调(表1)。
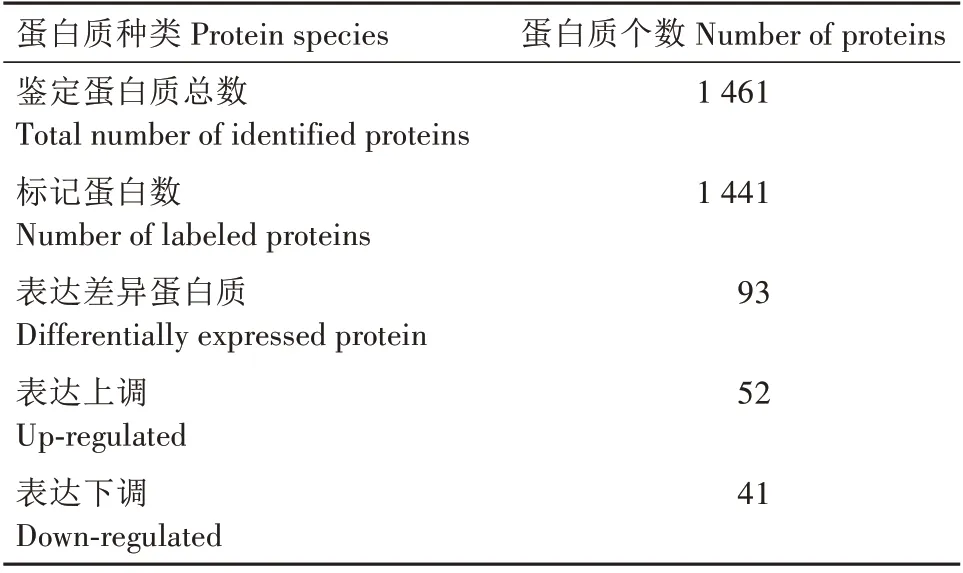
表1 获能前后水牛精子蛋白质质谱鉴定信息Tab.1 Identification information of protein mass spectrometry before and after buffalo sperm capacitation
2.3 获能前后水牛精子DEPs GO分析
使用DAVID 软件对DEPs 进行GO 分析,共有88 个蛋白质存在注释信息。从细胞组分(Cellular component)上看,有53个(56%)DEPs 定位在细胞质中。其中定位在囊泡和囊泡膜上的DEPs 有20 个(71%)表现为下调(图3A)。与细胞骨架有关的DEPs 中,12个下调,3 个上调。生物学进程(Biological processes)中也发现与细胞骨架有关的DEPs 明显下调。参与精子发生的9 个DEPs,上调4个,下调5个,其中2 个与精子获能有密切联系(图3B)。在分子功能(Molecular functions)中,参与钙调素结合蛋白质有3个下调蛋白质(图3C)。
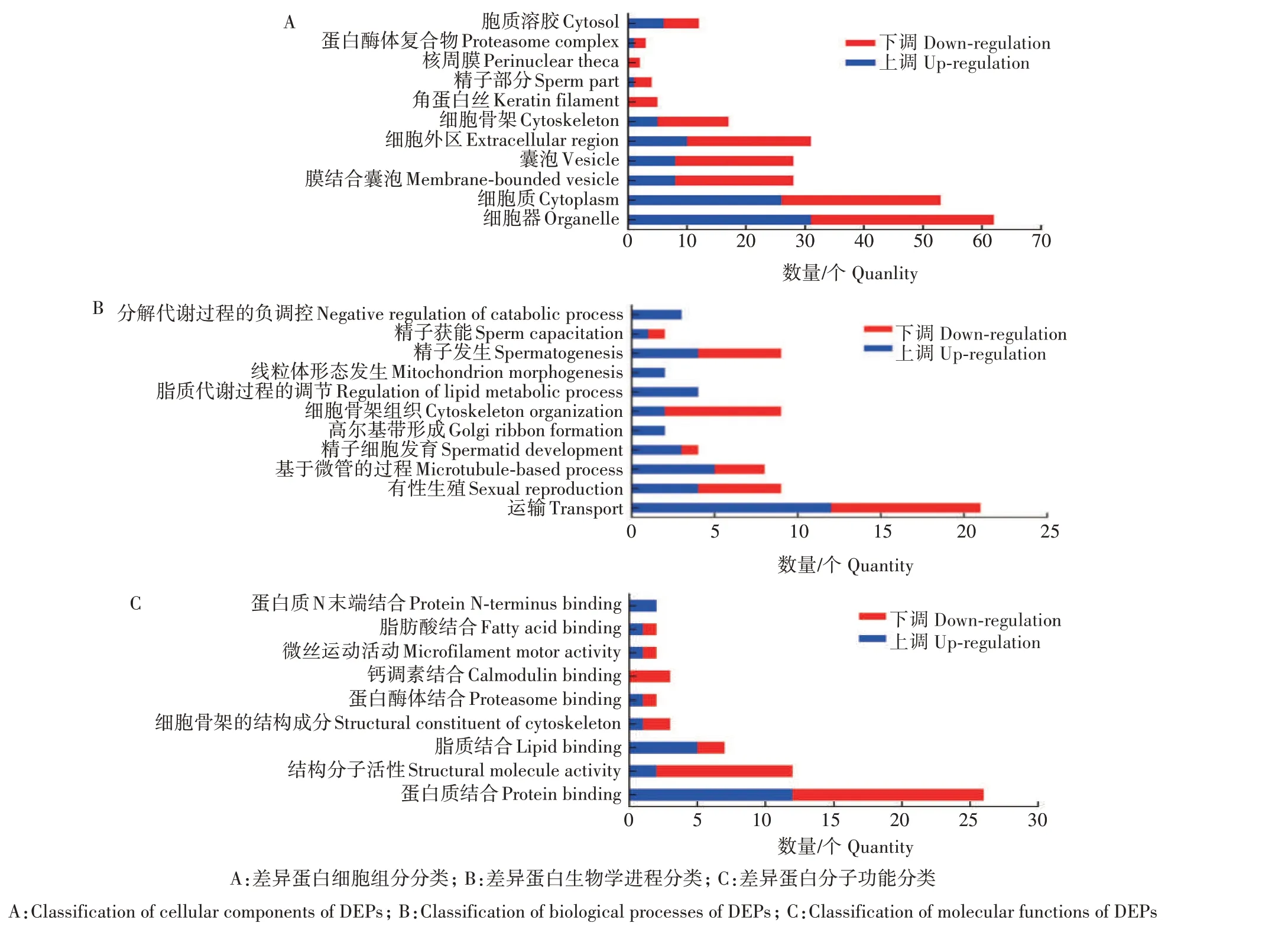
图3 获能前后水牛精子表达差异蛋白质GO分析Fig.3 GO analysis of differential expression protein in buffalo sperm before and after capacization
2.4 获能前后水牛精子DEPs KEGG通路分析
为了获得DEPs参与的信号通路,使用KEGG对DEPs 进行通路分析。KEGG 分析表明,DEPs 参与到56个相关的信号通路中,一些重要的信号通路如kinase muscle,CKM)与精子获能过程的能量代谢联系紧密。此外,还富集到2 个与精子获能有关的重要信号通路,即过氧化物酶体增殖物激活受体信号通 路(Peroxisome proliferators-activated receptors,PPAR)和可溶性NSF 附着蛋白受体(Soluble NSF attachment protein receptor,SNARE)信号通路,载脂蛋白C3(Apolipoprotein c-3,APOC3)参与PPAR信号通路,囊泡相关膜蛋白4(Vesicle associated membrane protein 4,VAMP4)参与SNARE 互作通路,结果表明APOC3 和VAMP4 可能在精子获能过程中发挥重要作用。
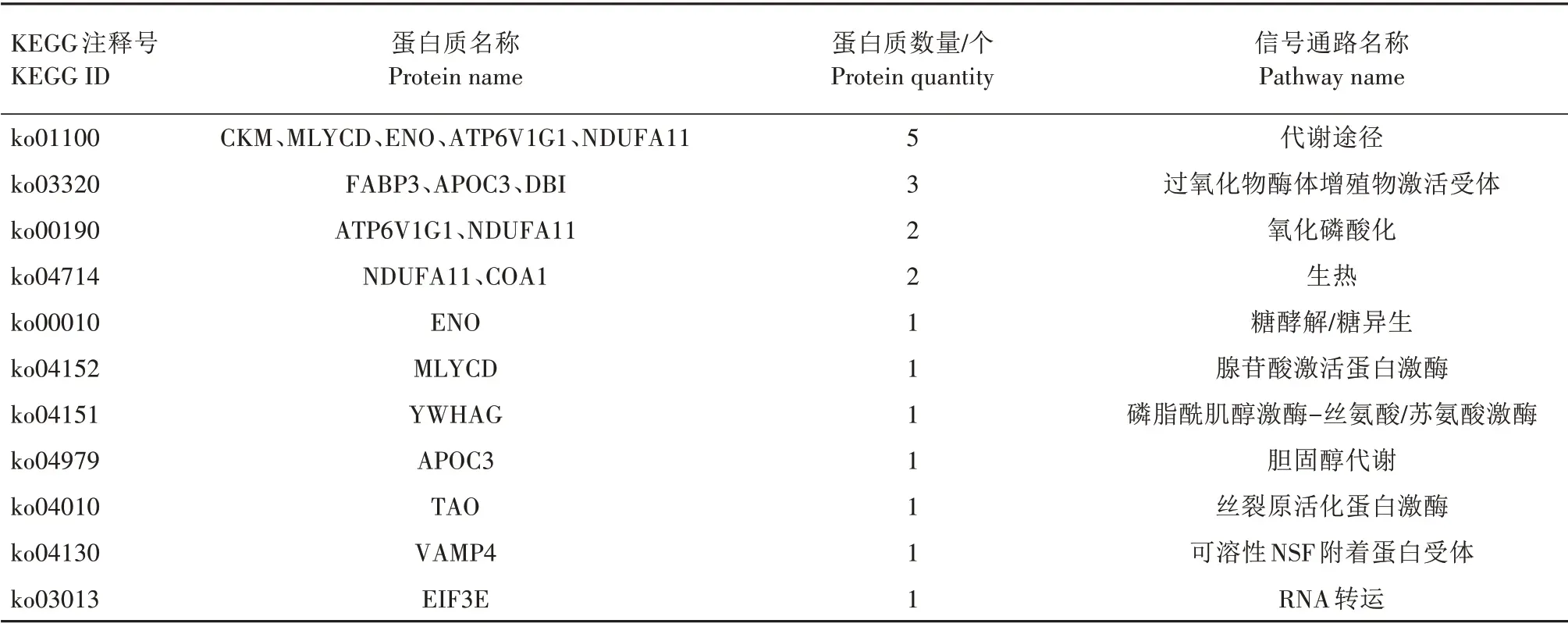
表2 获能前后水牛精子表达差异蛋白质KEGG信号通路Tab.2 KEGG signaling pathway of differential expression protein list in buffalo sperm before and after capacization
2.5 获能前后水牛精子蛋白质互作网络分析
水牛精子获能差异蛋白质互作网络(图4)分析结果表明,共有31 个蛋白质存在互作关系,节点度数(Degree)平 均 值 为 3.86,节 点 中 介 性(Betweenness)平均值39.5。根据平均值设置参数,制作互作网络,发现这些差异表达蛋白质与蛋白质磷酸化、代谢调节作用以及糖的无氧氧化有关。调节通路的中心蛋白(Hub)有拓扑异构酶2(Topoisomerase 2 alpha,TOP2A)、烯 醇 化 酶3(Enolase 3,ENO3)和烯醇化酶4(Enolase 4,ENO4),它们在维持互作网络的稳定性中起着中枢的作用。
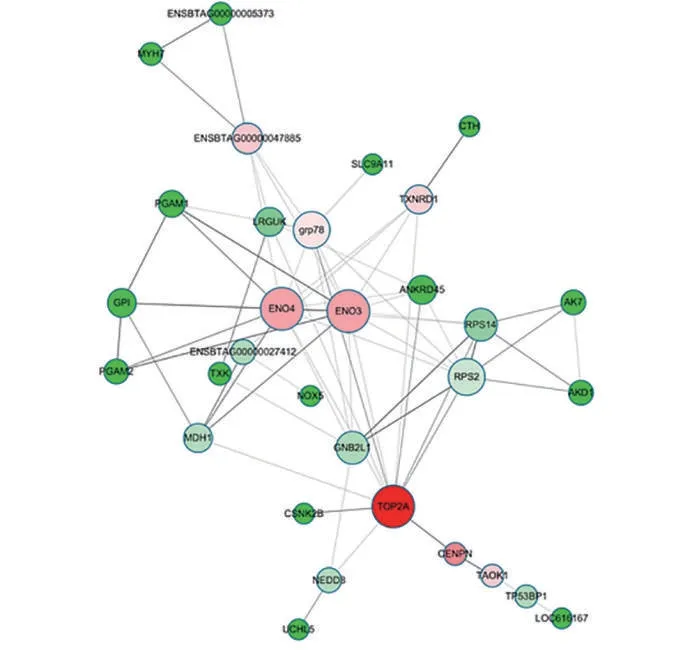
图4 获能前后水牛精子DEPs的相互作用网络Fig.4 The interaction network of DEPs before and after sperm capacitation in buffalo
2.6 获能对水牛精子APOC3和VAMP4表达量的影响
为了检验组学定量数据的可靠性,通过Western blot对VAMP4和APOC3的表达水平进行分析。如图5所示,VAMP4蛋白和APOC3蛋白均能检测到杂交信号,其中获能后精子中VAMP4 蛋白和APOC3 蛋白表达水平均显著高于未获能精子。Western blot 结果表明,VAMP4 和APOC3 在水牛精子的获能过程中表达量逐渐升高(图6)。在组学定量分析中,获能精子中的VAMP4 蛋白和APOC3 蛋白表达量高于未获能精子(图7)。

图5 获能对水牛精子APOC3和VAMP4表达的影响Fig.5 Effects of capacitation on the expression of APOC3 and VAMP4 in buffalo sperm
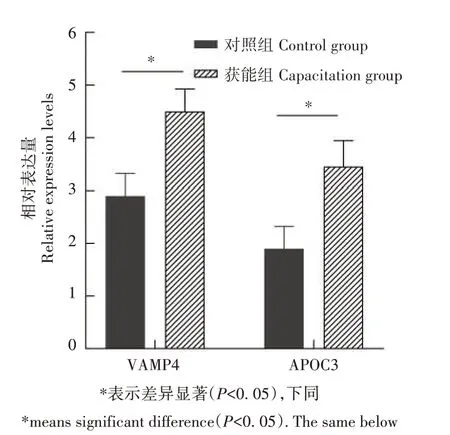
图6 获能前后水牛精子APOC3和VAMP4相对表达水平Fig.6 Relative expression of APOC3 and VAMP4 in buffalo sperm before and after capacization
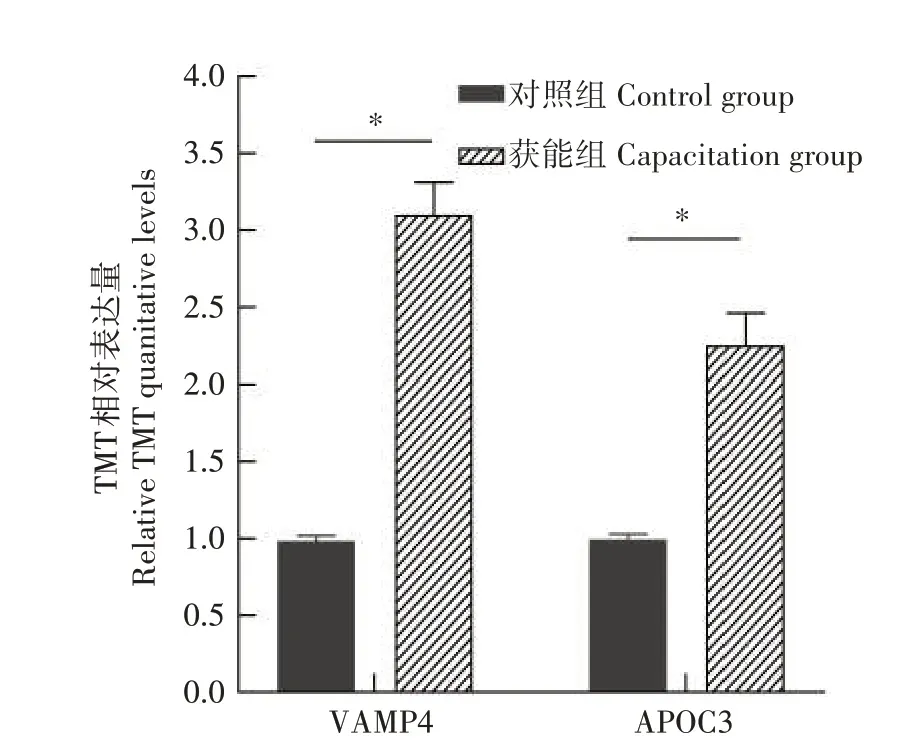
图7 获能前后水牛精子TMT标记定量结果Fig.7 Quantitative results of TMT labeling before and after buffalo sperm capacitation
3 结论与讨论
本研究通过GO 分析发现,获能前后水牛精子的DEPs 主要定位于细胞器与细胞质中。由于精子细胞核在受精前需要维持遗传信息的稳定性,因此精子细胞核中的蛋白质并不活跃[14]。受精时精子细胞核内核心组蛋白(H3、H3.3、H2B、H2A、H2AX 和H4)激活并与卵子相互作用[15],此时,细胞核内的蛋白质开始活跃。在KEGG 的分析结果中,APOC3 参与PPAR 信号通路,VAMP4 参与SNARE 信号通路。水牛精子获能后,APOC3 和VAMP4 的表达量增高,表明APOC3和VAMP4与精子获能密切相关。
APOC3 是肝脏和小肠分泌的一种与糖脂代谢有关的糖蛋白,在内质网中成熟[16],与脂质代谢疾病相关[17-18]。前人研究表明,血液中极低密度脂蛋白(VLDL)的代谢率会随着APOC3表达量的增高而降低[19]。在PPAR 信号通路中,APOC3 是脂质代谢重要的调控因子。本研究中,获能水牛精子组中APOC3 表达量上调,可能与精子在获能前后的代谢方式不同有关。精子获能过程需要大量能量维持其稳定性,脂质代谢产生的能量不足,需要其他代谢途径联合增加供能,APOC3 高表达抑制了获能时的脂质代谢(主要是VLDL 代谢)。而精子获能后,由其他代谢途径联合增加供能,具体分子机制还需要进一步研究。
VAMP4 是一种仅表达于脊椎动物反面高尔基网络(TGN)中的囊泡可溶性NSF 附着蛋白受体(Vesicle-SNAP receptor,v-SNARE)蛋白,在VAMP4缺失的情况下,高尔基体堆积正常,但高尔基体堆积长度缩短,其带状结构被破坏[20]。VAMP 与SNARE 复合体成员参与调节葡萄糖转运体(GLUT)介导的内吞作用,为体细胞提供能量。VAMP4在维持精子头部结构以及顶体反应中有重要作用[21],精子头部畸形率会随着VAMP4 表达量降低而增加,同时,顶体囊泡也会出现一定的破裂和异型,从而导致精子细胞核外露。VAMP4 在顶体反应中也具有一定的调控作用[22],在顶体反应中,顶体膜和顶体囊泡的结构完整性对于顶体膜与卵细胞膜之间的融合至关重要。此外,在鼬鲨的相关研究中发现,VAMP4 可能对精子的活力和数量有一定影响[23]。在本研究获能精子组中,VAMP4 表达量上调,推测VAMP4 可能在维持精子头部结构的稳定中发挥重要作用,并通过调节葡萄糖转运促进顶体反应的发生。
本研究通过差异蛋白质组学技术富集到一批与水牛精子获能有关的蛋白质。精子在获能时需要大量能量维持相关反应,同时,在顶体反应前也需要保持顶体的完整性,APOC3 作为脂质代谢的重要调控因子,与水牛精子获能时的能量代谢紧密相关;VAMP4对水牛精子顶体反应膜的融合与稳定具有重要作用。APCO3 和VAMP4 在水牛精子获能过程中起到重要作用,为在分子水平上全面揭示水牛精子的发育和成熟提供理论支持。
