羊口疮病毒感染对山羊皮肤成纤维细胞circRNA表达谱的影响
2022-07-23贵州大学动物科学学院贵州贵阳550025贵州省动物疫病与兽医公共卫生重点实验室贵州贵阳550025
庞 峰 (1.贵州大学 动物科学学院,贵州 贵阳 550025;2.贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025)
羊口疮 (orf) 又称为羊传染性脓疱 (contagious ecthyma),是由羊口疮病毒 (orf virus,ORFV) 引起的一种急性、高度接触性人畜共患病。该病主要感染绵羊、山羊等小反刍动物,人也可被感染[1-2]。我国多个省份均报道过该病的发生和流行,该病的暴发和流行严重危害我国养羊业的发展和人类健康[3-5]。
环状RNA(circular RNA,circRNA)是一类具有闭合环状结构、没有5′帽子和3′polyA 尾、耐RNA酶降解的内源性非编码RNA[6-8]。circRNA来源于mRNA前体的反向剪切,根据来源不同主要分为外显子circRNA(exonic circRNAs,ecircRNAs)、内含子circRNA(circular intronic RNAs ,ciRNAs)和外显子-内含子circRNA(Exon-Intron circRNA,EIciRNA)。circRNA广泛存在于多个物种,具有稳定性、保守性、组织和时空特异性[9-12]。越来越多的研究表明circRNAs在多种生物学过程如细胞增殖、分化、癌症发生、先天免疫中扮演着重要的角色[12-16]。此外,circRNA在病毒与宿主互作机制中发挥重要作用[17-19]。然而,circRNA在ORFV感染中的作用尚无文献报道。因此,本研究对ORFV感染的GSF 细胞进行circRNA测序,探索ORFV感染对GSF细胞circRNA表达谱的影响及差异circRNA在ORFV感染中的潜在功能,为ORFV致病机制研究提供新的线索。
1 材料与方法
1.1 试验材料GSF细胞购自中科院细胞库,羊口疮病毒ORFV-JS株由吉林省畜牧兽医科学研究院邵洪泽研究员惠赠。
1.2 主要试剂胎牛血清、高糖DMEM、Ambion mirVana miRNA Isolation Kit、RevertAid First Strand cDNA Synthesis Kit 均购自ThermoFisher Scientific 公司;Blood/Cell/Tissue Genome DNA Extraction Kit购自天根生化科技(北京)有限公司;pMD-19T载体购自TaKaRa公司;2×SYBR qPCR Mix 购自北京艾德莱生物公司;Green Taq Mix 购自南京诺唯赞生物公司;引物由生工生物工程(上海)股份有限公司合成;其他试剂均为分析纯。
1.3 RNA 提取待60 mm培养皿内GSF细胞达到90%聚合度,MOI=1接种ORFV-JS病毒(TCID50=106.2/mL),37℃吸附1 h 后,吸掉病毒液,加入细胞维持液,继续培养6 h。对照组不加病毒,换为细胞维持液,继续培养6 h。感染组 (OV) 和对照组 (GSF) 各3个生物学重复。参照Ambion mirVana miRNA Isolation Kit 说明书提取总RNA,-80℃保存。
1.4 去rRNA链特异性文库构建及测序样品总RNA 质检合格后,使用epicentre Ribo-Zero试剂盒去除核糖体RNA (rRNA) ,纯化回收的RNA被随机打断成短片段,以此为模板构建6个cDNA文库,文库质检合格后采用Illumina Hiseq4000 测序,测序读长为双端2×150 bp (PE150) 。
1.5 circRNA的鉴定将线性方式无法比对到山羊参考基因组(GCF_001704415.1)的reads使用TopHat-Fusion按照非线性方式继续比对。然后使用CIRCExplore 软件对比对上的reads从头组装,根据circRNA结构特征以及剪接序列特征鉴定circRNA。需满足以下条件:剪切位点两端必须是GU/AG;错配不大于2;Back-spliced junctions reads ≥ 1;2个剪切位点在基因组上距离 ≤ 100 kb。
1.6 circRNA 差异表达分析通过CIRCExplorer对circRNA进行预测,基于公司开发的脚本Scripts in house对不同样本或处理之间的circRNA进行差异统计。差异circRNA的筛选标准为:|log2(fold change)|≥1,P≤0.05。
1.7 差异circRNA的GO和KEGG富集性分析Gene Oncology总共有3个本体,分别描述基因的分子功能(molecular function)、细胞成分(cellular component)、参与的生物过程(biological process)。GO的基本单位是GO term。首先把所有差异circRNA的亲本基因向GO数据库(http://www.geneontology.org/)的各term映射,计算每个term的基因数目,然后应用超几何检验,找出与整个基因组背景相比,在显著性差异表达基因中显著富集的GO条目,其计算公式为:
其中,N为基因总数:n为N中差异表达基因的数目:M为注释为某特定GO term的基因数目:m为注释为某特定GO term的差异表达基因数目。P≤0.05定义为在差异表达基因中显著富集的GO term。差异circRNA的KEGG富集性分析与GO 富集分析类似,不再赘述。
1.8 差异circRNA的验证从差异表达circRNA中挑选相对高表达 (FPKM>10) ,且3个生物学重复中至少在2个样本中鉴定到的circRNA进行qPCR验证。以总RNA为模板,使用随机引物反转录得到cDNA,然后以cDNA为模板,使用divergent 引物扩增circRNA。以2-△△Ct法计算表达差异。GAPDH作为内部对照,每个试验做3次生物学重复。另外,分别以cDNA和基因组DNA(gDNA)为模板,使用divergent引物和convergent 引物进行PCR,PCR产物胶回收后连接到pMD-19T载体,送上海生工公司Sanger测序,鉴定circRNA的反向剪切位点。
1.9 统计分析使用Student’st检验进行显著性分析,P≤0.05 表示差异显著。
2 结果
2.1 测序数据统计数据下机后过滤掉接头序列和低质量原始序列,GSF组(GSF-1、GSF-2、GSF-3)和OV组(OV-1、OV-2、OV-3)分别平均得到83 697 556和91 192 170条有效reads (表1);6个样本的Q30均大于92%。GSF组和OV组平均有85.2%和86.7%的有效reads线性比对到山羊参考基因组(GCF_001704415.1),对无法线性比对到参考基因组的有效reads进行非线性比对,GSF组和OV组平均得到946 247条和843 165条back-spliced (反向剪切)reads。此外,将无法比对到山羊参考基因组的reads比对ORFV参考毒株NA1/11(KF234407.1),OV-1、OV-2、OV-3样本分别有125 619,165 878 和 157 779条reads 比对到ORFV NA1/11毒株基因组,而未感染的GSF组样本比对ORFV基因组的reads数接近为0。将原始数据和处理后的数据上传至NCBI的Gene Expression Omnibus 数据库 (https://www.ncbi.nlm.nih.gov/geo/),登录号为GSE121725。

表1 测序数据统计
2.2 circRNA鉴定及特征利用CIRCExplorer软件对6个样本中circRNA 进行鉴定。结果如图1所示,GSF-1、 GSF-2、 GSF-3样本中分别预测到4 639,4 603和4 834个circRNAs;OV-1、OV-2、OV-3样本中分别预测到4 388,5 067和5 802个circRNAs。最终GSF组 ( 至少在1个样本中预测到 ) 总共预测到9 979个circRNAs,OV 组总共预测到10 844个circRNAs,其中4 649个circRNA为两者共有。6个样本中预测到的circRNAs 约98%为外显子circRNAs,剩余的为内含子circRNAs(ciRNAs) 。这些circRNAs在染色体1到染色体29 均有分布,其中,染色体1,2,3,10和11 均产生超过800个circRNA。circRNA的长度主要集中在100~2 000 bp之间。同一亲本基因可产生1个至多个circRNA,其中有超过2 000个亲本基因只能产生1个circRNA。

A.circRNA的数量统计;B.circRNA的种类统计;C.circRNA的染色体分布;D.circRNA的长度分布;E.来源同一亲本基因的circRNA数量统计图1 circRNA的鉴定及特征
2.3 circRNA的差异表达分析设置差异circRNA的筛选阈值为:(|log2( fold change ) | ≥ 1,P≤ 0.05。结果如图2所示,与未感染组 (GSF) 相比,ORFV感染组 (OV) 有59个circRNAs表达上调,92个circRNAs表达下调。

A.差异表达circRNA的柱状图;B.差异表达的circRNA的热图图2 差异表达circRNA统计
2.3 差异circRNA的GO富集分析circRNA功能可能与其亲本基因有关,因此,我们对差异circRNA的亲本基因进行了GO富集分析,分别取“生物学过程”(biological process)“分子功能”(molecular function)和“细胞成分”(cellular component) 3个本体的前20个显著富集 (P<0.05 ) 的GO term作图。结果如图3所示,在细胞成分本体中,显著富集的GO term主要是蛋白质的细胞外基质(proteinaceous extracellular matrix)、质膜(plasma membrane),胞外区(extracellular region)等; 在分子功能本体中,显著富集的GO term 主要是生长因子结合(growth factor binding)、电压门控钠通道(voltage-gated sodium channel activity)、整合素结合(integrin binding)等;在生物学过程本体中,显著富集的GO term 主要是炎症应答调控(regulation of inflammatory response)、上皮结构维持(epithelial structure maintenance)、细胞迁移的正向调控(positive regulation of cell migration)、泛素蛋白转移酶活性的正向调控(positive regulation of ubiquitin-protein transferase activity)等。

图3 差异circRNA的GO显著富集分析
2.4 差异circRNA 的KEGG富集分析对差异circRNA亲本基因进行KEGG信号通路富集分析, 取前20个显著富集(P< 0.05 )的信号通路作图。结果如图4所示,差异circRNA主要富集在紧密连接(tight junction)、黏着斑(focal adhesion)、血管平滑肌收缩(vascular smooth muscle contraction)、内吞作用(endocytosis)、细胞因子受体相互作用(cytokine-cytokine receptor interaction)等。
2.5 差异circRNA的验证首先筛选相对高表达 (FPKM>10) ,且3个生物学重复中至少在2个样本中鉴定到的差异circRNA,从中随机挑选3个表达上调的circRNAs(circRNA5112,circRNA7880,circRNA8565)和6个表达下调的circRNA(circRNA998、circRNA1000、circRNA1001、 circRNA1684、circRNA3127、 circRNA4287),设计divergent引物(表2)进行qPCR验证,以GAPDH作为内部对照,以2-△△Ct法计算表达差异。结果表明circRNA7880 表达上调,circRNA1001、 circRNA1684 和circRN3127 表达下调,与circRNA测序结果一致(图5A)。

表2 差异circRNA的qPCR验证
为进一步证明4个候选circRNA为真正的circRNA,分别以cDNA和GSF细胞gDNA为模板,使用divergent引物(扩增circRNA)和convergent 引物(扩增circRNA对应的线性转录本)(表3)进行PCR验证(图5B),PCR产物胶回收后连接到pMD-19T载体,送上海生工公司Sanger测序。结果表明,以cDNA为模板,使用divergent引物扩增得到circRNA片段(*表示),而以gDNA为模板无法扩增得到circRNA;以cDNA或gDNA为模板,使用convergent引物均能扩增出circRNA对应的线性转录本。将扩增得到的circRNA片段连接到pMD-19 T simple 载体,Sanger测序发现4个circRNA中反向剪切位点存在(箭头表示)(图5C)。
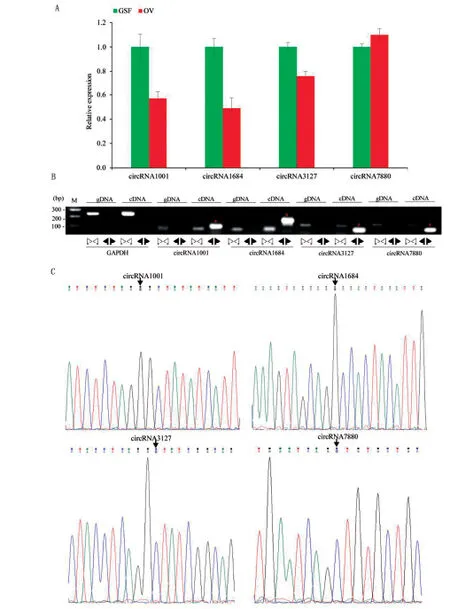
A.qPCR验证差异circRNA的表达; B.以gDNA和cDNA为模板,使用会聚引物(▷◁)和跨接头引物(◀▶)进行PCR扩增。红色星号表示circRNA;C.Sanger测序确定circRNA的反向剪切位点。箭头指示反向剪切位点图5 差异circRNA的qPCR和Sanger测序验证

表3 差异circRNA的验证引物
3 讨论
近年来,orf在至全国呈广泛流行,给养羊业造成重大经济损失。之前对ORFV致病机制的研究主要集中在ORFV毒力基因或免疫调控基因的挖掘。目前已经证明的ORFV毒力基因主要有ORFV132、ORFV127、ORFV125、ORFV119、ORFV117、ORFV112和ORFV020[20-26]。
ORFV的致病机理仍有很多未知,高通量测序成为研究ORFV与宿主的互作的强有力工具。最近,陈达香等[27-29]分别对ORFV感染的绵羊口腔粘膜、鼠源DC细胞和人皮肤成纤维细胞进行转录组测序,发现差异表达基因显著富集在免疫应答、炎症应答、凋亡和细胞周期等多个生物学过程;孔汉金等[30-31]则分别对ORFV感染的GSF细胞和DC细胞做了蛋白组测序,研究ORFV感染对宿主细胞蛋
白表达谱的影响。大量文献表明宿主circRNA 在病毒感染过程中扮演着重要角色。然而,circRNA在ORFV感染中发挥何种作用尚无文献报道。因此我们对ORFV感染的GSF 细胞进行去核糖体circRNA测序,探究ORFV 感染对GSF 细胞circRNA表达谱的影响及circRNA在ORFV感染中的潜在功能。
在感染组和非感染样本中分别鉴定到9 979 和10 844个circRNA, 这与circRNA在哺乳动物中广泛存在的报道相一致[6,11-12]。6个样本中预测到的circRNAs 约98%来源于外显子,而山羊卵泡细胞中的circRNA有 86% 属于内含子circRNA[32], 这充分体现了circRNA 组织和细胞特异性的特点。与未感染GSF细胞相比,ORFV感染组总共得到151个差异表达circRNA,来源于90个亲本基因。为了解circRNA的潜在功能,对差异circRNA进行功能富集分析。GO富集分析表明,差异circRNA显著富集在炎症应答调控、上皮结构维持、细胞迁移的正向调控、泛素蛋白转移酶活性的正向调控等生物学过程。KEGG富集分析表明差异circRNA主要富集在紧密连接、黏着斑、血管平滑肌收缩、内吞作用、细胞因子受体相互作用等信号通路。虽然本研究结果表明circRNA广泛参与宿主对ORFV的应答,但差异circRNA的具体功能,尤其是对ORFV复制的影响,将是今后需要进一步研究的课题。
