K47型肺炎克雷伯菌噬菌体vB_KpnP_ZK2的生物学特性及基因组分析
2022-07-23赵日虹贺蔚纬姜秋杰孙长江顾敬敏韩文瑜吉林大学动物医学学院吉林长春006吉林省动物疫病预防控制中心吉林长春006吉林省畜牧兽医科学研究所吉林长春006
赵日虹,贺蔚纬,姜秋杰,王 楠,孙长江,冯 新,顾敬敏*,韩文瑜* (.吉林大学 动物医学学院,吉林 长春 006;.吉林省动物疫病预防控制中心,吉林 长春 006;.吉林省畜牧兽医科学研究所,吉林 长春 006)
肺炎克雷伯菌(K.pneumoniae)是最常见的机会致病性病原体之一,通常会引起多种医院获得性感染以及社区获得性感染。当机体免疫力下降时,肺炎克雷伯菌可引发一系列病理变化,如肺炎、乳腺炎、子宫炎等化脓性炎症甚至败血症[1]。目前随着养殖业和临床大量且无节制的滥用抗生素,肺炎克雷伯菌已趋向于多重耐药(MDR)[2],耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistantK.pneumoniae,CRKP)已经受到世界卫生组织的“重点关注”,成为世界上治疗最为困难的革兰阴性菌之一[3]。耐药细菌的不断出现,给临床治疗用药选择造成极大困难,研发新型抑菌药物迫在眉睫。
噬菌体作为细菌的天然杀手,能特异性感染并杀灭细菌。目前,噬菌体疗法越来越多地被报道为MDR细菌感染患者的最后希望,甚至被用于治疗COVID-19感染者的继发性细菌感染[4]。在治疗肺炎克雷伯菌感染的案例中,噬菌体鸡尾酒和抗生素联合疗法成功治愈由MDR 肺炎克雷伯菌引起的多灶性尿道感染[5]。噬菌体KPJH46和抗生素通过静脉注射联合治疗,成功挽救一位饱受困扰11年之久的人工膝关节感染肺炎克雷伯菌患者[6]。噬菌体良好的治疗效果,显示出其在防控细菌感染方面的巨大潜力。
本研究利用耐碳青霉烯类K47型肺炎克雷伯菌KPN-1从污水中分离得到一株新型裂解性噬菌体,并对其生物学特性及全基因组序列进行分析,为肺炎克雷伯菌噬菌体及耐碳青霉烯类肺炎克雷伯菌进一步研究奠定基础。
1 材料与方法
1.1 材料
1.1.1菌株来源与鉴定 肺炎克雷伯菌KPN-1分离自吉林大学第一医院的临床样本(中国,长春),并通过16S rRNA基因鉴定引物F(5′-AGAGTTTGATCCTGGCTCAG-3′)和R (5′-ACGGCTACCTTGTTACGACTT-3′)对肺炎克雷伯菌进行初步鉴定[7]。通过对荚膜多糖合成相关基因wzi[8](F:5′-GTGCCGCGAGCGCTTTCTATCTTGGTATTCC-3′,R:5′-GAGAGCCACTGGTTCCAGAA-CTTCACCGC-3′)进行PCR扩增,将测序得到的序列上传至https://bigsdb.pasteur.fr/klebsiella/klebsiella.html网站进行结果比对,鉴定KPN-1的血清型。
1.1.2主要试剂和仪器 胰蛋白胨及酵母提取物购自OXOID 公司;0.22 μm一次性针头过滤器购于Merck Millipore公司; DNaseⅠ、RNase A购于Sigma-Aldrich公司;病毒基因组提取试剂盒购自Doraville公司(美国);透射电子显微镜购于Hitachi公司。
1.2 方法
1.2.1噬菌体的分离纯化 采集长春城市污水样品,以KPN-1为宿主菌进行噬菌体分离,具体步骤:用纱布过滤后的污水样品配置LB培养基,将1 mL对数期(D600 nm=0.6~0.8)的KPN-1菌液与之混合。将混合物置于37℃过夜培养,12 000×g离心2 min, 收集上清并通过0.22 μm 滤器进行过滤,获得噬菌体原液并保存。利用空斑法[9]检测噬菌体,并通过双层平板法[10]对噬菌体进行纯化,重复双层平板试验,挑取4~5次单个噬菌斑,将噬菌体纯化至噬菌斑大小一致,将获得的噬菌体命名为vB_KpnP_ZK2(简称ZK2)
1.2.2噬菌体的电镜观察 将纯化后的ZK2进行大量扩增并用PEG-8000进行沉淀,离心回收沉淀的噬菌体颗粒,加入SM液充分洗涤沉淀后,用氯仿抽提浓缩。取1滴浓缩后的噬菌体悬液滴在铜网上,15 min后用滤纸吸去多余的液体,用 2%的磷钨酸(PTA)染色1~2 min,干燥后使用透射电镜观察。
1.2.3噬菌体ZK2最佳感染复数 (MOI) 的测定 将培养至对数期的KPN-1调整为108CFU/mL,将噬菌体与KPN-1按照一定比例(分别为MOI=0.000 000 001,0.000 000 01,0.000 000 1,0.000 001,0.000 01,0.000 1,0.001,0.01,0.1,1)进行混合,转接到LB液体培养基中,37℃培养8 h。将培养液4℃,12 000×g离心15 min,用0.22 μm 滤器对上清液进行过滤得到噬菌体增殖液,进行10倍倍比稀释后,利用双层平板法测定噬菌体滴度,以确定噬菌体的最佳 MOI,试验重复3 次。
1.2.4噬菌体的一步生长曲线测定 将培养至对数期的KPN-1与ZK2按照MOI=0.001的比例混合,于37℃孵育2 min后,4℃,10 000×g离心10 min,用10 mL LB液体培养基将沉淀悬起,悬液于37℃振荡培养,在培养的0,1,2,3,5,10,15,20,25,30,40,50,60 min各取1次样品,利用双层平板法测定噬菌体的滴度,试验进行3次重复,绘制出噬菌体感染细菌的一步生长曲线。
1.2.5噬菌体的宿主谱测定 将ZK2滴度调整为108PFU/mL,选择多株肺炎克雷伯菌,通过空斑法和双层平板法对ZK2的宿主谱进行测定,观察是否形成空斑或噬菌斑,若形成则说明ZK2对该菌有裂解活性。共选取26株肺炎克雷伯菌进行测试,全部分离菌株均为本实验室保存。
1.2.6药敏试验 将对ZK2敏感的肺炎克雷伯菌接种到LB液体培养基,37℃振荡培养4~6 h。将菌液调整为麦氏浊度为0.5后,用棉签将其均匀涂布LB固体平板,干燥后通过纸片扩散法进行药物敏感试验。耐药性评价参考美国临床实验标准。
1.2.7噬菌体基因组的提取和测序分析 使用病毒基因组提取试剂盒(Omega Bio-Tek Inc.,美国)从1.2.1浓缩的噬菌体中提取基因组,并通过Illumina Hiseq 2500测序平台进行测序,利用 Newbler v.2.8进行序列组装[11]。使用GeneMarks软件预测噬菌体ZK2潜在的开放阅读框架(ORF)[12]。通过NCBI的PSI-BLAST(阈值=0.000 1)(https://blast.ncbi.nlm.nih.gov/blast.cgi)搜索比较,注释ZK2中编码区域的功能[13]。使用CLC Main Workbench软件(CLC Bio-Qiagen,Aarhus,Denmark)生成噬菌体基因组的示意图。 使用PHYLIP软件绘制噬菌体DNA聚合酶的系统发育树[14]。
2 结果
2.1 噬菌体的分离和纯化利用KPN-1从污水中分离出1株噬菌体,纯化培养24 h后,获得周围有半透明晕环、中心透亮的噬菌斑(图1),表明该噬菌体具有较强的裂解活性,可能具有产生解聚酶的能力,将其命名为vB_KpnP_ZK2(简称ZK2)。

图1 噬菌体ZK2 纯化后在双层板上产生的噬斑
2.2 噬菌体的形态学特征利用透射电子显微镜进行ZK2的形态学观察。电镜下可见ZK2具有一个二十面体的头部以及一个短的不可收缩的尾部(图2),这些特点表明ZK2 属于有尾噬菌体目,短尾噬菌体科。进一步对其进行测量,发现ZK2的头部直径为(60 ± 5) nm,尾部长(5 ± 5) nm。

图2 噬菌体ZK2 的透射电镜图(比例尺100 nm)
2.3 噬菌体的最佳MOI将ZK2与宿主菌KPN-1按一定比例混合,当以MOI为 0.000 000 01 时,ZK2产生最大滴度(图3),表明 0.000 000 01是ZK2的最佳MOI。
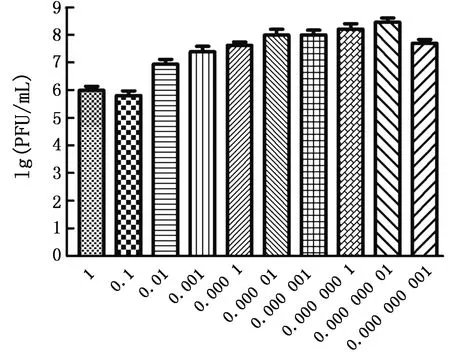
图3 噬菌体ZK2的感染复数
2.4 噬菌体的一步生长曲线ZK2的一步生长曲线如图4所示,在MOI为0.001的条件下, ZK2的潜伏期约为2 min,大约50 min达到生长平台阶段,每个感染细胞的暴发量约为186 PFU/cell。
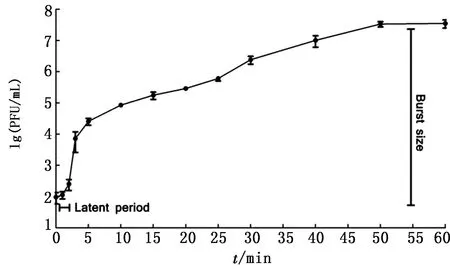
图4 噬菌体ZK2的一步生长曲线
2.5 噬菌体的宿主谱利用空斑法和双层琼脂平板法测定ZK2的宿主谱,结果显示在所有26株测试的肺炎克雷伯菌菌株的平板上,有6株能产生空斑和噬菌斑,且这6株肺炎克雷伯菌均为K47血清型(表1),表明ZK2对K47血清型的肺炎克雷伯菌有高度特异性。

表1 噬菌体ZK2的裂解谱
2.6 肺炎克雷伯菌的药敏试验对能产生空斑和噬菌斑的6株肺炎克雷伯菌进行药敏试验,结果显示大部分菌株对多黏菌素、氟本尼考和复方新诺明表现出敏感性,全部菌株均对青霉素、红霉素、四环素、阿莫西林、氨苄西林和强力霉素表现出耐药性(表2)。值得注意的是,这6株K47型肺炎克雷伯菌中有5株对美罗培南和亚胺培南表现出耐药性,表明这5株菌为耐碳青霉烯类肺炎克雷伯菌。

表2 ZK2敏感菌株对抗生素的耐药性评价
2.7 噬菌体的全基因组分析对噬菌体基因组进行测序和拼接,将噬菌体ZK2的完整基因组序列上传至 GenBank(OL409034),并对全基因组进行分析。结果表明ZK2的基因组类型为双链DNA,长度为40 946 bp,G+C的含量52.27%。共具有48个ORF;所有的ORF包括3种不同的起始密码子,其中以ATG作为起始密码子的为89.6% (43/48),以GTG作为起始密码子的为8.3% (4/48),另外2.1% (1/48) 以TTG作为起始密码子,所有的ORF的编码方向均为正向。
利用NCBI BLAST程序对噬菌体的全基因组进行比较分析(表3),结果表明ZK2在全基因水平和肺炎克雷伯菌噬菌体SH-KP152226同源性最高(同源性92.57%、覆盖率93%),此外,肺炎克雷伯菌噬菌体IME304、066015、066013和vB_KpnP_IME205与ZK2也有90%以上的同源性,覆盖率在90%以上。为进一步确定噬菌体之间的亲缘关系,选取在噬菌体进化过程中相对保守的DNA聚合酶绘制进化树,以大肠杆菌噬菌体T7作为外群,利用软件进行进化树绘制(图5)。从图中可以看出ZK2和肺炎克雷伯菌噬菌体SH-Kp 152410、066056以及P509亲缘关系最近,其次是vB_KpnP_KpV767。

图5 基于DNA聚合酶的系统发育树
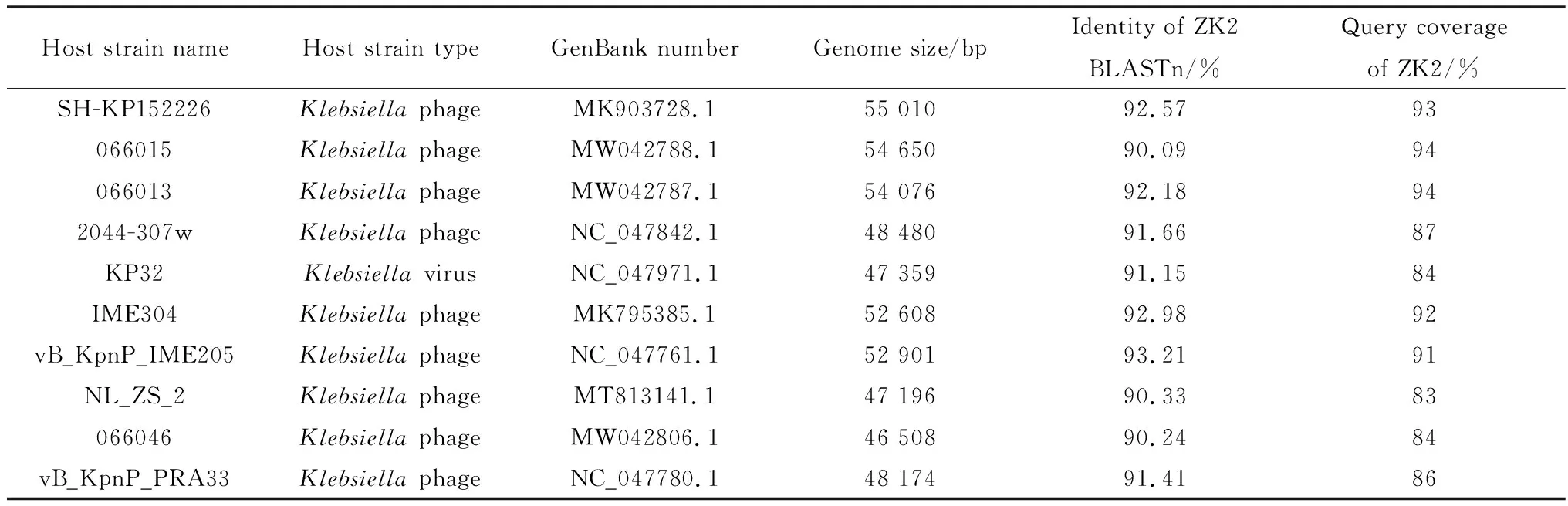
表3 噬菌体ZK2全基因组同源性比较
利用NCBI对ZK2的ORF功能进行初步的预测和分析,同时利用软件对噬菌体ZK2 的基因功能绘制图谱(图6)。在已知的数据库中,有30个ORF与数据库中已知功能的序列高度相似,表明这些蛋白可能具有相同的对应功能,剩余的17个ORF注释为假定蛋白,此外,ORF20与数据库中任何病毒和原核生物的蛋白均没有同源性。所有预测的功能蛋白中,主要参与核酸代谢和复制、裂解、DNA包装以及结构组成,其中预测为尾丝蛋白的ORF42与K47型肺炎克雷伯菌噬菌体SH-KP152226的解聚酶Depo42(QDF14644.1)有较高的同源性(98%)。同时,在预测分析过程中未发现ZK2有与耐药性或溶原性相关的基因序列,说明ZK2具有作为肺炎克雷伯菌治疗药物的潜力。
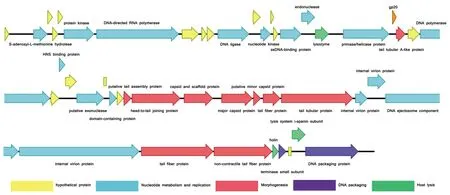
图6 噬菌体ZK2的蛋白功能图谱
3 讨论
目前,肺炎克雷伯菌耐药问题日渐严重,全国细菌耐药监测网在2014-2019年细菌耐药性监测报告中指明肺炎克雷伯菌对环丙沙星、左氧氟沙星、亚胺培南和美罗培南的耐药率在不断升高,对临床及兽用常见的头孢曲松和头孢噻肟的耐药率也都高达30%以上[2],逐年升高的耐药率给肺炎克雷伯菌感染的治疗带来巨大威胁。面对多重耐药的肺炎克雷伯菌,噬菌体疗法已多次成功挽救患者,成为一种可行的抗生素替代药物。
在本研究中,利用肺炎克雷伯菌KPN-1成功分离获得一株具有高效裂解活性的新型噬菌体vB_KpnP_ZK2,对其生物学特性及基因组进行分析。对ZK2敏感的肺炎克雷伯菌均为K47型肺炎克雷伯菌且大多对碳青霉烯类抗生素耐药。有研究发现,K47型是我国耐碳青霉烯酶类肺炎克雷伯菌中最常见的荚膜血清型之一,同时,与碳青霉烯类敏感肺炎克雷伯菌相比,耐碳青霉烯类肺炎克雷伯菌的致死率更高[15]。从公共安全角度思考,阻止耐碳青霉烯类肺炎克雷伯菌的传播至关重要,而噬菌体作为高度特异性的高效杀菌制剂值得人们的关注。潜伏期是体现噬菌体特性最重要的生长阶段之一。一步生长曲线结果显示ZK2具有极短的潜伏期(2 min)和较短的裂解周期(50 min),能够快速吸附细菌细胞并裂解细菌,同时暴发量约为186 PFU/cell,体现出ZK2的高效性和良好的杀菌活性。ZK2的噬菌斑周围形成半透明晕环,表明ZK2可能在裂解细菌的过程中形成具有清除细菌荚膜多糖作用的解聚酶。噬菌体的尾纤 (tail fiber) 或尾刺 (tail spikes) 蛋白通常表现出噬菌体的荚膜解聚酶活性[16]。本研究通过对ZK2全基因组进行分析发现,ORF42编码噬菌体的尾丝蛋白,并且和已证实为噬菌体SH-KP152226解聚酶的Depo42有高度同源性,表明ORF42可能是ZK2的解聚酶。同时,ZK2的基因组中不存在与细菌毒力、抗生素耐药以及溶原相关的基因,这些特点都表明 ZK2有作为耐碳青霉烯酶类K47型肺炎克雷伯菌抗菌制剂的潜力。
综上所述,噬菌体vB_KpnP_ZK2 是一株具有高效裂解活性和高度特异性的短尾噬菌体,能够有针对性的裂解K47型肺炎克雷伯菌,在噬斑周围形成由于解聚酶作用而产生的半透明光晕,值得对其进一步深入研究。本研究为使用噬菌体或噬菌体衍生蛋白治疗耐碳青霉烯酶类肺炎克雷伯菌感染提供了参考依据。
